《免疫学》:发现肿瘤囚禁免疫细胞的窝点!华人科学家发现,瘤内缺氧区域吸引和封闭免疫细胞,并进行免疫抑制重编程
2023-07-19
免疫疗法
Hongyan Zou等人揭示,在胶质母细胞瘤(GBM)中,缺氧区域是肿瘤相关巨噬细胞分布状态和免疫抑制的主要驱动因素。
以虚假信息作为诱饵招募人们前往,随后限制其人身自由,进行洗脑或胁迫,诱导实施犯罪行为并利用其吸引更多不明真相的人前来……
自从前几年“这里是缅甸北部”的网络热梗火起来之后,现实中的残酷案例接连击破美好的假象。面对极具诱惑力的虚假薪资待遇,人们欣然前往,却不料正中诈骗集团的圈套,反倒成为犯罪“工具人”。
美国西奈山伊坎医学院的Hongyan Zou和她的同事们发现,在胶质母细胞瘤(GBM)中,缺氧区域的肿瘤细胞会招募肿瘤相关巨噬细胞(TAMs)和细胞毒性T细胞(CTLs),限制其分布在缺氧区域内,并对其重编程以表达免疫抑制特征,而这会吸引来更多的TAMs和CTLs。

Preview
来源: 生物谷
论文首页截图
胶质母细胞瘤(GBM)是最常见的原发性脑肿瘤之一,因其免疫活性较低、属于“冷肿瘤”,导致相关免疫疗法面临困境。
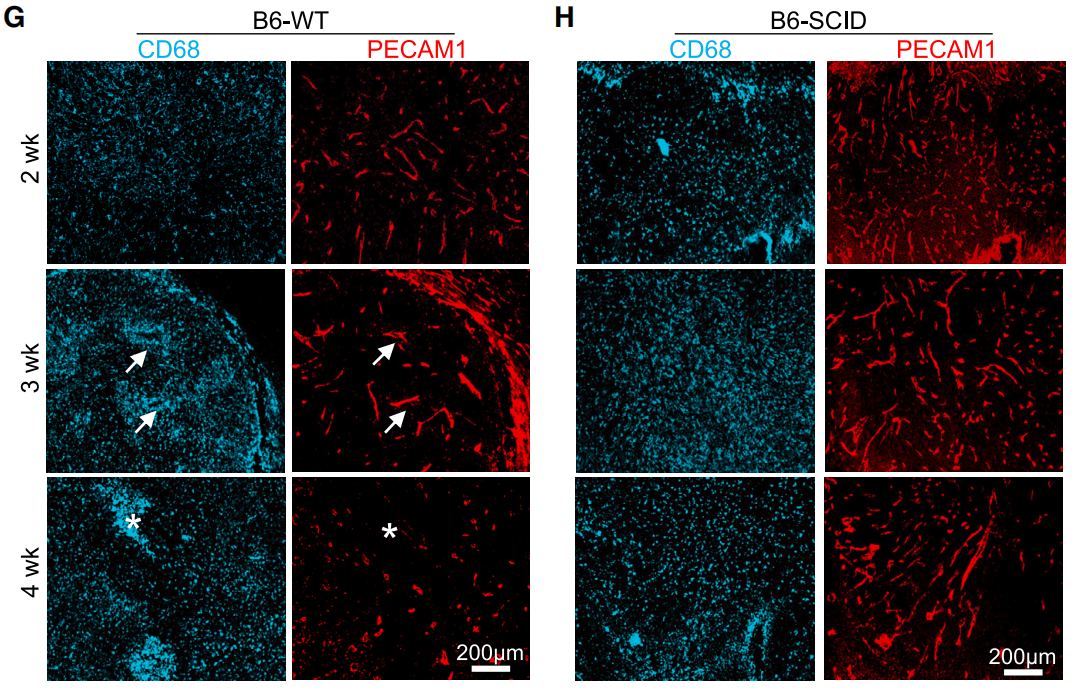
相比之下,缺乏功能性T细胞、B细胞的免疫缺陷小鼠,肿瘤内血管保持密集和规律的排列状态,且TAMs分布均匀,没有明显的聚集现象。
也就是说,TAMs的空间分布与肿瘤血管重塑密切相关,而适应性免疫加剧了血管异常。
Preview
来源: 生物谷
TAMs分布与血管重塑相关
由于血管异常通常会导致低氧供应,研究者们进一步探索TAMs的分布是否受缺氧因素的影响。
进一步研究表明,缺氧区域就好比泥潭,让TAMs陷入其中难以脱身。环绕在缺氧区域周围肿瘤细胞形成花环状聚集,即假栅栏状排列(pseudopalisades),将TAMs包围起来,并限制TAMs离开异常血管附近的缺氧区域。
Preview
来源: 生物谷
TAMs被肿瘤细胞围在缺氧区域里
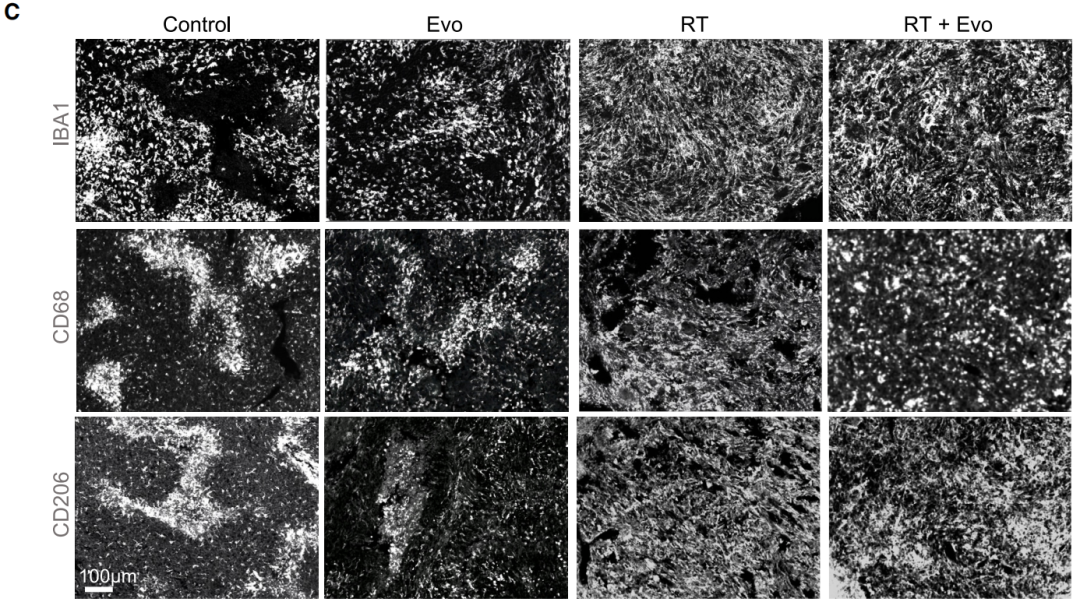
随后的研究结果显示,通过放疗或缺氧激活前体药物(Evofosfamide)靶向破坏肿瘤内缺氧区域,可以“营救”TAMs、改变TAMs的分布模式,减少小鼠肿瘤负荷。联合治疗的效果更好。
Preview
来源: 生物谷
治疗后TAMs分布均匀
围困在肿瘤缺氧区域期间,TAMs究竟经历了什么?
一方面,缺氧环境下,肿瘤细胞表达与免疫抑制、缺氧相关的基因特征,免疫系统的正调控因子表达下调、负调控因子表达上调,代谢、血管生成、趋化因子等通路的基因表达模式发生改变。
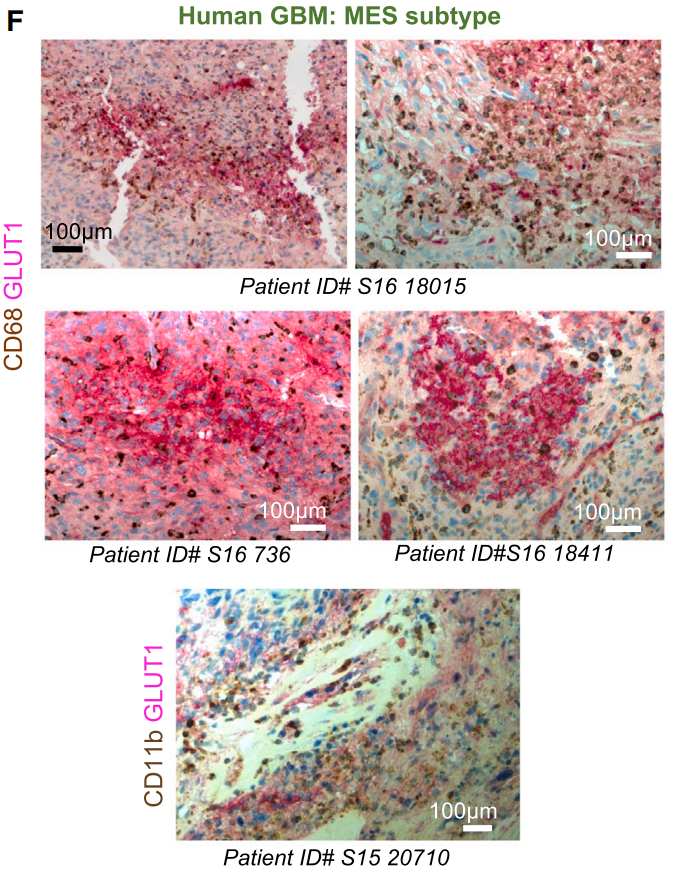
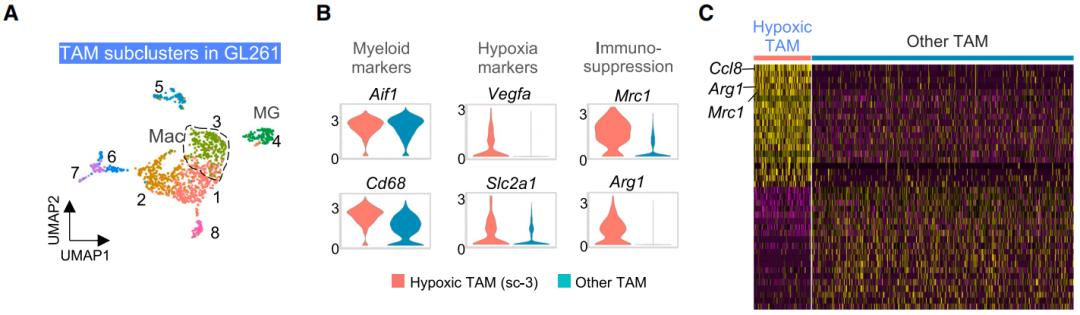
另一方面,缺氧环境中的TAMs可分为8个亚群,每个亚群具有不同的功能特征,例如促炎反应、增殖、代谢、T细胞激活等。其中,一个与血管生成相关的TAMs亚群(sc-3)表现出缺氧相关基因特征以及免疫耐受标志物。除此之外,肿瘤缺氧区域还“囚禁”着细胞毒性T细胞(CTLs),CTLs表现缺氧相关和免疫耗竭特征。
这些表明,缺氧环境可能改变了这群免疫细胞的功能,使其丧失原本的抗肿瘤免疫作用。
Preview
来源: 生物谷
肿瘤小鼠或患者的瘤内缺氧区域中的TAMs亚群,部分亚群表现出免疫耐受特征
引诱,洗脑,钓来其它同胞好友。熟悉的套路,妥妥的肿瘤诈骗窝点。
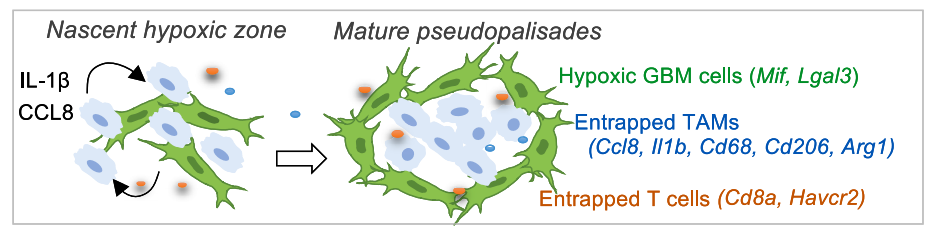
Preview
来源: 生物谷
缺氧区域的肿瘤细胞钓来TAMs,并利用其形成完整的缺氧区域结构
总体来说,Hongyan Zou等人揭示,在胶质母细胞瘤(GBM)中,缺氧区域是肿瘤相关巨噬细胞分布状态和免疫抑制的主要驱动因素。
更多内容,请访问原始网站
文中所述内容并不反映新药情报库及其所属公司任何意见及观点,如有版权侵扰或错误之处,请及时联系我们,我们会在24小时内配合处理。
机构
-药物
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


