首款!武田创新酶替代疗法获FDA批准,治疗这种死亡率超90%的疾病
2023-11-10
优先审批快速通道孤儿药临床结果临床3期
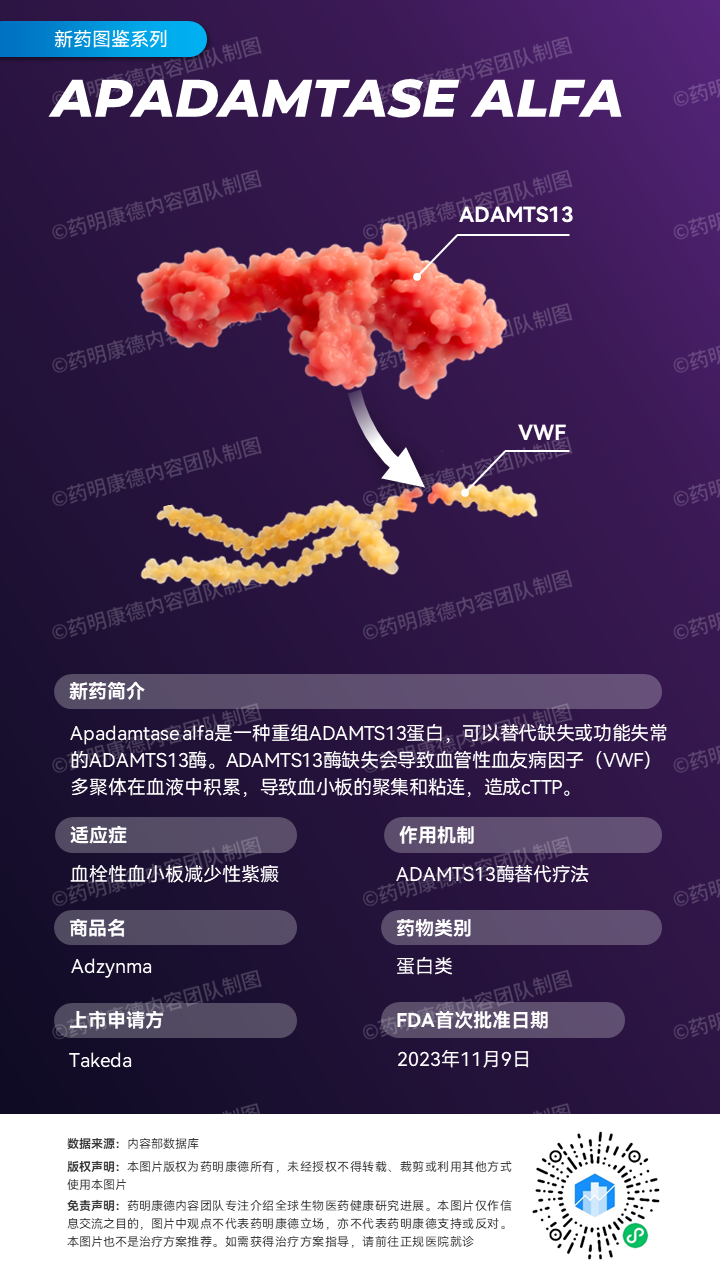
武田(Takeda)宣布美国FDA批准其酶替代疗法Adzynma(apadamtase alfa)的上市申请。根据新闻稿,这是FDA所批准用于治疗先天性血栓性血小板减少性紫癜(cTTP)成人和儿童患者的首款酶替代疗法(ERT)。

Preview
来源: 药明康德
这一申请得到了来自cTTP中首个随机对照试验的疗效、药代动力学、安全性和耐受性数据的支持,并拥有积极的长期安全性和有效性数据。这项3期试验旨在评估TAK-755在多个临床相关终点上的益处。武田在2023年1月宣布的中期结果显示,与基于血浆的疗法相比,TAK-755降低血小板减少事件的发生率达60%(95% CI,30%-70%),这是cTTP中疾病活动的重要指标,也是最经常观察到的临床症状。
安全性方面,在接受TAK-755治疗的受试者中发生治疗相关不良事件的比率显著低于接受接受血浆治疗的受试者(8.9%与47.7%)。此外,一项3b期延续性研究的中期分析结果表明,TAK-755预防疗法的安全性良好,没有出现中和抗体。
Preview
来源: 药明康德
TAK-755是一款ADAMTS13重组蛋白,可以替代缺失或功能失常的ADAMTS13酶,这种酶的缺乏是造成cTTP的根本病因。通过补充ADAMTS13酶功能,可以有效改善cTTP的急、慢性症状,以及其他由ADAMTS13缺陷引起的合并症,从而改善cTTP患者的生活质量和寿命。此前,TAK-755还获得了美国FDA的快速通道资格和孤儿药资格,并在今年5月获得FDA的优先审评资格,用于预防和治疗cTTP。
资料:[1] FDA Approves First Treatment for Patients with Rare Inherited Blood Clotting Disorder. Retrieved November 9, 2023 from https://www.prnewswire.com/news-releases/fda-approves-first-treatment-for-patients-with-rare-inherited-blood-clotting-disorder-301983923.html
[2] U.S. Food & Drug Administration Grants Priority Review of TAK-755 for the Treatment of Congenital Thrombotic Thrombocytopenic Purpura (cTTP). Retrieved November 8, 2023, from https://www.businesswire.com/news/home/20230516006066/en
内容来源于网络,如有侵权,请联系删除。
靶点
热门报告
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。



