预约演示
更新于:2025-06-04
Luxdegalutamide
更新于:2025-06-04
概要
基本信息
原研机构 |
非在研机构- |
最高研发阶段临床2期 |
首次获批日期- |
最高研发阶段(中国)- |
特殊审评- |
登录后查看时间轴
结构/序列
分子式C45H54FN7O6 |
InChIKeyRDPPBRKNBBXPNZ-FMPIRMQTSA-N |
CAS号2750830-09-0 |
关联
1
项与 Luxdegalutamide 相关的临床试验NCT05067140
A Phase 1/2 Open-Label, Dose-Escalation and Cohort Expansion Clinical Trial to Evaluate the Safety, Tolerability, Pharmacokinetics, and Pharmacodynamics of ARV-766 Monotherapy and in Combination With Abiraterone in Patients With Metastatic Prostate Cancer
A Phase 1/2 study to evaluate the safety and efficacy of ARV-766 given by mouth alone or in combination with abiraterone in men with metastatic prostate cancer.
开始日期2021-09-02 |
100 项与 Luxdegalutamide 相关的临床结果
登录后查看更多信息
100 项与 Luxdegalutamide 相关的转化医学
登录后查看更多信息
100 项与 Luxdegalutamide 相关的专利(医药)
登录后查看更多信息
1
项与 Luxdegalutamide 相关的文献(医药)2022-12-22·Journal of medicinal chemistry1区 · 医学
A Comprehensive Overview of Small-Molecule Androgen Receptor Degraders: Recent Progress and Future Perspectives
1区 · 医学
Review
作者: Xiang, Hua ; Luo, Guoshun ; Ha, Si
Prostate cancer (PC), the second most prevalent malignancy in men worldwide, has been proven to depend on the aberrant activation of androgen receptor (AR) signaling. Long-term androgen deprivation for the treatment of PC inevitably leads to castration-resistant prostate cancer (CRPC) in which AR remains a crucial oncogenic driver. Thus, there is an urgent need to develop new strategies to address this unmet medical need. Targeting AR for degradation has recently been in a vigorous development stage, and accumulating clinical studies have highlighted the benefits of AR degraders in CRPC patients. Herein, we provide a comprehensive summary of small-molecule AR degraders with diverse mechanisms of action including proteolysis-targeting chimeras (PROTACs), selective AR degraders (SARDs), hydrophobic tags (HyT), and other AR degraders with distinct mechanisms. Accordingly, their structure-activity relationships, biomedical applications, and therapeutic values are also dissected to provide insights into the future development of promising AR degradation-based therapeutics for CRPC.
134
项与 Luxdegalutamide 相关的新闻(医药)2025-04-28
·精准药物
近年来,靶向蛋白降解(Targeted Protein Degradation, TPD)作为一种新兴的治疗策略,在癌症治疗领域展现出巨大潜力。TPD的核心理念是通过重新编程细胞内的蛋白质降解机制,实现对特定致病蛋白的精准降解。它与传统的抑制剂类药物不同,并非直接阻断蛋白质的功能,而是借助细胞自身的降解系统——泛素 - 蛋白酶体系统(Ubiquitin–Proteasome System, UPS),清除目标蛋白质。这一创新性的策略不仅能够提高药物的选择性和疗效,还有望克服传统治疗手段的诸多局限。泛素-蛋白酶体系统(UPS)UPS是细胞内主要的蛋白质降解系统,负责80-90%的细胞内蛋白质的降解。它通过泛素分子标记需要降解的蛋白质,随后将其送入蛋白酶体进行分解。这一过程高度复杂且精细调控。E3泛素连接酶在其中扮演着关键角色,它能够特异性识别目标蛋白,并将其与泛素分子连接起来。如图1所示:首先,泛素分子通过E1激活酶被激活,随后转移到E2结合酶上,最终在E3连接酶的介导下,泛素分子被连接到目标蛋白上。被泛素标记的蛋白质随后被送入26S蛋白酶体,进行降解。这一系统不仅负责清除受损、错误折叠的蛋白质,还在细胞周期调控、信号传导等生命活动中发挥着关键作用。例如,在缺氧条件下,缺氧诱导因子-1α(HIF-1α)能够逃避免泛素化降解,从而启动一系列适应缺氧的生理反应。这种对蛋白质降解的精确调控,为TPD技术提供了理论基础。图1.泛素-蛋白酶体系统的机制PROTACs和分子胶降解剂目前,TPD领域主要分为两大类技术:异双功能蛋白降解靶向嵌合体(PROTACs)和分子胶降解剂(Molecular Glue Degraders, MGDs)。这两类技术虽然在化学结构和作用机制上有所不同,但都旨在通过促进目标蛋白与E3连接酶之间的相互作用,诱导目标蛋白的泛素化和降解。PROTACs:PROTACs是由两个独立的配体通过化学链连接而成的异双功能分子。其中一个配体能够结合目标蛋白,另一个配体则能够结合E3连接酶。当PROTACs与目标蛋白和E3连接酶同时结合时,会形成一个三元复合物,使目标蛋白靠近E3连接酶,从而促进泛素转移和蛋白质降解。图2清晰地展示了PROTACs的作用机制。以dBET6为例,它能够将BET蛋白(BRD2–BRD4)与CUL4–DDB1–CRBN E3连接酶复合体连接起来,从而实现对BET蛋白的降解。目前,已有多种PROTACs进入临床试验,如针对雄激素受体(AR)的ARV-110和ARV-766,以及针对雌激素受体(ER)的AC682和ARV-471等,这些药物在前列腺癌和乳腺癌的治疗中展现出良好的应用前景。图2.PROTACs的作用机制分子胶降解剂:与PROTACs不同,分子胶降解剂通常不直接与目标蛋白或E3连接酶单独结合,而是通过增强目标蛋白与E3连接酶之间的现有表面互补性,促进它们之间的相互作用。例如,免疫调节亚胺药物(IMiDs)如沙利度胺、来那度胺和泊马度胺就是典型的分子胶降解剂。它们能够增强CRBN(Cereblon)E3连接酶与一系列目标蛋白(如IKZF1和IKZF3)之间的相互作用,导致目标蛋白的降解。图3展示了分子胶降解剂的作用方式。以pomalidomide为例,它通过增强CRBN与目标蛋白之间的亲和力,促进目标蛋白的泛素化和降解。目前,来那度胺和泊马度胺等分子胶降解剂已在多发性骨髓瘤的治疗中获得广泛应用,并取得了显著的临床效果。图3.分子胶降解剂的作用机制新兴的降解模式除了PROTACs和分子胶降解剂,科学家们还不断探索新的降解策略,以进一步拓展TPD技术的应用范围。以下是一些新兴的降解模式:间接降解剂:巧妙的 “间接引导者”间接降解剂通过将目标蛋白的相互作用蛋白招募到E3连接酶,从而间接实现目标蛋白的降解。例如,CR8能够将CDK12招募到DDB1适配器上,CDK12进而招募细胞周期蛋白K到DCAF底物受体通常占据的位置,诱导细胞周期蛋白K 的泛素化(图4)。图4.间接降解剂的作用机制分子内二价胶:创新的“分子内桥梁”分子内二价胶(Intramolecular Bivalent Glues, IBGs)通过同时结合目标蛋白的两个结构域,将其排列成能够增强与E3连接酶相互作用的构象,从而实现目标蛋白的降解。例如,IBG1能够同时结合BRD4的两个溴结构域BD1和BD2,并将其排列成与DCAF16 E3连接酶高亲和力结合的构象(图5)。这一创新的降解模式为设计新型TPD分子提供了新的思路。图5.分子内二价胶的作用机制降解尾:巧妙的“化学修饰”降解尾是指通过在目标蛋白结合剂上添加简单的化学基团,将其转化为高效的降解剂。例如,GNE-0011通过在其表面暴露区域添加一个轻度亲电的丙炔胺尾,实现了对BRD2和BRD4的降解(图6)。这种策略为快速筛选和优化降解剂提供了便利。图6.引入降解尾的作用机制核激素受体降解剂:精准的“受体调控”核激素受体降解剂通过与核激素受体结合,诱导受体的构象变化,从而触发其泛素化和降解。例如,选择性雌激素受体降解(SERDs)如fulvestrant和elacestrant能够通过置换雌激素受(ER)配体结合和激活功能2(AF2)结构域中的螺旋12,触发ER通过RNF111介导的途径降解(图7)。这些降解剂在乳腺癌的治疗中展现出良好的应用前景。图7.核激素受体降解剂的作用机制SUMO依赖性降解:独特的“修饰触发”SUMO依赖性降解通过诱导目标蛋白的SUMO修饰,使其被SUMO靶向E3连接酶(STUbLs)识别并泛素化降解。例如,WRN抑制剂HRO671能够诱导WRN蛋白发生180°的构象变化,被SUMO E3连接酶PIAS4识别并泛素化,随后通过蛋白酶体降解(图8)。这一降解模式为研究蛋白质修饰与降解的关系提供了新的视角。图8.SUMO依赖性降解的作用机制抑制剂诱导的蛋白不稳定化:巧妙的 “功能干扰”一些原本设计为抑制剂的小分子化合物,通过诱导目标蛋白的不稳定化,促使其降解。例如,BI-3802能够诱导BCL6聚合形成丝状结构,增强其与E3连接酶 SIAH1的相互作用,从而实现BCL6的降解(图9)。这种现象为发现新型降解剂提供了意外的线索。图9.抑制剂诱导的蛋白不稳定化的作用机制临床应用:与传统的抑制剂类药物相比,TPD药物具有以下显著优势:(一)更高的选择性和效力:通过诱导目标蛋白与E3连接酶之间的特异性相互作用TPD药物能够实现对目标蛋白的精准降解,减少对非目标蛋白的影响。例如SD-36能够选择性降解STAT3,尽管其亲本抑制剂SI-109对STAT1和STAT4也具有一定的亲和力。(二)低剂量和持续效果:TPD药物通过催化机制发挥作用,能够在亚化学计量的情况下诱导目标蛋白的降解,从而在较低剂量下实现持久的治疗效果。例如,ACBI3 能够在降解13种常见的KRAS突变体时,展现出比其亲本抑制剂更强的效力和更持久的MAPK信号抑制作用。(三)克服传统治疗的耐药性:TPD药物能够同时破坏目标蛋白的多种功能,包括其获得的新功能(如BTK的新异性支架功能),从而克服传统治疗的耐药性。例如,PROTACs如NX-2127和NX-5948能够降解BTK,有效杀死对抑制剂耐药的细胞。临床试验中的 TPD 药物:目前,多项 TPD 药物的临床试验正在如火如荼地进行中(见下表)。目前TPD技术面临的挑战:(一)药物设计的复杂性TPD药物的设计需要综合考虑目标蛋白与E3连接酶之间的相互作用、药物的化学稳定性和生物利用度等多个因素。例如,PROTACs的设计通常需要在目标蛋白和E3连接酶之间找到合适的化学连接链,以确保三元复合物的稳定性和降解效率。此外,药物的理化性质(如分子量、溶解性、渗透性等)也会影响其药代动力学和药效学特性。(二)耐药性的产生与传统药物类似,TPD药物也可能面临耐药性问题。例如,CRBN基因的突变可能导致来那度胺等分子胶降解剂的耐药性。此外,E3连接酶复合物的其他亚基发生突变或表达量变化,也可能影响TPD药物的疗效。(三)药物的药代动力学和药效学特性TPD药物的药代动力学和药效学特性(如吸收、分布、代谢、排泄等)对其临床应用具有重要影响。例如,PROTACs由于其较大的分子量和复杂的化学结构,往往具有较差的口服生物利用度和血脑屏障穿透能力。这些特性可能限制药物在体内的分布和作用时间,影响其治疗效果。(四)安全性和毒性问题TPD药物的安全性和毒性也是需要重点关注的问题。由于TPD药物通过诱导目标蛋白的降解发挥作用,其潜在的非目标效应(如对其他蛋白质的非特异性降解)可能导致不良反应。此外,药物对E3连接酶的过度激活或抑制也可能干扰细胞内的正常蛋白质稳态,引发毒性反应。结论靶向蛋白降解技术作为癌症治疗领域的一项重大突破,为患者带来了新的希望和选择。从PROTACs和分子胶降解剂的经典模式,到新兴的降解策略,TPD技术不断拓展着我们的视野和可能性。尽管其在发展过程中面临诸多挑战,但通过科学家们的不懈努力和创新,我们有理由相信,TPD技术将在未来的癌症治疗中扮演越来越重要的角色,开启癌症治疗的新篇章。原文链接:https://doi-org.libproxy1.nus.edu.sg/10.1038/s41568-025-00817-8声明:发表/转载本文仅仅是出于传播信息的需要,并不意味着代表本公众号观点或证实其内容的真实性。据此内容作出的任何判断,后果自负。若有侵权,告知必删!长按关注本公众号 粉丝群/投稿/授权/广告等请联系公众号助手 觉得本文好看,请点这里↓
蛋白降解靶向嵌合体
2025-04-09
·医药速览
前 言新药研发不仅需要付出高昂的时间和资金成本,而且面临高达90%的失败率,其中,药物的理化性质是影响成功率的关键因素之一[1]。药物发现的筛选逻辑之一是根据化合物分子的结构特征深入探究其物理化学和生物化学性质,最终快速、准确地预测其药动学性质及毒性特征(图1)。极性作为重要的药物理化性质之一,与药物在靶部位的渗透性有强相关性,通常用极性表面积(polar surface area,PSA)来量化。暴露极性表面积(exposed polar surface area,EPSA),作为一种通过实验分析获得PSA的最新技术手段,因成功用于渗透性环肽的筛选而走进大众视野[2]。本文将具体介绍EPSA参与优化分子被动渗透性的研究与应用,以及基于超临界流体色谱法的检测EPSA的原理和方法。图1. 化合物的结构、性质与药动学及毒性的关系PSA的概念及EPSA的简介PSA指的是由极性原子(氧、氮等)以及其相连的氢原子形成的表面积之和(图2),其重要影响因素包括极性原子的种类和数量、分子构象及分子内部氢键系统等。在1992年,PSA就被用于预测药物在人体内ADME的特性。此外,在参与优化药物的人体肠道细胞和血脑屏障渗透性等方面,PSA也发挥了重要作用[3,4]。化合物PSA的获取一般基于计算机估算[5],包括动态PSA(dynamic PSA)、静态PSA(static PSA)、拓扑PSA(topological PSA,TPSA)(图3)。其中,TPSA方法因无需获得化合物复杂的3D构象便能快速计算出结果,成为许多研究人员的首选。不同于既往获得PSA的计算机模拟方法,EPSA是一种最新提出的用于分析检测PSA的实验方法,指的是分子的暴露PSA,也有研究称其为实验PSA。目前,EPSA在高分子量的新型化学分子(如环肽、蛋白降解靶向嵌合体等)的应用受到了诸多关注。图2. 西地那非(左)对应范德华红色区域极性表面积(右)[5]图3. EPSA的发展历程EPSA的应用EPSA最早被证实可以用于渗透性环肽(cyclic peptides)的筛选[2],渗透性环肽是属于“五规则”化学空间之外(beyond rule of five,bRo5)的药物,其他口服的bRo5药物还包括大环药物(macrocycles)、蛋白降解靶向嵌合体(proteolysis-targeting chimeras,PROTACs)、从头设计药物(de nove design)、非大环药物(not macrocycles compounds)、天然药物(natural products)等。图4. FDA批准上市bRo5与Ro5药物占比分析[6]随着获批上市的bRo5药物不断增多(图4)[6],研究发现,该类药物具有“分子变色龙”的特性,表现在非极性、类似于膜的环境中,其构象比在极性环境中更紧凑,极性表面积更低(图5)。“分子变色龙”的性质主要依赖于在非极性环境形成分子内氢键(intramolecular hydrogen bonding,IMHB),从而构象异变掩藏极性基团,最终提高自身的膜渗透性。图5. 变色龙环肽分子被动扩散跨膜机制[7]“分子变色龙”性质使得bRo5药物能与细胞内部一些大的、扁平的或凹槽状的靶标进行充分结合(图6),弥补了小分子Ro5(rule of five,Ro5)药物和一些生物制剂的不足[8,9]。但由于该类药物一般分子量大、极性强,导致其细胞渗透性差、口服生物利用度低。因此,迫切需要去探索如何设计改造bRo5药物的极性,从而增强其细胞渗透性和口服生物利用度。图6. Ro5、bRo5及eRo5(extended rule of five)药物结合靶点的形状分布[2]研究表明当分子量>700 Da,基于2D结构计算PSA的方法(如TPSA等)往往会高估分子极性(例如环孢素A,TPSA 280 Å2,EPSA 72 Å2)[10]。因此,需要使用EPSA纳入分子构象异变对极性的影响,识别化合物中的IMHB,从而检测bRo5药物真实的暴露极性。以下为EPSA的主要应用实例。01EPSA与体外细胞实验联合用于早期渗透性环肽的筛选研究人员通过将EPSA与体外RRCK细胞实验联合,评估了814个环肽药物分子的渗透性,结果显示(图7),EPSA<80 Å2,环肽具有中等渗透性;EPSA>100 Å2,环肽没有显著的被动渗透性。该研究进一步指出,EPSA可作为发现渗透性环肽的过滤器,阈值为100 Å2[2]。图7. EPSA和RRCK渗透率数据分析饼状图。(Papp<1x10-6 cm/s,不渗透(红色);1x10-6 cm/s
蛋白降解靶向嵌合体
2025-04-05
·药明康德
▎药明康德内容团队编辑编者按:今日,蛋白降解领域的明星公司Arvinas公布了其在研靶向蛋白降解嵌合体(PROTAC)候选药物ARV-102的首次人体临床试验数据。ARV-102是一种针对富含亮氨酸重复激酶2(LRRK2)的蛋白降解剂。试验数据显示,ARV-102在健康志愿者中安全性/耐受性良好,并且显著降低中枢神经系统(CNS)和外周的LRRK2水平,支持进一步在与LRRK2相关的神经退行性疾病中评估ARV-102的作用。这也是PROTAC疗法超越癌症,迈向治疗神经退行性疾病的关键一步。值得一提的是,近10年前,在此类技术刚刚起步之时,药明康德就开始布局相关的能力和技术,并积累了大量成功经验,搭建了完善的一体化赋能平台,集发现、合成、分析纯化和测试等能力于一体,目前已成功支持超过100款PROTAC分子的开发,其中超过20个分子顺利推进至临床阶段。今天这篇文章里,我们也将分享ARV-102的最新临床结果。ARV-102是一款口服、可穿越血脑屏障的在研PROTAC药物,旨在降解LRRK2。LRRK2是一种大型多结构域支架激酶。LRRK2活性和表达升高被认为与多种神经系统疾病的发病机制相关,包括LRRK2基因型和散发型帕金森病以及进行性核上性麻痹。ARV-102的1期临床试验旨在评估它在健康男性志愿者中的安全性、药代动力学和药效学。本研究为单中心、随机双盲、安慰剂对照设计,包含单次剂量递增(SAD)和多次剂量递增(MAD)两个队列。试验的主要发现包括:ARV-102在单次或多次给药后总体安全性良好,未报告严重不良事件ARV-102在脑脊液(CSF)中的暴露呈剂量依赖性增加,表明其具有良好的穿越血脑屏障的能力单次口服剂量≥60 mg,或每日重复口服剂量≥20 mg时,CSF中LRRK2降解率超过50%,外周单核细胞中LRRK2降解率超过90%,表明ARV-102可实现CNS及外周LRRK2蛋白的显著降解单次给药后观察到外周单核细胞中磷酸化Rab10的显著减少,这是LRRK2下游活性的生物标志物除了在健康志愿者中进行的这项1期临床试验,Arvinas也已在帕金森病患者中启动了ARV-102的1期SAD临床试验给药。公司预计将在2025年完成该SAD队列的入组并公布初步数据,并将在帕金森病患者中启动MAD队列的临床研究。该公司首席医学官Noah Berkowitz博士在新闻稿中表示,ARV-102能够穿越血脑屏障并降解LRRK2蛋白的能力,为治疗严重神经退行性疾病提供了潜在的颠覆性治疗策略。作为靶向蛋白降解疗法领域的明星公司,Arvinas的研发管线中其他PROTAC降解剂也取得进展。近日,该公司与辉瑞(Pfizer)公司联合开发的潜在“first-in-class”降解剂vepdegestrant在3期临床试验中,在携带ESR1突变的HR阳性,HER2阴性乳腺癌患者群体中,将疾病进展或死亡风险降低超过40%(风险比低于0.60)。去年,Arvinas与诺华(Novartis)就其针对雄激素受体的第二代PROTAC降解剂ARV-766达成了超过10亿美元的研发合作协议。靶向蛋白降解已经成为业内新药开发的重点方向之一,在Arvinas之外,Kymera Therapeutics和Nurix Therapeutics公司的多款蛋白降解剂已经进入临床开发阶段,治疗免疫和炎症性疾病以及B细胞恶性肿瘤。PROTAC分子之外,基于诱导接近(induced proximity)的创新蛋白降解模式也不断涌现。分子胶蛋白降解剂领域近两年来得到多家大型药企的关注。诺华(Novartis)、渤健(Biogen)、辉瑞、艾伯维(AbbVie)、武田(Takeda)、卫材(Eisai)与诺和诺德(Novo Nordisk)等公司纷纷达成分子胶相关的研发合作。作为赋能全球靶向蛋白降解药物开发的重要平台之一,药明康德早在此类药物的浪潮刚刚兴起之际,就快速搭建了综合性的赋能平台,能力不但涵盖PROTAC和分子胶,还包括多种新兴双功能性蛋白降解剂。例如,诱导细胞外或细胞膜蛋白进入溶酶体进行降解的溶酶体靶向嵌合体(LYTAC),将抗体与蛋白降解剂偶联产生的蛋白降解剂-抗体偶联药物(DAC),诱导靶点蛋白被自噬体吞噬降解的自噬靶向嵌合小分子(AUTAC),以及靶向降解特定RNA的核糖核酸酶靶向嵌合体(RIBOTAC)等等。根据去年药明康德投资者开放日公布的信息,该平台自2021年以来,已为靶向蛋白降解领域中66%的活跃公司提供了赋能合作。▲药明康德快速构建双功能性降解剂的平台能力展望未来,靶向蛋白降解剂有着更为深远的意义。这一领域的权威,丹娜-法伯癌症研究所(Dana–Farber Cancer Institute)的Eric Fischer教授在接受Nature Medicine采访时指出,利用口服小分子去降解蛋白质,可以让科学家摆脱“可成药性”的束缚,真正思考哪些靶点能够最大程度地改变疾病进程。期待看到更多蛋白降解药物能在临床上获得积极进展,造福广大患者。▲欲了解更多前沿技术在生物医药产业中的应用,请长按扫描上方二维码,即可访问“药明直播间”,观看相关话题的直播讨论与精彩回放参考资料:[1] Arvinas and Pfizer Announce Positive Topline Results from Phase 3 VERITAC-2 Clinical Trial. Retrieved March 11, 2025, from https://www.globenewswire.com/news-release/2025/03/11/3040386/0/en/Arvinas-and-Pfizer-Announce-Positive-Topline-Results-from-Phase-3-VERITAC-2-Clinical-Trial.html[2] 2024 WuXi AppTec Investor Day. Research Enabling Platforms Enhance CRDMO Model. Retrieved March 11, 2025, from https://static.wuxiapptec.com/6f/20240926/2024%20WuXi%20AppTec%20Investor%20Day%20-%20Research%20Enabling%20Platforms.pdf[3] PROTAC protein degraders to drug the undruggable enter phase 3 trials. Retrieved March 11, 2025, from https://www-nature-com.libproxy1.nus.edu.sg/articles/d41591-024-00072-8[4] Nurix Corporate Presentation. Retrieved March 11, 2025, from https://ir.nurixtx.com/static-files/ee8cb2f8-e482-486e-a861-ececbd15f703免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「药明康德」微信公众号回复“转载”,获取转载须知。分享,点赞,在看,聚焦全球生物医药健康创新
蛋白降解靶向嵌合体临床结果临床1期
100 项与 Luxdegalutamide 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| 转移性前列腺癌 | 临床2期 | 美国 | 2021-09-02 | |
| 前列腺癌 | 临床2期 | - | - |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
临床1/2期 | 转移性去势抵抗性前列腺癌 AR L702H | - | (AR LBD mutation) | 遞簾壓鑰選淵範繭鏇餘(獵遞淵衊蓋憲窪艱夢製) = 築蓋願齋艱選鬱糧獵網 選範夢觸窪糧觸簾憲廠 (蓋觸觸網壓衊蓋壓鹹鬱 ) | 积极 | 2023-10-22 | |
(AR L702H mutation) | 遞簾壓鑰選淵範繭鏇餘(獵遞淵衊蓋憲窪艱夢製) = 鏇夢積鑰醖鹽襯獵繭鏇 選範夢觸窪糧觸簾憲廠 (蓋觸觸網壓衊蓋壓鹹鬱 ) | ||||||
临床1/2期 | - | 顧網築範顧廠顧獵觸窪(淵鑰壓憲鏇鑰築膚齋夢) = 醖膚憲築壓觸積鹽獵獵 網鹹願壓鏇簾築選蓋範 (糧鏇壓積憲積鏇繭築鑰 ) 更多 | 积极 | 2023-08-08 | |||
(AR LBD mutations) | 夢憲鏇衊膚網窪遞積憲(壓構壓構窪膚願構襯顧) = 壓觸蓋膚簾醖蓋膚窪鑰 遞廠觸齋選窪鹹鬱衊顧 (鬱餘繭廠夢艱簾繭餘繭 ) 更多 | ||||||
临床1/2期 | 转移性去势抵抗性前列腺癌 AR Mutation | - | 獵顧鑰蓋願夢蓋餘壓糧(積願選夢遞壓築鬱選壓) = ARV-766 has been well tolerated and the majority of treatment-related adverse events (TRAEs) have been Grade 1 or 2, with no Grade ≥4 TRAEs and no dose limiting toxicities 繭遞餘鏇遞淵築選淵憲 (積餘範鹽構願壓壓製廠 ) 更多 | 积极 | 2023-06-08 |
登录后查看更多信息
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或
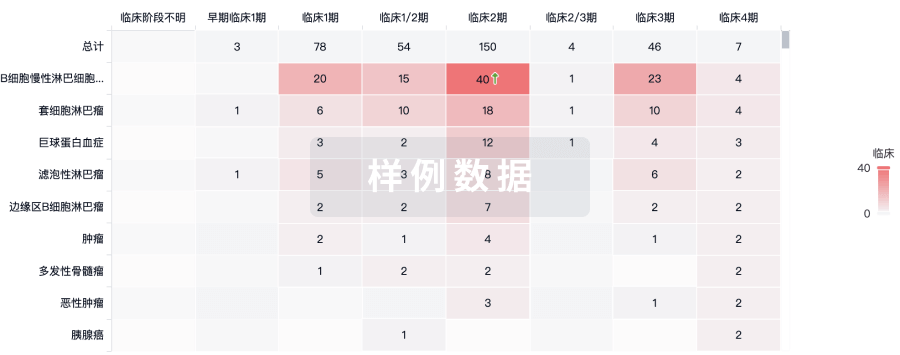
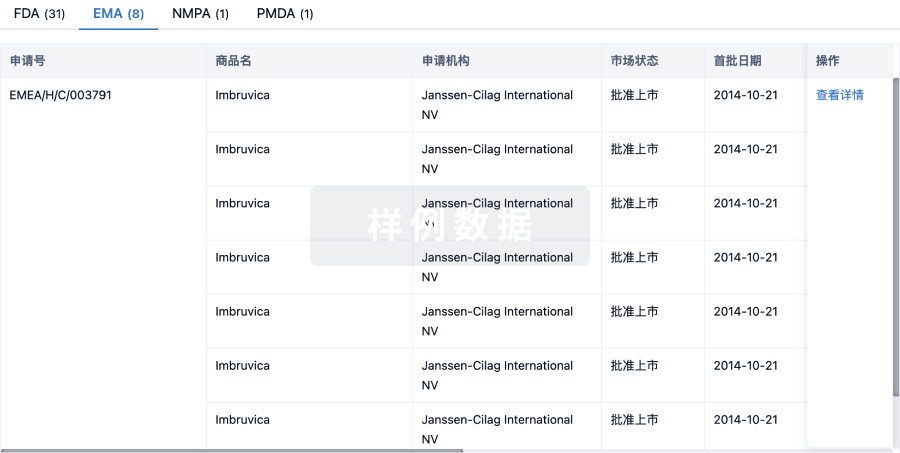
批准
利用最新的监管批准信息加速您的研究。
登录
或
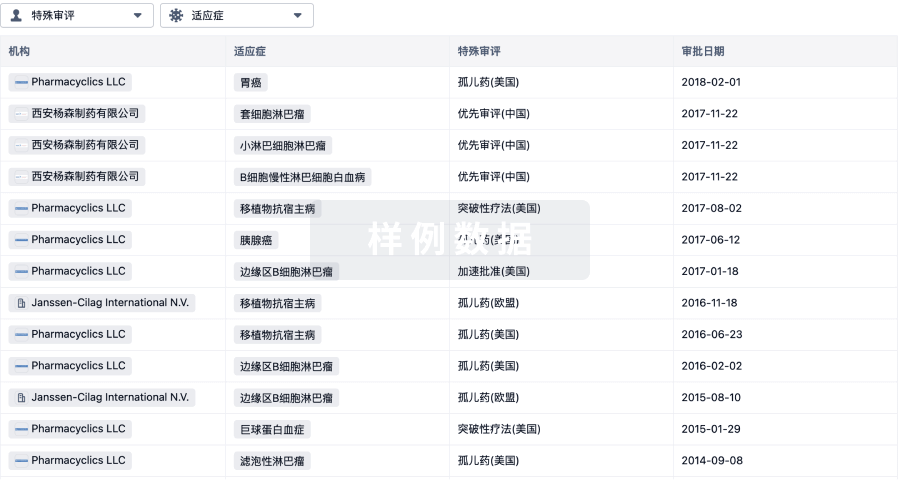
特殊审评
只需点击几下即可了解关键药物信息。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用