预约演示
更新于:2025-08-09
CMG1A46
更新于:2025-08-09
概要
基本信息
药物类型 三特异性T细胞接合器 |
别名 1A46、BR110、CMG 1A46 + [5] |
作用方式 抑制剂、刺激剂 |
作用机制 CD19抑制剂(B淋巴细胞抗原CD19抑制剂)、CD20抑制剂(B淋巴细胞抗原CD20抑制剂)、CD3刺激剂(T细胞表面糖蛋白CD3复合体刺激剂) |
在研适应症- |
非在研适应症 |
原研机构 |
在研机构- |
最高研发阶段终止临床1/2期 |
首次获批日期- |
最高研发阶段(中国)终止 |
特殊审评- |
登录后查看时间轴
关联
3
项与 CMG1A46 相关的临床试验CTR20232077
一项评估三特异性 T 细胞介导抗体(1A46)在R/R CD20 和/或 CD19 阳性 B细胞非霍奇金淋巴瘤(B-NHL)成人受试者中安全性和有效性的I/II期、开放性、首次人体单臂研究
I期部分
主要目的:
评价1A46在CD20和/或CD19阳性的R/R B-NHL受试者中的安全性、耐受性、最大耐受剂量(MTD)/推荐的II期研究剂量(RP2D)。
II期部分
主要目的:
评价1A46在CD20和/或CD19阳性R/R B-NHL受试者中的有效性。
在CD20和/或CD19阳性R/R B-NHL受试者中的药代动力学(PK)特征。评价1A46在CD20和/或CD19阳性R/R B-NHL受试者中的药效动力学(PD)作用。评价1A46在CD20和/或CD19阳性R/R B-NHL受试者中初步的抗肿瘤活性。评价1A46在CD20和/或CD19阳性R/R B-NHL受试者中的免疫原性。
探索性目的:探索1A46暴露量与B细胞耗竭、疗效和安全性的关系。初步探索药效学指标与疗效的关系。探索抗药抗体的产生对疗效和安全性的影响。
II期部分
主要目的:评价1A46在CD20和/或CD19阳性R/R B-NHL受试者中的有效性。
开始日期2023-09-12 |
申办/合作机构 杭州博之锐生物制药有限公司 [+2] |
NCT05987605
A Phase I/II, First in Human, Single Arm, Open Label Study to Evaluate the Safety and Efficacy of the Injection of Triple-specific T-cell Engager 1A46in Adult Subjects with R/R CD20 Positive And/or CD19 Positive B Cell Non-Hodgkin's Lymphoma (B - NHL)
A phase I/II, first in human, single arm, open label study to evaluate the safety and efficacy of the injection of triple-specific T-cell engager 1A46 in adult subjects with R/R CD20 positive and/or CD19 positive B cell non-Hodgkin's lymphoma (B - NHL)
开始日期2023-09-12 |
申办/合作机构 |
NCT05348889
A Phase 1/2, First in Human, Single-arm, Open-label Study to Evaluate the Safety and Efficacy of Triple-specific T-cell Engager 1A46 in Adult Patients with Advanced CD20 And/or CD19 Positive B-cell Hematologic Malignancies
This study will evaluate the safety and efficacy of 1A46 in adult patients with advanced CD20 and/or CD19 positive B-cell non-Hodgkin's lymphoma (NHL) or acute lymphoblastic leukemia (ALL).
开始日期2022-08-30 |
申办/合作机构 |
100 项与 CMG1A46 相关的临床结果
登录后查看更多信息
100 项与 CMG1A46 相关的转化医学
登录后查看更多信息
100 项与 CMG1A46 相关的专利(医药)
登录后查看更多信息
62
项与 CMG1A46 相关的新闻(医药)2025-07-19
·氨基观察
氨基观察-创新药组原创出品作者 | 沙晓威一场围绕三抗的资本盛宴已然开席。7月,艾伯维宣布以7亿美元首付款收购IGI Therapeutics开发的一款三抗,靶点覆盖CD3、CD38和BCMA,用于多发性骨髓瘤(MM)治疗。这是继2025年1月与先声药业达成GPRC5D/BCMA/CD3三抗SIM0500的10.55亿美元合作之后,艾伯维在血液瘤领域的又一次出手。短短半年,豪掷17亿美元,艾伯维对三抗的前景认可不言而喻。艾伯维也并非孤例,各大药企都在加速布局三抗。自2024年初以来,三抗相关交易持续升温。默沙东先后收购Harpoon Therapeutics、EyeBio两家企业,强化三抗产品线;吉利德以5600万美元预付款及最高15亿美元里程碑付款,与Merus达成合作,联手开发新型肿瘤相关抗原(TAA)的三抗;还有GSK,以8.5亿美元引进恩沐生物的CD19/CD20/CD3三抗CMG1A46,剑指自免疾病市场……可以看到,下场的MNC越来越多。尽管这些管线仍处于早期阶段,但仍向外界传递着一个明确的信号,那就是,三抗已经彻底火起来了。随着临床的推进,未来或许还将有更多交易的达成。新的技术军备竞赛,开始了。/ 01 /全球竞速三抗赛道双抗走红后,三抗成为了下一代免疫疗法研发的焦点之一。过去3年,全球三抗药物的研发管线,呈现指数型增长。截至目前,在研三抗产品已突破100个,且多个项目已开启动临床试验。其中,来自中国的管线数量最多,占比接近半数。随着研发的持续推进,多家MNC通过并购、BD交易等方式入局,三抗已经不再是概念炒作,而是一场新的全球竞速赛。从交易规模上看,2024年初至今,全球三抗领域的各类交易总额(不含里程碑付款)已突破100亿美元。各大药企争相布局背后,看中的是三抗在肿瘤和自免领域的巨大潜力。肿瘤由于细胞高度异质性、微环境引起的免疫抑制增强及耐药性的问题,导致单一靶点难以长期有效控制肿瘤增殖。也正因此,联合用药、双抗成为了新的治疗趋势。双抗时代的到来,为诸多药企带来新的增长。当前最火热的无疑是TCE双抗,全球已上市的19款双抗药物中,11个是TCE类产品,强生对自家两款TCE双抗的销售额峰值,更是看到了50亿美元。只不过,随着CD19/CD3、BCMA/CD3等热门组合被迅速挖掘,靶点重合、管线扎堆的问题逐渐显现。在针对复发/耐药性实体瘤治疗中,双抗也存在疗效瓶颈,T细胞耗竭、抗原丢失和耐药问题日益突出,亟待更强力机制补充。相比之下,三抗通过整合双TAA与CD3免疫激活元件,有潜力实现更精准的引导,同时降低脱靶风险。在多发性骨髓瘤、淋巴瘤等抗原异质性高的疾病中,三抗有望解决双抗的耐药问题。目前临床阶段最常见的靶点组合为CD3/BCMA/GPRC5D,现有管线药物包括强生的JNJ-79635322、艾伯维收购先声的SIM0500、信达的IBI3003以及天广实的MBS314。从强生公布的JNJ-79635322治疗RRMM的1期结果来看,36名接受推荐2期剂量药物治疗的患者中,ORR达86.1%,非头对头优于强生的双抗CD3/GPRC5D双抗塔奎妥74.1%的ORR。在肿瘤深入探索的同时,TCE在自免市场的潜力,正在被越来越多的药企看见。B细胞驱动的免疫异常是多种自免疾病的核心发病机制,TCE的机制,理论上也能够通过深度清除B细胞,来为自免疾病患者带来获益。一些初步的探索,也证明了潜力。此前安进的TCE Blinatumomab(CD3/CD19)、强生的TCE Teclistamab(CD3/BCMA)均在自免早期临床中显示出积极疗效。然而,持续时间短,难以深度或持久清除B细胞。此外,体内抗药物抗体(ADA)的出现,也影响药物的疗效。相比之下,三抗的分子设计具备更强靶向性和调控能力。比如诺华的PIT565(CD3/CD19/CD2三抗)从肿瘤跨界至自免,正在开展系统性红斑狼疮(SLE)、类风湿关节炎等自免疾病的研究。与CD3双抗相比,PIT565共刺激CD2会克服T细胞衰竭,增加患者反应的深度和持续时间。这种三抗设计使其在疗效和安全性上具有较大的潜力。再比如GSK引进CMG1A46,看中的也是其分子设计特点:对CD19和CD20阳性B细胞具有高亲和力,对CD3具有低亲和力,可以降低TCE通常相关的毒性。而这能够帮助其拓展SLE等B细胞驱动的自免疾病研究。三抗能否满足药企的期待还有待时间的证明,但其热度持续上升成了一个必然事件。/ 02 /被按下了快进键三抗概念早在2004年就已出现,Huang等人提出了CEA/CD3/CD28三抗在靶向NK细胞和肿瘤细胞中的尝试。2022年,赛诺菲在《Nature》上连发多篇文章分享CD38/CD3/CD28三抗的研发进展,由此这一领域尝试正式进入大众视野。尽管从概念到产业真正关注,三抗用了18年的时间;随着近两年大药企的争相布局,三抗领域异常热闹。但本质上,这仍被按下了“快进键”的结果。一方面,从成药结果上看,目前全球尚无任何三抗产品获批上市,进度最快的管线,如强生JNJ79635322、默沙东的EYE103(眼科)也仅处于2期临床阶段,距离商业化落地还有较长距离。另一方面,三抗的研发过程也并非一帆风顺,靶点叠加≠效果提高,复杂性远超预期。此前,赛诺菲的HER2/CD3/CD28三抗SAR443216已因毒性较大而有效性不足被终止开发。这次失败也暴露出两个问题,靶点的选择不当以及三抗的设计缺陷。尽管ADC在HER2这个靶点大杀四方,但TCE与ADC的逻辑不同。前者的本质上是化疗,对靶点的要求是越高越好,对靶点的特异性要求就没那么高,而TCE对靶点的要求核心是特异性好,对表达水平要求较低。由于HER2同时在多种肿瘤细胞甚至是正常细胞中表达,因此,要对肿瘤的高表达和正常细胞低表达进行一定的区分。反映在药物设计中,HER2的亲和力不宜过高。而三抗涉及到三种靶点,分子的亲和力更需要平衡。但很显然,赛诺菲没有考虑这一点。这也提示现有的三抗甚至多抗研发者,并不是靶点叠加的越多越好,也绝不是简单的排列组合。更需要关注的是,在TCE三抗中,高度刺激免疫系统可能会引发安全性问题。艾伯维收购的BCMA/CD38/CD3三抗ISB2001的1期临床结果上看疗效还算不错:50ug/kg剂量以上达到了79% ORR,其中30%的患者达到完全缓解CR。然而,43%的患者出现了≥3级的中性粒细胞减少症,74%的患者发生感染。这样的问题出现在强生的三抗JNJ-79635322临床:41%患者的出现3级以上中性粒细胞减少症和75%的感染。这涉及一个关键问题:CD3 介导的T细胞活化是否需要两种肿瘤抗原的结合,还是与任一抗原结合足以触发细胞毒性?这种设计选择,对疗效和毒性的控制都有重要意义。而在大药企更关注的自免领域,双抗尚属新鲜事物,更不要提三抗了。核心在于,相比肿瘤药物,自免药物对依从性、安全性等要求更严苛。Ozoralizumab是已上市的双抗中唯一一款自免药物,用于类风湿性关节炎的治疗。其相对分子量仅为38 kDa,避免了大结构免疫复合物的形成,降低了免疫原性。但在最新的3期临床中,还是有40%的患者出现了ADA,影响了治疗效果。强生、艾伯维、安进等药企的TCE此前都遭遇过ADA免疫原性过高的问题,大多数管线已经终止研发。基于免疫原性的限制,强生目前管线中的相关自免疗法,以联用为主。事实上,在TCE为代表的双抗在肿瘤药物开发过程,ADA的控制一度也成为挑战。扩展到自免领域,ADA免疫原性的问题在慢性病管理中更突出,在靶点组合和药物结构设计方面,需要更为关注。三抗在此基础上推进,挑战无疑更大。/ 03 /大力能否出奇迹当然,尽管三抗开发更为早期,风险与周期更高,但市场的热情追捧也不难理解。一方面,双抗太火了,这为药企布局三抗提供了信心支撑。毕竟,此前市场也曾质疑双抗“比单抗好不了多少”,但近年来Blincyto、Vabysmo等双抗产品在血液瘤、眼科等领域的大爆发,证明可通过协同效应实现疗效突破、商业化成功。而HER2/HER3双抗则由于安全性饱受质疑,但Bizengri和Zenocutuzumab的成功,让市场看到叠靶点也是有回报的。另一方面,三抗技术处于早期,存在诸多不确定是事实,但是,资本和药企的大量涌入,必然会加速多抗的研发进程。在交易模式上,大药企的已不局限于单一药物,而是延伸到整个技术平台。默沙东从Harpoon获得了包括在肿瘤微环境中特异性激活的ProTriTAC和TriTAC-XR三抗平台,借助这些平台加速了三抗的研发。同年5月默沙东对EyeBio进行并购,8月就迎来了管线产品EYE103的2/3期临床试验结果,接受该疗法的糖尿病性黄斑水肿患者视力得到改善,这一快速进展充分验证了整合优质平台对研发效率的提升作用。更为重要的是,在资本与大药企的推动下,三抗研发过程中问题的暴露,可能会加速系统性解决方案的诞生。药物研发本就是一个不断发现问题、解决问题的过程,成功往往建立在无数次失败的基础之上。三抗研发同样如此。每一次失败都能为研究者提供宝贵的经验,以及优化迭代的“原始数据”;而资本的持续投入、大药企的重视,也为研究试错提供了底气,从而推动整个领域的进步。泡沫对投资者意味着风险,但对行业来说并非全是坏事。因为创新不能被计划、不能被安排,需要大量试错,而泡沫能为其提供充足的养料。总而言之,三抗需要质疑,但同样要期待。毕竟,解决未满足临床需求的钥匙,往往藏在最复杂的迷宫中,需要一次又一次的碰壁与重来。PS:欢迎扫描下方二维码,添加氨基君微信号交流。
并购免疫疗法申请上市
2025-07-08
·药研网
前言继 ADC、核药后,CD3 TCE类药物也迎来了高光时刻,TCE加上爆火的 NewCo 出海模式不断被刷屏,正在自免领域掀起一场热潮,不断刷新新的交易记录。6月4日,Cullinan Therapeutics宣布与智翔金泰达成合作,获得BCMAxCD3双特异性T细胞衔接抗体velinotamig在全球(大中华区除外)全适应症的独家授权。新闻稿介绍,velinotamig在近50例复发/难治性多发性骨髓瘤患者的2期目标剂量治疗中已展现出潜在"best-in-class"疗效。Cullinan将开发该药物用于自身免疫疾病领域。此次交易,Cullinan将向智翔金泰支付2000万美元首付款,以及最高6.92亿美元的开发、监管批准和销售里程碑付款,总交易合计7.12亿美元!6月23日,和铂医药宣布与大塚制药达成全球战略合作协议,携手推进用于治疗自身免疫性疾病的BCMA×CD3双特异性T细胞衔接器(TCE)的开发。根据协议,和铂医药将获得总计4700万美元的首付款及近期里程碑付款,未来还有望获得高达6.23亿美元的后续里程碑付款,并享有产品销售分成权益。基于此次合作,双方亦计划在TCE领域探索更多潜在的合作机会。而这是和铂继3月与阿斯利康的重大合作后,在2025H1拿下的第二笔MNC大单了,落地于TCE双抗这一前沿赛道。TCE双抗:新兴癌症免疫疗法TCE是一种创新的生物工程抗体,能够同时结合两个细胞上的不同抗原。通常情况下,一端为T细胞表面的CD3分子,另一端则是与肿瘤细胞或自免疾病相关细胞表现的特定抗原。相较于传统的单抗产品,TCE双抗的设计可以在空间上拉近T细胞与目标细胞的距离,进而激活T细胞,实现更强大的“击杀”效果。CD3靶点在TCE双抗疗法中扮演了关键角色,通过激活T细胞和促进其与目标细胞的紧密接触,最终发挥强大的免疫介导杀伤作用,为TCE双抗在肿瘤、自免疫性疾病等领域的应用奠定了基础。吉满生物重磅推出CD3稳定过表达细胞系、高灵敏度报告基因检测细胞系及优质抗体与蛋白产品组合,打造从靶点验证到临床申报的一站式解决方案,为您的创新药研发提供全流程、高标准的技术支持,加速药物开发进程。CD3双抗靶点开发作为免疫治疗领域的热点,CD3双特异性抗体的开发也一直备受关注。目前,全球有 11 种是以 CD3 靶点为基础的 TCE 双抗(其中包括首款商业化药物 Catumaxomab 2017年已退市),靶点组合类型主要集中在CD3×CD19、CD3×CD20、CD3×BCMA和CD3×GPRC5D。根据已批准上市的TCE药物列表,目前多数的TCE药物都用于治疗血液系统恶性肿瘤,适应症涵盖前体B淋巴细胞白血病,B细胞急性淋巴白血病,滤泡型淋巴瘤,弥漫性大B细胞淋巴瘤,多发性骨髓瘤等。表1. 全球已获批 CD3 TCE药物列表TCE目前主要应用于血液系统肿瘤的原因之一是,正常细胞中也表达这类抗原,其所导致的可能的非肿瘤靶向毒性,在血液瘤领域相比实体瘤而言更为可控。举例来说,靶向B细胞表面的CD19可能会导致B细胞再生障碍和低丙种球蛋白血症,并极大地增加感染风险;但这些感染可以通过临床警戒和及时的抗生素使用得以控制。TCE新战场:自免疾病领域TCE多抗药物研发已成为全球生物医药领域的热点方向,其中三抗药物因其独特的靶向性和治疗潜力备受瞩目。国际制药巨头纷纷加码布局:诺华(Novartis)开发的靶向CD19×CD2×CD3的三抗产品PIT565,以及葛兰素史克(GSK)8.5亿美元引进恩沐CD19/CD20/CD3三抗CMG1A46,用于自免疾病领域的开发。此外,阿斯利康(AstraZeneca)的三抗分子AZD5492(靶向CD20×TCR×CD8)近期在中国多次获批临床,拟用于治疗B细胞非霍奇金淋巴瘤和系统性红斑狼疮,进一步彰显了TCE多抗在血液肿瘤和自身免疫疾病领域的广阔前景。值得一提的是,中国已成为全球TCE三抗研发的创新高地。据不完全统计,全球约一半的三抗药物研发管线来自中国药企,包括嘉和生物、惠和生物、泽璟生物、康源博创/天广实、恩沐生物、先祥医药(先声药业子公司)、信达生物等,这些企业的相关三抗管线已陆续进入注册临床阶段。此外,成都百利等公司也在积极探索多抗药物的开发,进一步丰富了国内TCE多抗的研发布局。尽管TCE三抗药物的研发仍处于早期阶段,尚未有产品正式上市。不过,随着对免疫调节机制的深入理解和技术平台的不断优化,TCE多抗有望为系统性红斑狼疮、类风湿性关节炎等难治性自免疾病带来突破性疗法。未来,随着更多临床数据的积累和适应症的拓展,TCE多抗药物或将成为继CAR-T、双抗之后,肿瘤和自免治疗领域的又一重要支柱。用心做好细胞,为更好的靶向药吉满生物重磅推出CD3稳定过表达细胞系、高灵敏度报告基因检测细胞系及优质抗体与蛋白产品组合,打造从靶点验证到临床申报的一站式解决方案,为您的创新药研发提供全流程、高标准的技术支持,加速药物开发进程。(咨询吉满客服同微信:18916119826)产品列表TCE药效验证数据展示GM-C17940:Jurkat CD3-BsAb Reporter Cell Line吉满生物的Jurkat CD3-BsAb报告基因细胞系已在多种应用场景下完成了验证,包括与贴壁细胞和悬浮细胞的共培养试验,以及针对CD19、BCMA等多种靶点结合体的功能评估。实验结果表明,该细胞系能够高效支持T细胞接合器(TCE)药效的评价,为TCE类药物的筛选和机制研究提供了有力工具。与贴壁细胞共培养,然后使用Anti-CD3-CD19 Bispecific Antibody(Blinatumomab)、Anti-CD3 epsilon hIgG1 Antibody [OKT-3 (muromonab)]抗体验证结果与悬浮细胞共培养,然后使用Anti-CD3-CD19 Bispecific Antibody(Blinatumomab)、Anti-CD3 epsilon hIgG1 Antibody [OKT-3 (muromonab)]抗体验证结果与贴壁细胞共培养,然后使用GM-88011MABAnti-CD3E×BCMA hIgG4 Reference Antibody (Tecbio) 抗体验证结果稳定性数据展示GM-C32931:H_CD3 CHO-K1 Cell Line使用Anti-CD3 hIgG1 Antibody(CH2527)抗体稳定性验证结果细胞传代至少18代后,表达仍然稳定GM-C30877:H_CD3 HEK-293 Cell Line使用Anti-CD3 hIgG1 Antibody(CH2527)抗体稳定性验证结果细胞传代至少25代以后,表达仍然稳定GM-C32790:H_CD3E(Membrane Bound ECD) CHO-K1 Cell Line使用Anti-CD3 hIgG1 Antibody(CH2527)抗体为稳定性验证结果细胞传代至少25代以后,表达仍然稳定联系我们吉满生物助力药物研发,紧随前沿靶点资讯,储备几百株现货细胞,覆盖GPCR、细胞因子、免疫检查点、TAA等多领域,截止当前已布局近400个热门靶向药靶点,超1000 株现货单克隆细胞系,旨在助力、加速大分子早期研发,做到进口细胞的国产替代。同时可根据客户需求提供细胞系服务。扫码咨询扫码找现货参考文献:[1]https://www.ema.europa.eu/en/medicines/human/EPAR/blincyto[2]https://mp.weixin.qq.com/s/PeqtjrHMzKFK-4gXCuqO5w[3]Shanshal M, Caimi P F, Adjei A A, et al. T-Cell engager[4]https://www.gsk.com/en-gb/media/press-releases/gsk-enters-agreement-to-acquire-cmg1a46-from-chimagen-biosciences/[5] 海通国际,TCE双抗行业研究[6]https://mp.weixin.qq.com/s/YqrnALVmW7-M7bqvNNgODg[7]https://www.detaibio.com/topics/T-cell-engager-platform.html
引进/卖出免疫疗法抗体药物偶联物临床1期
2025-05-21
·空之客
在被三生授权Pfizer创纪录交易的铺天盖地刷屏中,市场情绪自不必说(眼见几乎所有带BD预期的票都在涨),针对交易以及SSGJ-707这个资产的多角度分析也俯拾即是,与AK-112的对比一路上溯到format、affinity、Kd,仿佛大家又忘了几个星期之前全体恶补临床统计学那一晚的惊悚记忆。诚然每个重大交易都有复杂的剧情,旁观者自难得管窥,不过考虑到即使是业内顶级买家历史上的出手成功率也是一言难尽(参见【医苑观畴】谁家的瓜都不保熟:国际药企创新药交易全景分析和【医苑观畴】谁家的瓜都不保熟:国内外创新药交易全景图分析更新),我们也没必要甘当辩经的大儒,去论证每个交易的合理性。有没有一种可能,退到更宏观的视角,当一类BD交易批量出现的时候,个别买家和卖家的画像特征的影响程度降低,而整个赛道的交易行为呈现出一些共性的规律呢?本文从近年来中国创新药出海交易最火热的几个靶点,逐一列举各个管线的关键里程碑事件的进度,来尝试梳理这其中可能蕴含的BD交易规律。先上结论:赛道确定性越高,排位对BD交易的重要性越大,只要管线的数据没有显著差异,买家会更在意推进速度,而未必去纠结那一点潜在的优劣势。既然是风口,也就不会有人太在意起飞的是不是猪。(说明:每个靶点仅列举中国公司管线、以及对海外的BD或M&A交易,临床开发进度的时间节点基于医药魔方数据库,并手工做一定的修正)1PD-(L)1/VEGF双抗首先当然是今天的主角PD-(L)1/VEGF双抗。从AK-112领衔出道后,整个团体热度迅速起飞,后面成员的出场费也水涨船高。SSGJ-707本来就是AK-112最快的跟进者之一,是为数不多在康方与Summit交易之前就启动临床、又及时读出了临床数据的管线,成为MNC争抢对象就不足为奇了。此外,这个列表里其他进度靠谱的,诸如HB-0025等,也早已放出BD交易传闻,随时有落锤的可能。唯有LM-299略显玄学,如何秒入Merck法眼,自然是有大量背后的工作才得以实现了。2血液瘤/自免TCE接下来是去年热度炸裂的TCE,特别是针对血液瘤及自免,主要是CD19、CD20、BCMA、GPRC5D与CD3组成的双抗和三抗。这个赛道的交易态势就更简单粗暴,由于B细胞清除机制的确定性高以及对于自免广大治疗领域的FoMo心态,或MNC直接下手、或采取Newco形式,进度靠前的TCE资产几乎被一网打尽。不过看得再细一点,我们会发现目前已经被买走的TCE资产,往往还都没有进入自免适应症的临床阶段、而只是早早在血液瘤上有了初步验证,甚至如CN-201和CMG-1A46这俩最早落入MNC彀中的管线还迟迟未能推进自免的IND。这就可能有两种解释,一则MNC氪金根本不在乎、横竖买来之后都是自己推临床,二则那些有一定资源的企业可以自己先推临床、后面待价而沽或者干脆就自己做商业化。3ADC时间再往前推,上一波交易热潮是ADC,也是中国创新药批量交易的起点。在HER2靶点上,由于是第一三共版本的ADC平台出茅庐第一仗,以及彼时中国Biotech的能力尚未成为全球行业共识,从IND开始后的临床进度多数还比较拖沓,也就只有RC-48、BB-1701和DB-1303等少数管线获得交易机会。到TROP2的时候,虽然靶点的价值比预想打了折扣,但能看到研发进度的显著提速,除恒瑞以外,临床进度靠前的管线基本应卖尽卖了。再到当红的B7H3,中国Biotech的执行力优势进一步凸显,从IND到三期的速度被压缩到两年左右,无论是已经交易的HS-20093、还是后续的交易传闻,都愈发有吸引力。最后是被寄予厚望的DLL3(包括了ADC和CAR-T),虽然阶段更偏早,但中高表达量+高度选择性的特点,决定了全球买家的兴趣,也就呈现出“出水必抢”的态势。从日常的基本逻辑我们可以知道,用户对可选消费品的性能在意程度远大于必需消费品,人们会对不同品牌的汽车、手机、奢侈品之类产品的各个细节翻来覆去进行对比,而买瓶水的时候至多也就看眼价签,甚至口渴的时候连价都不问了。医药资产交易同理,在竞品之间差异没那么大的情况下,与其纠结那几个点的数据差异,不如考虑清楚这条赛道是不是已经成了兵家必争之地和目标资产是不是处在赛道上的有利位置。
引进/卖出临床1期临床终止并购免疫疗法
100 项与 CMG1A46 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| CD19阳性B细胞淋巴瘤 | 临床2期 | 中国 | 2023-09-12 | |
| CD19阳性B细胞淋巴瘤 | 临床2期 | 中国 | 2023-09-12 | |
| CD20阳性B细胞淋巴瘤 | 临床2期 | 中国 | 2023-09-12 | |
| CD20阳性B细胞淋巴瘤 | 临床2期 | 中国 | 2023-09-12 | |
| 侵袭性 B 细胞非霍奇金淋巴瘤 | 临床2期 | 美国 | 2022-08-30 | |
| B细胞恶性肿瘤 | 临床2期 | 美国 | 2022-08-30 | |
| CD19阳性非霍奇金淋巴瘤 | 临床2期 | 美国 | 2022-08-30 | |
| 弥漫性大B细胞淋巴瘤 | 临床2期 | 美国 | 2022-08-30 | |
| 惰性非霍奇金淋巴瘤 | 临床2期 | 美国 | 2022-08-30 | |
| 套细胞淋巴瘤 | 临床2期 | 美国 | 2022-08-30 |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
No Data | |||||||
登录后查看更多信息
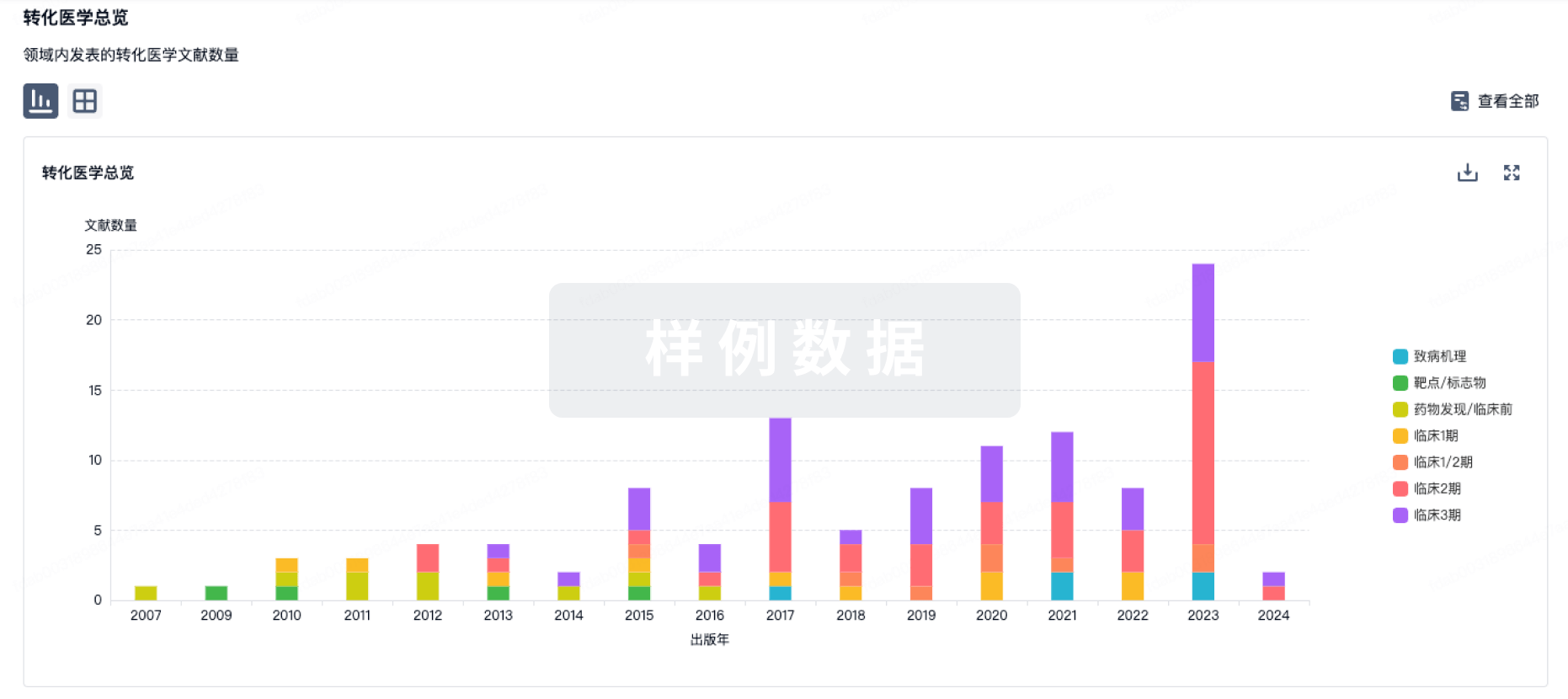
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或

批准
利用最新的监管批准信息加速您的研究。
登录
或
生物类似药
生物类似药在不同国家/地区的竞争态势。请注意临床1/2期并入临床2期,临床2/3期并入临床3期
登录
或
特殊审评
只需点击几下即可了解关键药物信息。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用


