预约演示
更新于:2025-05-07
Pelvic Neoplasms
盆腔肿瘤
更新于:2025-05-07
基本信息
别名 Cancer of Pelvis、Cancer of the Pelvis、Cancer, Pelvic + [56] |
简介 Tumors or cancer of the pelvic region. |
关联
11
项与 盆腔肿瘤 相关的药物靶点 |
作用机制 VEGFR2拮抗剂 |
在研机构 |
原研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2014-04-21 |
作用机制 PDGFR拮抗剂 [+2] |
在研机构 |
原研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2006-01-26 |
靶点- |
作用机制 光敏剂 |
最高研发阶段批准上市 |
首次获批国家/地区 日本 |
首次获批日期2003-10-16 |
145
项与 盆腔肿瘤 相关的临床试验NCT06915727
Pafolacianine for Localization of Pediatric Extracranial Solid Tumors
This phase III trial studies how well pafolacianine works for identifying cancerous lesions in children and adolescent patients with primary solid tumors or solid tumors that have spread from where they first started (primary site) to other places in the body (metastatic). Pafolacianine is a fluorescent imaging agent that targets folate receptors which are overexpressed in many cancers and is used with near infrared (NIR) imaging during surgery to identify tumor cells. NIR uses a special camera that uses wavelengths in the infrared range to visualize and locate the tumor cells that are lit up by the pafolacianine. Giving pafolacianine for NIR imaging may work better than other imaging agents in identifying cancerous lesions in pediatric patients with solid tumors.
开始日期2025-04-15 |
申办/合作机构 |
NCT05648253
Pilot Study to Assess the Feasibility of Use of a Novel Vaginal Dilator Device Post-radiation for Patients With Pelvic Malignancies
Vaginal dilator therapy (VDT) with static dilators is often prescribed to patients following vaginal or pelvic radiation therapy. This study seeks to evaluate the feasibility of a novel intravaginal device that delivers patient-controlled dilation (Hyivy device). The study is designed as a proof-of-concept single-arm pilot study. The primary objective is to assess safety and tolerability, while also evaluating changes in health-related quality of life and pelvic pain.
开始日期2025-04-11 |
申办/合作机构  Hyivy Health, Inc. Hyivy Health, Inc. [+1] |
NCT06820320
Oral Iohexol in the Management of Chylous Ascites After Retroperitoneal or Extended Lymphadenectomy for Abdominal or Pelvic Malignant Tumor: an Innovative and Convenient Treatment
The goal of this clinical trial is to assess the effectiveness of oral iohexol in the treatment of postoperative chylous ascites. It will also learn about the safety of oral iohexol. The main questions it aims to answer are:
* Confirm the potential of oral iohexol as an innovative therapeutic regimen.
* Confirm its ability to improve clinical outcomes for patients.
* Confirm the potential of oral iohexol as an innovative therapeutic regimen.
* Confirm its ability to improve clinical outcomes for patients.
开始日期2025-02-15 |
申办/合作机构 |
100 项与 盆腔肿瘤 相关的临床结果
登录后查看更多信息
100 项与 盆腔肿瘤 相关的转化医学
登录后查看更多信息
0 项与 盆腔肿瘤 相关的专利(医药)
登录后查看更多信息
4,824
项与 盆腔肿瘤 相关的文献(医药)2025-08-01·European Journal of Surgical Oncology
The role of computer-assisted navigation in pelvic tumor surgery: A systematic review and meta-analysis
Review
作者: Za, Pierangelo ; Manfreda, Antongiulio ; Papalia, Giuseppe Francesco ; Zoccali, Carmine ; Parisi, Francesco Rosario ; Ferrini, Augusto ; Papalia, Rocco
2025-05-01·Journal of the American College of Surgeons
Outcomes of Palliative Hemipelvectomy in Comprehensive Cancer Center Patients with Metastatic Cancer: Retrospective Study
Article
作者: Curry, Michael ; Bartsch, Christan ; Gulati, Amitabh ; Omer, Dana ; Aysola, Varun ; Santos, Erin P ; Rosen, Roni ; Vaynrub, Max ; Nash, Garrett
2025-05-01·Thrombosis Research
The efficacy and safety of low-molecular-weight heparins for venous thromboembolism prophylaxis in abdominal or pelvic cancer surgery: A systematic review and network meta-analysis of randomized controlled trials
Article
作者: Liu, Kun ; Wu, Yi-Feng ; Zuo, Xiao-Cong ; Tang, Zhi-Yao ; Huang, Yu-Jie ; Hu, Can ; Zhou, Ling-Yun
23
项与 盆腔肿瘤 相关的新闻(医药)2025-05-01
New data to be presented at the American Society of Breast Surgeons Annual Meeting shows fluid and body composition assessments improve early detection accuracy
CARLSBAD, Calif., May 1, 2025 /PRNewswire/ -- ImpediMed, a leader in medical technologies to clinically monitor and manage fluid and body composition, announced today that it will present new results from a breast cancer-related lymphedema (BCRL) study during a poster session at the American Society of Breast Surgeons (ASBrS) Annual Meeting in Las Vegas, NV on Friday, May 2nd at 6:00 p.m. in the Bellagio Grand Ballroom.
Titled "The Importance of a Pre-Treatment Baseline When Screening Patients for Breast Cancer–Related Lymphedema," the study underscores the need to measure fluid and body composition before cancer treatment begins. Findings from the PREVENT trial revealed that without a pre-treatment baseline, up to 71% of patients monitored with bioimpedance spectroscopy (BIS) and up to 88% of those monitored with tape measure would not have been identified as having early signs of lymphedema—potentially missing the window for early, more effective intervention.
ImpediMed Chief Medical Officer, Steven L. Chen, MD, MBA, the study's lead author, will present the findings at ASBrS.
"This evidence reinforces the critical importance of establishing an easy-to-perform, baseline measurement for fluid and body composition, one that improves the likelihood of detecting BCRL as early as possible so lymphedema treatment can begin at its most reversible stages," said Dr. Chen. "These findings highlight the importance of paying attention to lymphedema risk even as the cancer treatment is being planned."
The results stem from PREVENT, the largest randomized control trial to assess lymphedema prevention, in 1200 women, which monitored progression to chronic BCRL following intervention for early BCRL assessed by both BIS and a traditional tape measure. These baseline assessments performed prior to breast cancer treatment increased the likelihood that patients developing BCRL would be detected at an earlier stage post-treatment.
"Breast cancer-related lymphedema often stems from lymph node removal, radiation, or chemotherapy, and its impact goes far beyond discomfort—it can limit mobility and carry a significant financial burden," said study co-author John Boyages, MD, PhD, author of Lymphoedema –– Taking Control, a book he wrote after witnessing firsthand the physical and emotional trauma of lymphedema in many of his breast cancer survivor patients. "I firmly believe in the power of early detection and have used this technology since 2007. By identifying lymphedema before it's visible or measurable with a tape, it gives us a crucial window to intervene early and help prevent a lifelong, irreversible condition."
Lymphedema, a common consequence of cancer treatment, poses significant challenges in healthcare. According to the American Cancer Society 58% of cancer patients diagnosed with breast cancer, melanoma, or pelvic area cancers are at risk for developing limb lymphedema, and over 80% of breast cancer patients are at risk.
As a pioneer in the field of lymphedema detection and monitoring, ImpediMed offers the only FDA-cleared bioimpedance spectroscopy (BIS) solution for the clinical assessment of lymphedema –– SOZO® Digital Health Platform. ImpediMed's platform is now recommended in clinical practice guidelines nationwide and is broadly accepted and recognized for effective and accurate screening of lymphedema.
The National Comprehensive Cancer Network (NCCN) recently updated its Breast Cancer Clinical Practice Guidelines and advises on pretreatment screening as a baseline for patients with lymphedema risk factors, reinforcing the importance of baseline measurements to support early lymphedema detection.
"I'm proud to support research that highlights the benefits of closer monitoring for breast cancer survivors," said Scott Long, newly appointed Senior Vice President of Sales at ImpediMed. "It's rewarding to see survivorship care gaining momentum—something I've championed throughout my 30-year career in breast cancer biopsy and device development."
About SOZO Digital Health Platform
SOZO, the world's most advanced, non-invasive bioimpedance spectroscopy (BIS) device, delivers a precise snapshot of fluid status and tissue composition in less than 30 seconds. Using ImpediMed's BIS technology, SOZO measures 256 unique data points over a wide spectrum of frequencies from 3 kHz to 1000 kHz. Results are available immediately online for easy data access and sharing across an entire healthcare system. The FDA-cleared, CE-marked and ARTG-listed digital health platform aids in the early detection of secondary lymphedema, provides fluid status for patients living with heart or renal failure, and can be used to monitor and maintain overall health – all on a single device.
About ImpediMed
ImpediMed is a leading global medical technology company that designs and manufactures medical devices that employ bioimpedance spectroscopy (BIS) technology for use in the noninvasive clinical assessment and monitoring of fluid status and tissue composition in patients. The company consistently drives innovation, directing its primary efforts toward addressing the specific challenges and devastating burden of secondary lymphedema with a focus on breast cancer-related lymphedema (BCRL). With its SOZO® Digital Health Platform and L-Dex®, ImpediMed is the only company to offer an FDA-cleared technology that uses BIS and is setting new standards in early detection and management of BCRL. For more information, please visit .
About the PREVENT Trial
The PREVENT trial is a pivotal study and the largest randomized controlled trial to assess lymphedema prevention. The study enrolled 1,200 patients across 10 trial sites in the US and Australia, involving 13 hospitals, including Vanderbilt University, Mayo Clinic and MD Anderson. The trial was conducted over six and a half years and patients were followed for up to three years, with the primary aim to determine if early intervention in patients with subclinical detection of extracellular fluid accumulation via bioimpedance spectroscopy results in a lower rate of lymphedema progression versus the rate when tape measure is used for subclinical detection. The manuscript is published in Lymphatic Research and Biology.
The results of the trial demonstrated that patients with early detection with L-Dex™ technology and at-home intervention with compression garments resulted in a 7.9% rate of chronic lymphedema compared to a 19.2% rate of chronic lymphedema using tape measure. The difference is statistically significant (p=0.016) as well as being clinically significant for patients and clinicians. This represents an absolute reduction of 11.3% and a relative reduction of 59% in lymphedema progression at three years.
Media Contact:
Jodi Perkins
Amendola Communications, on behalf of ImpediMed
[email protected]
SOURCE ImpediMed
WANT YOUR COMPANY'S NEWS FEATURED ON PRNEWSWIRE.COM?
440k+
Newsrooms &
Influencers
9k+
Digital Media
Outlets
270k+
Journalists
Opted In
GET STARTED
临床研究临床结果
2024-11-24
·肿瘤界
点击蓝字 关注我们
引用本文:陈紫琦,丁美清,卢慧,等.输卵管癌脑转移2例及文献回顾[J/CD].肿瘤综合治疗电子杂志,2024,10(4):109-114.
基金项目:国家中医临床研究基地开放课题资助项目(JD2023SZ17);南京市卫生科技发展重点项目(ZKX20024)
通信作者:朱丽晶 E-mail :zhulj@hotmail.com
脑转移瘤的发病率为8.5%~9.6%,且20%~30%的实体瘤患者会在病程中发生脑转移[1],多来源于肺癌、乳腺癌、黑色素瘤等[2],预后普遍较差,而输卵管癌脑转移在临床上相对罕见,因此尚未形成统一的治疗规范。近年来,随着诊疗水平的提高和药物治疗的进展,肿瘤患者的总生存(overall survival,OS)时间有所延长,间接增加了晚期输卵管癌脑转移的发生率,且多重治疗可能导致耐药,疗效较差,所以及时接受有效的治疗至关重要。
研究表明,输卵管癌和卵巢癌具有共同的起源、类似的发病机制、表现及基因表达谱[3],国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)推荐原发性输卵管癌的诊治可参照卵巢癌指南[4]。基于此,本文选取2例输卵管癌脑转移病例进行分析,并以卵巢癌脑转移的治疗为例进行文献回顾,以期为临床优化输卵管癌脑转移患者的治疗模式提供思路。
1
病例资料
1.1 病例1
患者女,60岁,绝经8年。2021年6月无明显诱因出现阴道出血,妇科超声检查示 :左附件混合性占位(6.8 cm×3.8 cm×3.8 cm),子宫腺肌病合并腺肌瘤。血肿瘤指标未见异常。于2021年8月5日行腹腔镜下全子宫双侧附件切除术+盆腔淋巴结清扫术+大网膜切除术+盆腔肿瘤病灶切除术。术后病理:左侧输卵管高级别浆液性腺癌,输卵管内肿块大小4.0 cm×3.5 cm×3.0 cm,累及左侧卵巢(肿块大小1.0 cm×0.8 cm×0.5 cm);癌组织侵犯但未穿透卵巢白膜。脉管、神经未见明确癌组织侵犯 ;右侧卵巢组织及输卵管组织未见特殊,双侧宫旁未见肿瘤组织,网膜组织未见肿瘤组织累及;纤维结缔组织内见癌组织浸润;左侧盆腔淋巴结13枚,未见肿瘤组织累及;右侧盆腔淋巴结1/9枚见癌组织转移(转移灶最大径1.8 cm)。术后FIGO分期为Ⅱ期。基因检测结果(血液+组织):未检测到BRCA1和BRCA2基因胚系的变异。拷贝数变异分析示拷贝数无异常。患者术后规律行6个周期紫杉醇脂质体+卡铂静脉化疗(末次化疗时间2021年12月5日),化疗2个周期后复查血清糖类抗原125(carbohydrate antigen 125,CA125)已降至正常水平,后定期复查无异常(图1)。
2023年3月患者无明显诱因下出现头部剧痛,伴头晕、视物模糊,右侧肢体乏力,走路脚踩棉花感,至南京大学医学院附属鼓楼医院就诊,予甘露醇脱水治疗后症状减轻,头颅磁共振成像(magnetic resonance imaging,MRI)示:左侧额顶叶占位伴周围水肿,中线结构右偏,考虑恶性可能,左侧小脑半球液体衰减反转恢复序列呈高信号影,性质待定(图2a)。阅片提示脑部多个转移灶。胸腹部计算机断层扫描(computed tomography,CT)示:左侧颈部、腹膜后多发肿大淋巴结。血清CA125为46.6 U/ml(图1)。请神经外科会诊,结合影像和临床,排除原发性颅内肿瘤,考虑为输卵管癌颅内多发转移,无手术指征。
2023年4月11日至2023年5月9日行左侧额叶及顶叶及左侧小脑半球转移灶三维适形调强放射治疗(以下简称放疗),共完成受照射剂量60 Gy/20 Fx,其间同步行白蛋白紫杉醇+顺铂周方案化疗(共4次)联合贝伐珠单抗(第1天和第21天)靶向治疗2次。第4次化疗后复查头颅MRI示:左侧额叶、顶叶病灶及水肿带减小。疗效评价部分缓解(partial remission,PR)。患者头痛、头晕、视物模糊、肢体乏力等症状明显缓解。2023年6月13日放疗结束后1个月复查MRI结果提示:左侧额叶病灶消失,疗效评价PR;左侧顶叶病灶及周围水肿带明显缩小(图2b),疗效评价PR。胸腹部CT提示:左侧颈部淋巴结、腹膜后淋巴结等颅外转移灶均较治疗前缩小。血肿瘤指标CA125降至正常水平。2023年6月14日开始行白蛋白紫杉醇+顺铂+贝伐珠单抗6个周期方案全身治疗,此后给予贝伐珠单抗维持治疗至今。2024年5月7日复查头颅MRI提示颅内病灶完全缓解(complete remission,CR),颅外病灶PR(图2c)。
1.2 病例2
患者女,75岁,绝经23年。2022年6月2日无明显诱因出现阴道出血,血清CA125为41.9 U/ml(图3)。妇科超声检查示:右侧附件区低回声团块(5.3 cm×3.5 cm×3.6 cm)。胸部CT检查未见明显病灶(图4a)。于2022年7月7日在外院行全子宫切除术+双附件切除术+大网膜部分切除术+盆壁及盆底病灶切除术。术后病理:输卵管高级别浆液性腺癌(低分化腺癌)伴大片出血、坏死,隆起型,大小约7.5 cm×3.5 cm×3.0 cm,癌侵及输卵管壁全层达浆膜外,脉管及神经束膜未见侵犯;腹腔冲洗液涂片未见明确肿瘤细胞。术后FIGO分期为ⅡA期。术后至南京大学医学院附属鼓楼医院就诊,查胸腹部CT示双肺多发结节,考虑转移(图4b)。2022年8月2日肺穿刺活检病理:坏死组织内见异型上皮样细胞团,结合免疫组化染色结果及病史可符合输卵管低分化癌肺转移。修正分期为ⅣB期。患者于2022年8月4日至2022年8月28日行紫杉醇脂质体+卡铂+贝伐珠单抗靶向治疗2个周期,胸部CT示部分病灶较前增大(图4c),疗效评价疾病进展。于2022年9月23日开始更改方案为白蛋白紫杉醇+顺铂+贝伐珠单抗靶向治疗3个周期,2个周期后疗效评价PR,末次化疗时间为2022年11月22日。胸部CT检查示:双肺多发转移,部分病灶较前缩小(图4d)。2022年12月患者无诱因下出现恶心、呕吐、头晕症状,在当地医院查头颅MRI示:右侧小脑半球见团片状高密度影,范围约2.6 cm×2.4 cm,周围见水肿带(图5a)。头颅CT示:右侧小脑半球高密度影(图5b)。神经外科会诊,不支持颅内原发肿瘤,考虑为肿瘤脑转移,暂无手术指征,建议放疗。患者于2023年1月3日开始在当地医院接受颅内转移灶放疗,共完成受照射剂量48 Gy/8 Fx,放疗后患者症状缓解。2023年2月7日患者因咳嗽胸闷,偶有痰中带血再次入院,复查血清CA125为39.4 U/ml(图3)。胸部CT示:双肺多发转移,病灶较前增大。头颅CT示:右侧小脑半球混杂密度影,脑白质疏松,脑萎缩。于2023年2月10日予信迪利单抗静脉注射+仑伐替尼口服治疗,1个周期后复查胸部CT示缓慢进展,2023年2月24日开始调整为信迪利单抗+仑伐替尼+吉西他滨化疗3个周期,其间复查胸部CT示病灶进一步增大,而头颅CT示:颅内病灶及水肿带较前缩小(图5c)。患者颅内病灶控制,但肺部转移灶缓慢进展,伴有胸闷、气短、呼吸困难等肺部症状,于2023年5月宣告死亡。
2
输卵管癌脑转移治疗策略的文献回顾
输卵管癌在临床上较为罕见,仅占妇科肿瘤的0.3%~1.6%[5],虽然输卵管癌与卵巢癌具有相似的转移模式,但输卵管癌更倾向于向远处部位转移[6]。纳入的2例输卵管癌患者均在初次进展时发生远处转移,病例1患者以脑部作为首发转移部位,而病例2患者以肺部作为首发转移部位,随后转移至脑部。中枢神经系统的早发转移是预后不良的指标,因输卵管癌脑转移的临床数据较少,根据FIGO建议,可参考卵巢癌脑转移的治疗策略[4]。根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[7]及中国临床肿瘤学会(Chinese Society of Clinical Onco logy,CSCO)指南[8]建议,对于卵巢癌ⅣB期及复发性转移患者,可选择的治疗策略包括手术、化疗、靶向治疗、抗血管生成治疗、免疫治疗及放疗。针对本研究所纳入的2例患者均出现脑转移,因中枢神经系统的特殊性,全身用药难以透过血-脑脊液屏障,且多数患者确诊时已是晚期阶段,限制了有创性及不良反应严重的治疗方式的推广应用,如何选择针对脑转移的低毒高效治疗策略成为脑转移治疗的关键。
2.1 手术
对于卵巢癌孤立性脑转移患者,接受手术切除可将OS时间延长至16个月,显著长于未接受手术治疗的患者(4个月)[9]。日本一项多中心回顾性研究结果显示,接受初始伽玛刀放射外科(gamma knife radiosurgery,GKRS)治疗的卵巢癌患者24个月后的OS率达到45.1%[10]。GKRS作为一种微创技术,可将高剂量的伽马射线精确传递至大脑中的多个或深层病灶,弥补了传统手术的局限[9],同时减小了对周围大脑组织的损伤,显著提高预后。但对于发生脑转移的晚期患者,手术治疗对患者的预后及生存质量改善不明显,在临床上不作为首选,更倾向于内科治疗手段,因此本文纳入的2例患者均以内科治疗为主。
2.2 放疗
全脑放疗曾是治疗多发性脑转移的主要方式,但因其可对认知功能造成不可逆损伤,近年来在脑转移中的应用尚存争议[11]。相较而言,立体定向放射外科(stereotactic radiosurgery,SRS)引起认知功能损伤的发生率更低[12],与有2~4个转移灶的患者相比,有5~10个脑转移病灶接受SRS治疗后OS时间无明显差异[13]。随着SRS模式的不断发展和优化,研究发现,27~35 Gy剂量分3~5次的分次SRS作用于直径21~40 mm的颅内病灶,1年局部控制率可达到80%[14],支持了SRS在脑转移患者中的常规应用。本文2例患者均接受了颅内病灶放疗,放疗后颅内病灶均明显的缩小,病例1达到了CR。
2.3 化疗
全身性化疗对脑转移瘤的效果有限,药物脑中暴露量较低,提高药物血-脑脊液屏障的透过性成为增强化疗效果的手段之一。鞘内化疗可直接提高药物在脑脊液中的暴露量,一项前瞻性Ⅱ期研究对实体瘤软脑膜转移患者同步进行放疗及鞘内化疗,神经症状改善率达到72%[15]。除此之外,放疗[16]、聚焦超声联合微泡[17]、渗透压疗法[18]等短暂破坏血-脑脊液屏障的手段,一定程度上增加药物在脑组织中的暴露量,与化疗联合用于脑转移的管理已得到临床认可。本文病例1患者在治疗期间规律使用甘露醇缓解颅内高压症状,甘露醇与放疗的结合,一定程度上提高了化疗的效果,达到有效局部控制。
2.4 靶向治疗
2.4.1 聚腺苷二磷酸核糖聚合酶抑制剂(poly ADP ribose polymerase inhibitor,PARPi) 靶向治疗手段在卵巢癌中的应用证据日益充分,在一线维持治疗或复发维持治疗中的应用均能获得较好的效果,同时相比细胞毒性化疗药的全身应用,PARPi的靶向治疗安全性更高。其中针对发生脑转移的患者,2023年英国的1项回顾性研究中纳入了39例卵巢癌脑转移患者,结果表明,接受PARPi治疗的患者中位无进展生存时间更长[19]。目前常用于输卵管癌维持治疗的PARPi包括奥拉帕利、尼拉帕利和帕米帕利。临床前研究证实,与奥拉帕利相比,尼拉帕利具有较高的血-脑脊液屏障穿透能力和脑肿瘤抑制率(56.4%∶15.6%)[20],因此尼拉帕利较奥拉帕利应用于脑转移患者治疗优势更明显。本文病例1患者进行了基因检测,结果未见BRCA突变,铂敏感复发阶段因脑转移采用了贝伐珠单抗联合化疗,后给予贝伐珠单抗维持治疗,取得了较好的疗效;而病例2患者未常规进行基因检测,且对含铂方案化疗不敏感,病情持续进展,使用PARPi的获益可能性仍需综合考虑,因此本文2例患者未接受PARPi治疗。
2.4.2 抗血管生成药物 1项Meta分析结果显示,使用抗血管内皮生长因子(vascular endothelial growth factor,VEGF)治疗后脑转移发生率更低[21]。贝伐珠单抗是临床常用的抗VEGF药物,在卵巢癌脑转移的个案报道中显示,含贝伐珠单抗的一线化疗联合放疗可使血清CA125水平明显下降[22]。同时贝伐珠单抗亦具有缓解脑水肿的作用,控制率达到86.75%[23]。本文中2例患者均接受了抗血管生成治疗,病例1采用放疗同步贝伐珠单抗及化疗,疗效评估为颅内CR、颅外PR,达到较为理想的疗效;病例2在放疗后序贯口服仑伐替尼及免疫治疗,尽管肺部病灶持续进展,但颅内疗效评估达到PR。
2.5 免疫治疗
免疫治疗以干预免疫系统及肿瘤微环境为主,激活外周T淋巴细胞,随之T淋巴细胞可迅速转运至脑组织中起效[24],改善了药物低渗透的缺陷。但卵巢癌及输卵管癌被认为是免疫微环境“冷肿瘤”,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)治疗获益较低,在NCCN指南中,ICI排在后线地位[7]。随着原位疫苗模式的不断创新,放疗与ICI的结合成为抗肿瘤治疗的新型模式,具体而言,通过放疗触发肿瘤抗原的释放,继而辅以ICI的免疫激活作用,重塑免疫微环境,变“冷肿瘤”为“热肿瘤”[25]。本文病例2患者在初始一线治疗阶段对含铂方案化疗不敏感,接受了放疗、化疗及抗血管生成治疗后病情仍持续进展,存在肺转移及脑转移情况,病情较重,在复发后期阶段患者接受信迪利单抗的联合免疫治疗模式,颅内病灶得到控制。
3
总结与展望
本文纳入2例输卵管癌脑转移患者,分别以脑部及肺部作为首发转移部位,是预后不良的表现,但经放疗为主的多学科综合治疗后都表现出颅内病灶的有效控制。对于脑转移的管理,优选手术、放疗等局部控制手段,辅以具有脑转移瘤获益证据的内科治疗,形成以放疗为主的多模式管理,在全身治疗的基础上对脑转移灶针对性干预,可最大限度地减轻肿瘤负担。
近年来,针对脑转移瘤的治疗方式不断创新,但仍具有许多挑战。研究发现原发灶与脑转移灶具有遗传异质性[26],临床主要以原发灶的基因改变作为治疗依据,对颅内病灶效果有限,容易诱发耐药性。但输卵管癌脑转移的病例较少,尚未发现具有临床普遍性的驱动突变,以分子变异指导靶向治疗成为亟待解决的问题。且治疗前常规获取患者颅内病灶样本成为脑转移瘤治疗的一大障碍。目前有不少研究尝试以脑脊液的肿瘤游离DNA检测结果判断颅内病灶的分子特征[27],但能否完全反映颅内病灶的准确突变情况仍待考证。除此之外,预后评估系统是临床决策的直接依据,不同癌种的疾病演变及治疗结局存在异质性,所以不断优化输卵管癌脑转移的特异性预后评估系统成为未来研究的趋势。
综上,未来应进一步深入探究具有脑转移风险的驱动突变,尽早识别高危患者,开发中枢系统高效靶向治疗策略,以高质量的生存期延长为目标,并积极探寻输卵管癌脑转移治疗的解决方法。
参考文献
[1] BORELLA F, BERTERO L, MORRONE A, et al. Brain metastases from ovarian cancer: current evidence in diagnosis, treatment, and prognosis[J]. Cancers (Basel), 2020, 12(8):21-56.
[2] SHONKA N, VENUR V A, AHLUWALIA M S. Targeted treatment of brain metastases[J]. Curr Neurol Neurosci Rep, 2017, 17(4):3-7.
[3] NIK N N, VANG R, SHIH I, et al. Origin and pathogenesis of pelvic (ovarian, tubal, and primary peritoneal) serous carcinoma[J]. Annu Rev Pathol, 2014, 9:27-45.
[4] BEREK J S, RENZ M, KEHOE S, et al. Cancer of the ovary, fallopian tube, and peritoneum: 2021 update[J]. Int J Gynaecol Obstet, 2021, 155(Suppl 1):61-85.
[5] AKKAYA E, SANCI M, KULHAN N G, et al. Prognostic factors of primary fallopian tube carcinoma[J]. Contemp Oncol (Pozn), 2018, 22(2):99-104.
[6] SIEGEL R L, GIAQUINTO A N, JEMAL A. Cancer statistics, 2024[J]. CA Cancer J Clin, 2024, 74(1):12-49.
[7] 卢淮武,叶栋栋,吴斌,等.《2023 NCCN卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南(第1版)》解读[J].中国实用妇科与产科杂志,2023,39(1):58-67.
[8] 李宁,吴令英.中国临床肿瘤学会《卵巢癌诊疗指南(2021 年版)》更新要点[J].中国实用妇科与产科杂志,2021,37 (7):720-723.
[9] CORMIO G, MANEO A, COLAMARIA A, et al. Surgical resection of solitary brain metastasis from ovarian carcinoma: an analysis of 22 cases[J]. Gynecol Oncol, 2003, 89(1):116-119.
[10] MATSUNAGA S, SHUTO T, SERIZAWA T, et al. Gamma Knife radiosurgery for metastatic brain tumors from ovarian cancer: histopathological analysis of survival and local control. A Japanese multi-institutional cooperative and retrospective cohort study[J]. J Neurosurg, 2022, 137(4):1-9.
[11] NABORS L B, PORTNOW J, AHLUWALIA M, et al. Central nervous system cancers, version 3. 2020, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2020, 18(11):1537-1570.
[12] BROWN P D, JAECKLE K, BALLMAN K V, et al. Effect of radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases: a randomized clinical trial[J]. JAMA, 2016, 316(4): 401-409.
[13] YAMAMOTO M, SERIZAWA T, SHUTO T, et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study[J]. Lancet Oncol, 2014, 15(4):387-395.
[14] REDMOND K J, GUI C, BENEDICT S, et al. Tumor control probability of radiosurgery and fractionated stereotactic radiosurgery for brain metastases[J]. Int J Radiat Oncol Biol Phys, 2021, 110(1):53-67.
[15] PAN Z, CHEN K, HE H, et al. A phase Ⅱ study of concurrent involved-field radiotherapy and intrathecal chemotherapy for leptomeningeal metastasis from solid tumors[J]. Radiother Oncol, 2023,186:109-740.
[16] TENG F, TSIEN C I, LAWRENCE T S, et al. Blood-tumor barrier opening changes in brain metastases from pre to one-month post radiation therapy[J]. Radiother Oncol, 2017, 125(1):89-93.
[17] ARVANITIS C D, ASKOXYLAKIS V, GUO Y, et al. Mechan-isms of enhanced drug delivery in brain metastases with focused ultrasound-induced blood-tumor barrier disruption[J]. Proc Natl Acad Sci U S A, 2018, 115(37):E8717-E8726.
[18] PARIS J, ANGELI E, BOUSQUET G. The pharmacology of xenobiotics after intracerebro spinal fluid administration: implications for the treatment of brain tumors[J]. Int J Mol Sci, 2021, 22(3):12-81.
[19] ALIZZI Z, ROXBURGH P, CARTWRIGHT D, et al. Description of a retrospective cohort of epithelial ovarian cancer patients with brain metastases: evaluation of the role of PARP inhibitors in this setting[J]. J Clin Med, 2023, 12(7):2497.
[20] SUN K, MIKULE K, WANG Z, et al. A comparative pharmacokinetic study of PARP inhibitors demonstrates favorable properties for niraparib efficacy in preclinical tumor models[J]. Oncotarget, 2018, 9(98):37080-37096.
[21] MANSOURI A, PADMANABAN V, AREGAWI D, et al. VEGF and immune checkpoint inhibition for prevention of brain metastases: systematic review and meta-analysis[J]. Neurology, 2021, 97(15):e1484-e1492.
[22] 许慧,杨慧敏,陶敏,等.卵巢高级别浆液性腺癌术后化疗后脑转移1例[J].牡丹江医学院学报,2021,42(1):123-125.
[23] BAI X, ZHANG Y, DING W, et al. Efficacy of bevacizumab in the treatment of refractory brain edema of metastatic tumors from different sources[J]. Neurol Res, 2021, 43(12):955-960.
[24] CHAMBERLAIN M C, BAIK C S, GADI V K, et al. Systemic therapy of brain metastases: non-small cell lung cancer, breast cancer, and melanoma[J]. Neuro Oncol, 2017, 19(1):i1-i24.
[25] GOTO T. Radiation as an in situ auto-vaccination: current perspectives and challenges[J]. Vaccines (Basel), 2019, 7(3):100.
[26] SUH J H, KOTECHA R, CHAO S T, et al. Current approaches to the management of brain metastases[J]. Nat Rev Clin Oncol, 2020, 17(5):279-299.
[27] PENTSOVA E I, SHAH R H, TANG J, et al. Evaluating cancer of the central nervous system through next-generation sequencing of cerebrospinal fluid[J]. J Clin Oncol, 2016, 34(20):2404-2415.
声明:本文由“肿瘤界”整理与汇编,欢迎分享转载,如需使用本文内容,请务必注明出处。
排版:lagertha
校对:松月
临床2期临床结果
2024-10-31
ImpediMed's SOZO® Digital Health Platform Aligns with Updated Survivorship Standard, Marking a Milestone in Lymphedema Management
CARLSBAD, Calif., Oct. 31, 2024 /PRNewswire/ -- ImpediMed, a leader in medical technologies to clinically monitor and manage fluid and body composition, today announced the National Accreditation Program for Breast Centers (NABPC) has updated its 2024 accreditation standards and, for the first time, these standards include lymphedema prevention programs utilizing bioimpedance spectroscopy (BIS) as an evidence-based guideline for managing lymphedema. As a pioneer in the field of lymphedema detection and monitoring, ImpediMed offers the only FDA-cleared BIS technology for the clinical assessment of breast cancer-related lymphedema (BCRL) –– the SOZO® Digital Health Platform.
The NAPBC is a quality program of the American College of Surgeons, and the NAPBC-accredited programs must understand, implement, and demonstrate compliance with accreditation standards outlined in Optimal Resources for Breast Care. To maintain accreditation, centers must monitor their compliance with these standards and prepare for onsite review every three years. The 2024 Standards focus on the entire patient care journey from screening and prevention, to diagnosis, treatment, and survivorship, with an emphasis on providing value-based multidisciplinary care.
The updated NABPC Standard for Survivorship specifies that NABPC-accredited programs must use evidence-based guidelines to manage survivorship. Examples include, but are not limited to:1
Referral to outpatient rehabilitation for evaluation and treatment of lymphedema, as needed.
Use of a lymphedema prevention program, including regular symptom assessment and clinical evaluation using objective measurements, such as bioimpedance spectroscopy.
"As Breast Cancer Awareness month wraps up, it's especially noteworthy that the NABPC's accreditation standards now recognize BIS as a hallmark of top-tier lymphedema care," said Dr. Parmjot Bains, Managing Director and CEO of Impedimed. "This isn't just an acknowledgement of the impact of BIS technology—it's a beacon of hope for breast cancer survivors everywhere. By including BIS, the NABPC—whose standards are penned by leading U.S. breast cancer experts—is sending a powerful message. They're not just influencing clinicians and healthcare facilities; they're reshaping the landscape of patient care, pushing this innovative approach closer to becoming the gold standard in survivorship support."
Lymphedema, a disabling swelling that is a common consequence of cancer treatment, poses significant challenges in healthcare. According to the American Cancer Society, 58% of cancer patients diagnosed with breast cancer, melanoma, or pelvic area cancers are at risk for developing limb lymphedema. For breast cancer patients specifically, this risk can escalate depending on the type of treatment received. BIS is a groundbreaking technology that is revolutionizing lymphedema care that offers a noninvasive, quick, and highly sensitive method for detecting fluid changes in the body. By sending a small electrical current through the body and measuring the resistance, BIS can identify subclinical lymphedema long before visible symptoms appear – critical for preventing the progression to chronic lymphedema, enabling timely intervention and better outcomes.
ImpediMed's platform is broadly accepted and recognized for effective and accurate screening of lymphedema, with U.S. health insurers now providing coverage for over 146 million covered lives.
To access the full Optimal Resources for Breast Care (2024 Standards) visit the American College of Surgeons' website.
1Used with permission of the American College of Surgeons, Chicago, Illinois. The original source for this information is the American College of Surgeons. Content does not reflect the views or interpretations of the American College of Surgeons.
About ImpediMed
ImpediMed is a leading global medical technology company that designs and manufactures medical devices that employ bioimpedance spectroscopy (BIS) technology for use in the noninvasive clinical assessment and monitoring of fluid status and tissue composition in patients. The company consistently drives innovation, directing its primary efforts toward addressing the specific challenges and devastating burden of secondary lymphedema with a focus on breast cancer-related lymphedema (BCRL). With its SOZO® Digital Health Platform and L-Dex®, ImpediMed is the only company to offer an FDA-cleared technology that uses BIS and is setting new standards in early detection and management of BCRL. For more information, please visit .
About SOZO Digital Health Platform
SOZO, the world's most advanced, non-invasive bioimpedance spectroscopy (BIS) device, delivers a precise snapshot of fluid status and tissue composition in less than 30 seconds. Using ImpediMed's BIS technology, SOZO measures 256 unique data points over a wide spectrum of frequencies from 3 kHz to 1000 kHz. Results are available immediately online for easy data access and sharing across an entire healthcare system. The FDA-cleared, CE-marked and ARTG-listed digital health platform aids in the early detection of secondary lymphoedema, provides fluid status for patients living with heart or renal failure, and can be used to monitor and maintain overall health – all on a single device.
Media Contact:
Jodi Perkins
Amendola Communications, on behalf of ImpediMed
[email protected]
SOURCE ImpediMed
WANT YOUR COMPANY'S NEWS FEATURED ON PRNEWSWIRE.COM?
440k+
Newsrooms &
Influencers
9k+
Digital Media
Outlets
270k+
Journalists
Opted In
GET STARTED
分析
对领域进行一次全面的分析。
登录
或
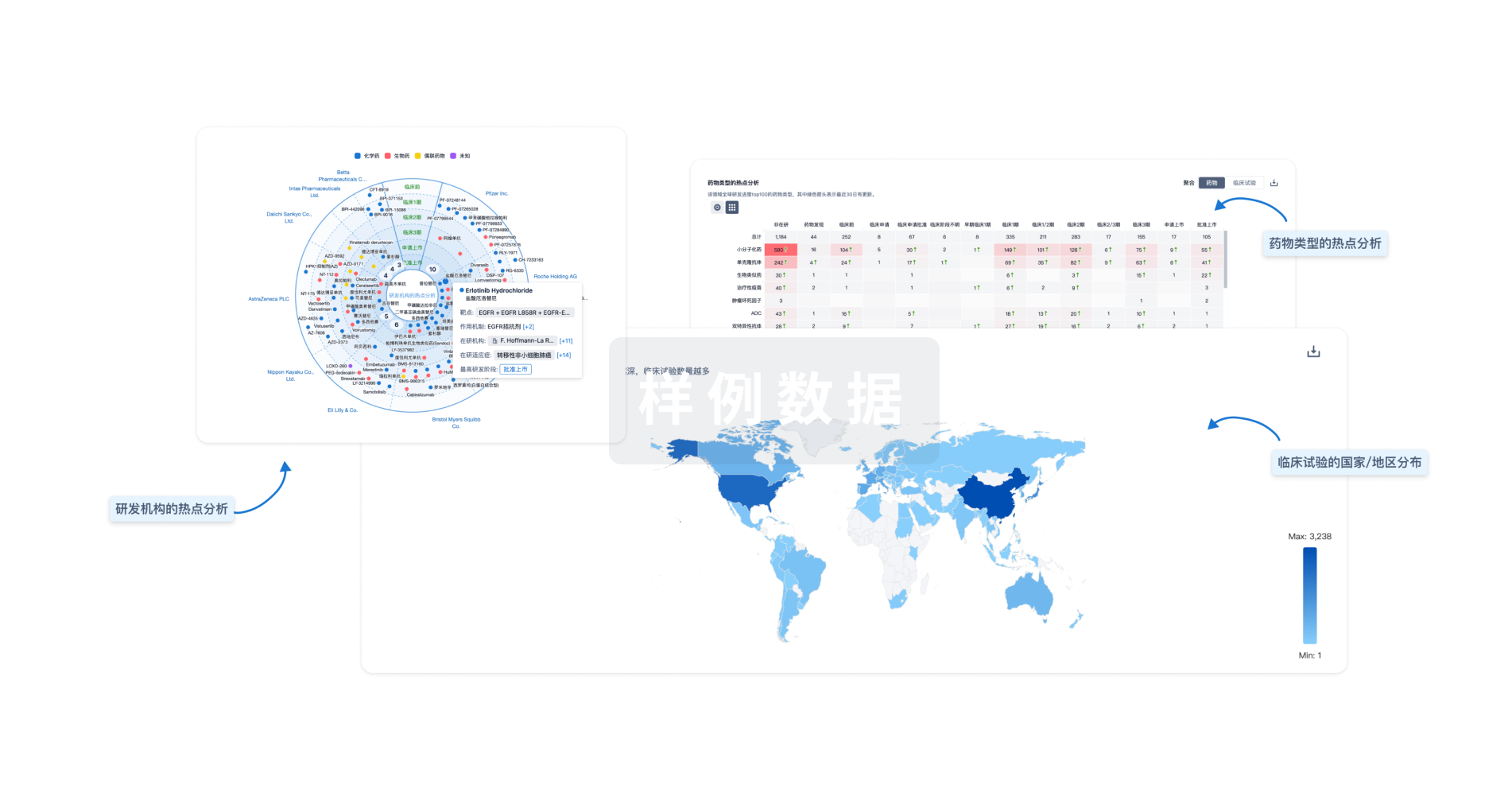
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用





