预约演示
更新于:2025-05-07
Malignant ascites
恶性腹水
更新于:2025-05-07
基本信息
别名 ASCITES MALIGNANT、Ascites, Malignant、MALIGNANT ASCITES + [17] |
简介 Accumulation of fluid in the peritoneal cavity resulting from the growth of primary or metastatic malignant neoplasms in the peritoneum. |
关联
32
项与 恶性腹水 相关的药物靶点 |
作用机制 微管蛋白调节剂 [+2] |
在研机构 |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 韩国 |
首次获批日期2016-07-01 |
111
项与 恶性腹水 相关的临床试验NCT04985357
Defining the Clinical Potential of Mass Response As a Biomarker for Patient Tumor Sensitivity to Drugs
The primary objective of this study, sponsored by Travera in Massachusetts, is to validate whether the mass response biomarker has potential to predict response of patients to specific therapies or therapeutic combinations using isolated tumor cells from varying cancers and biopsy formats.
开始日期2024-11-01 |
申办/合作机构- |
NCT06759064
Efficacy and Safety of Intraperitoneal Immune Checkpoint Inhibitors and Zoledronic Acids in Gastric Cancer Malignant Ascites: a Phase I/II Clinical Study (IPIZA)
This study is to evaluate the safety and efficacy of intraperitoneal injection of immune checkpoint inhibitor combined with zoledronic acid for the treatment of malignant ascites in gastric cancer.
This study is a phase Ib/II clinical study to evaluate the safety and efficacy of intraperitoneal injection of immune checkpoint inhibitors in combination with zoledronic acid in the treatment of malignant ascites in gastric cancer, which consists of two phases, firstly, the phase Ib safety study, which adopts the '3+3' drug-escalation experimental design, and after determining the safe and tolerable dose, it will proceed to the second part of the phase II efficacy study. The Phase II study was designed by Simon's two-stage approach to evaluate the efficacy of immune checkpoint inhibitors in combination with zoledronic acid in the treatment of malignant ascites in gastric cancer.
This study is a phase Ib/II clinical study to evaluate the safety and efficacy of intraperitoneal injection of immune checkpoint inhibitors in combination with zoledronic acid in the treatment of malignant ascites in gastric cancer, which consists of two phases, firstly, the phase Ib safety study, which adopts the '3+3' drug-escalation experimental design, and after determining the safe and tolerable dose, it will proceed to the second part of the phase II efficacy study. The Phase II study was designed by Simon's two-stage approach to evaluate the efficacy of immune checkpoint inhibitors in combination with zoledronic acid in the treatment of malignant ascites in gastric cancer.
开始日期2024-09-12 |
申办/合作机构 |
ACTRN12624000288527
Efficacy of intraperitoneal bevacizumab for decreasing or delaying re-accumulation of recurrent malignant ascites in chemotherapy resistant solid tumours: a randomised trial (REZOLV3R)
开始日期2024-08-05 |
申办/合作机构 |
100 项与 恶性腹水 相关的临床结果
登录后查看更多信息
100 项与 恶性腹水 相关的转化医学
登录后查看更多信息
0 项与 恶性腹水 相关的专利(医药)
登录后查看更多信息
6,047
项与 恶性腹水 相关的文献(医药)2025-06-01·Journal of Trace Elements in Medicine and Biology
Borax pentahydrate as a promising boron-based angiogenesis inhibitor
Article
作者: Sarıcaoğlu, M ; Koparal, A T ; Yetik Anacak, G ; İşel, E ; Keselik, E ; Yılmaz, H ; Özbek, E N ; Akyol Bahçeci, S ; Debeleç Bütüner, B ; Ulus, G
2025-06-01·Translational Oncology
Berberine inhibits metastasis of ovarian cancer by blocking lipid metabolism, alleviating aging of adipose tissue and increasing tumor infiltrating immune cells
Article
作者: Cheng, Zhongping ; Lu, Wei ; Wang, Lian ; Xue, Jiaying ; Cheng, Yujie ; Huang, Jimei ; Zhang, Xiaojie ; Xiong, Bing ; Li, Xiao ; Yang, Weihong ; Zhu, Jihui
2025-04-01·Asia-Pacific Journal of Clinical Oncology
Evaluation of the anticarcinogenic effects of Rutin on brain tissue in mice with Ehrlich ascites carcinoma by micro‐computed tomography and histological methods
Article
作者: Ocak, Mert ; Ateş, Şükrü ; Kahveci, Selda ; Okan, Aslı ; Uçar, Sümeyye ; Doğanyiğit, Züleyha ; Yılmaz, Seher
134
项与 恶性腹水 相关的新闻(医药)2025-04-18
·今日头条
结直肠癌是全球第三大最常见的癌症,而在我国,形势更为严峻—— 发病率直逼恶性肿瘤榜单亚军,死亡率也高居第四,且发病数据仍在不断攀升,让无数家庭笼罩在阴霾之下!但医学探索永不停步,随着新型靶向药物、CAR-T 细胞疗法、癌症疫苗等尖端技术相继 “破土而出”,一场足以颠覆结直肠癌治疗格局的 “精准抗癌革命”,正以雷霆万钧之势席卷而来!
全球肿瘤医生网小编再次为大家精心梳理一份在结直肠癌治疗领域成果卓越的几款癌症疫苗,为广大癌友点亮生命新希望!在与结直肠癌的斗争中,每一款创新疗法都是刺破黑暗的“利刃”,每一次技术突破都是点亮生命的 “曙光”!
一、结直肠癌六大治疗性疫苗全汇总,解锁结直肠癌精准治疗密码
(一)WT1/MUC1-DC:晚期十二指肠癌患者恶性腹水消除,肿瘤52个月未进展
WT1/MUC1-DC是一款WT1和MUC1肽脉冲树突状细胞,全球知名医学杂志《Cureus》曾报道过一个令人瞩目的案例。
一位处于IV期(T3N2M1)的十二指肠癌患者,并伴恶性腹水及远端淋巴结转移。在接受WT1/MUC1-DC+CAT联合治疗后,奇迹发生了:
恶性腹水迅速消退,原发病灶、转移性淋巴结持续缩小,腹膜播散在CT影像中几乎消失
。更令人欣喜的是,
肿瘤长达52个月(约4.3年)未出现进展
。
▼该患者DC联合CAT治疗前腹部CT
▼该患者DC联合CAT治疗后腹部CT
▲图源“Cureus”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
(二)ELI-002疫苗:KRAS阳性结直肠癌/胰腺癌中位总生存超16个月
ELI-002是一款由美国研发的治疗性癌症疫苗,专攻KRAS突变阳性实体瘤,尤其适用于结直肠癌(52%患者携带该突变)和胰腺导管腺癌(93%患者携带该突变)。这款疫苗由两大核心成分组成:AMP-CpG(一种特有的免疫激活剂)、AMP-mKRAS-肽(一种经修饰的KRAS突变肽,相当于“信号塔”,可引导机体免疫系统,追踪并摧毁携带KRAS突变的癌细胞)。
1期AMPLIFY-201临床试验(NCT05726864)数据令人振奋:25例入组患者自首剂接种起,
中位总生存期(OS)达16.33个月
(详见下图)。治疗6个月后,23例可评估患者中,
77%的肿瘤标志物显著下降
,更有
6例实现完全缓解(CR),意味着体内癌细胞被彻底清除
。
▲图源“nature medicine”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
(三)cevumeran(新抗原mRNA疫苗):助直肠癌患者达完全缓解
cevumeran(BNT122、RO7198457)是一款突破性的个体化新抗原mRNA疫苗,可编码20余种特异性肿瘤新抗原。其创新之处在于,通过分析患者肿瘤组织的特异性体细胞突变数据,量身定制疫苗序列,精准激活机体针对多种新抗原的T细胞免疫应答,有效降低肿瘤复发风险,显著延长患者生存周期。
1期GO39733临床试验(NCT03289962)数据令人振奋:在晚期实体瘤治疗中,一位直肠癌患者(21号)经该疫苗治疗后数据亮眼。该患者确诊为微卫星稳定且PD-L1低表达的直肠癌,经过两线治疗后,肺部仍存在1.1cm的靶病灶与非靶病灶。然而,在接受cevumeran联合阿替利珠单抗治疗后,竟奇迹般实现
完全缓解(CR)
,
且这一缓解状态持续长达8.2个月
。截至临床数据统计时,
该患者已成功生存超40.7个月(3年有余)
,为晚期癌症治疗领域提供了极具价值的成功典范。
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
(四)APCEDEN(自体DC疫苗):实体瘤中位总生存达356天
APCEDEN是一款获批上市的自体树突状(DC)细胞疫苗。2017年,印度食品药品监督管理局批准其用于治疗结直肠癌、非小细胞肺癌、前列腺癌和卵巢癌等难治性恶性实体瘤。
该疫苗的获批依据源于两项研究:2014年的单组开放标签研究,以及2017年的回顾性分析。数据显示:接受APCEDEN治疗的患者
中位生存期(OS)达356天
,
较对照组的157天显著延长199天
。在首次评估即达到免疫相关客观反应的患者中,
无事件生存期(EFS)更是长达439天
。不过,现有临床证据仍不足以支撑其获得更多国家或地区的监管批准。
(五)GRANITE(个性化新抗原癌症疫苗):高危结直肠癌的进展/死亡风险降低48%!
GRANITE(GRT-C901/GRT-R902)作为个性化新抗原癌症疫苗,在一线转移性微卫星稳定结直肠癌(MSS-CRC)治疗领域传来捷报。其2/3期临床研究(NCT05141721)第2期数据显示,该疫苗显著改善患者无进展生存期(PFS)。
截至2024年3月8日的分析结果令人振奋:与对照组相比,GRANITE治疗使全体患者
疾病进展或死亡风险降低18%
(HR=0.82,95%CI:0.34-1.67);在高危患者群体(超90%伴肝转移)中,
风险更是大幅下降48%
(HR=0.52,95%CI:0.15-1.38)。此外,GRANITE组
中位无进展生存期(PFS)达11.57个月(95%CI:7.36-NA)
,
远超对照组的7.06个月(95%CI:2.04-NA)
,为MSS-CRC治疗提供了极具潜力的新方案。
▲图源“OneLive”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
二、小编寄语
过去十年,结直肠癌的治疗已经取得了长足的进展,逆转了晚期患者的生存期,除了上面整理的内容,还有更多的抗癌新药/新技术正在研发中,更多的结直肠癌患者获得更长的生存期!
三、参考资料
[1]Yagawa Y,et al.Peritoneal Dissemination and Malignant Ascites in Duodenal Cancer Successfully Treated With Adoptive Cell Therapy Using WT1-and MUC1-Pulsed Dendritic Cells and Activated T Cells With No Adverse Effects: A Case Report[J]. Cureus, 2024, 16(11).
https://www.cureus.com/articles/308954-peritoneal-dissemination-and-malignant-ascites-in-duodenal-cancer-successfully-treated-with-adoptive-cell-therapy-using-wt1--and-muc1-pulsed-dendritic-cells-and-activated-t-cells-with-no-adverse-effects-a-case-report#!/
[2]Pant S,et al.Lymph-node-targeted, mKRAS-specific amphiphile vaccine in pancreatic and colorectal cancer: the phase 1 AMPLIFY-201 trial[J].Nature medicine,2024:1-12.
https://www-nature-com.libproxy1.nus.edu.sg/articles/s41591-023-02760-3
[3]Lopez J,et al.Autogene cevumeran with or without atezolizumab in advanced solid tumors: a phase 1 trial[J]. Nature Medicine, 2025: 1-13.
https://www-nature-com.libproxy1.nus.edu.sg/articles/s41591-024-03334-7
本文为全球肿瘤医生网原创,默认授权禁止转载。
疫苗信使RNA免疫疗法临床1期细胞疗法
2025-03-28
·医药速览
前 言研究表明,Epcam(epithelial cell adhesion molecule,上皮细胞黏附分子)参与了肿瘤干细胞、细胞增殖、代谢、血管生成、上皮向间充质转化(EMT)、转移、化疗/放射抵抗和免疫调节等过程。在肿瘤发展过程中,EPCAM会与许多关键信号通路如Wnt/β-catenin、转化生长因子-β/SMAD、Epex/EGFR、PI3K/Akt/mTor和P53等发生串扰,诱导肿瘤细胞产生生物学变化。例如增强Epcam表达能通过阻止细胞间黏附、促进免疫逃逸或激活白血病和结肠癌的下游致癌基因来促进癌症侵袭。在早期食道癌中,发现EpCAM表达减少会诱导EMT(上皮-间叶细胞转化过程),加速新陈代谢。所以Epcam在癌症发展过程扮演的角色“敌友难辨”鉴于其在癌症过程的复杂作用,EpCAM已成为癌症治疗中充满前景的靶点。并可作为监测CTCs(循环肿瘤细胞)和CSCs(肿瘤干细胞)的生物标志物。因此本文集中讨论了Epcam的结构特征和生物学功能。01EpCAM的结构特征Epcam(epithelial cell adhesionmolecule)亦称CD326,隶属GA733蛋白家族,是一种I型跨膜糖蛋白和同型Ca2+非依赖性细胞粘附分子,在多种正常上皮细胞的基底膜中低水平表达(结肠表达水平最高),而在癌细胞膜上广泛表达,尤其是鳞癌和腺癌。同时Epcam也是当前全球首个进入靶向CAR-T细胞疗法相关临床研究的靶点相关研究发现Epcam会参与细胞黏附过程,但其粘附性与钙粘附素相比更弱。值得注意的是,借助EpCAM的细胞黏附会受到CD44结合的claudin-7影响。EPCAM与两个claudin-7 和cLaudin-1分子相互作用,通过阻止其降解,来调节紧密连接的功能。当敲除EPCAM基因后,claudin-7和 claudin-1都会减少,紧密连接增加,细胞更不容易裂解,证明EpCAM在肿瘤侵袭和扩散中起着重要作用。图1:Epcam结构示意图02肿瘤生物学中扮演角色图2 EpCAM在肿瘤发生发展中的作用一癌症干细胞先前研究表明,EpCAM会在人类胚胎干细胞上广泛表达,并在分化过程中发挥关键作用。Kuan 等人研究发现,Epex和EpCAM可以提高OCT4、SOX2、KLF4和c-myc的重编程效率,并通过STAT和HIF-2α诱导成纤维细胞向多能干细胞分化。在癌症治疗领域,EpCAM是一个非常经典的CSCs(肿瘤干细胞)标志物。表达EpCAM的肿瘤细胞展现出更强的癌变能力,和更强的干细胞特性(化疗/放射抵抗、增强的成瘤性、血管生成、耐缺氧和转移集落形成能力)。二细胞代谢与血管生成比较四种表达EpCAM和AFP的肝癌,发现EpCAM+/AFP+人群的微血管密度和EGF表达水平较高。此外,Sankpal 等人发现EPCAM可调节IL-8和NF-κB转录因子在BC侵袭和血管生成中的活性。针对VEGFR2/EpCAM的双抗的增强效应及通过降低IL-8和IL-6对血管生成的调节表明EpCAM可能是预防肿瘤进展中血管生成的理想靶点。三免疫逃避和调节EpCAM会参与肿瘤免疫调节,Park等人推断EpCAM含量较高的肝癌会通过上调癌胚抗原相关细胞黏附分子1来抵抗NK细胞介导的细胞毒作用。与之类似,EpCAM+CD45+卵巢癌细胞通过过度表达主要组织相容性复合体I类抗原(MHC-I)来逃避NK细胞介导的免疫监控。四EMT过程中的动态表达和背景依赖性EpCAM在EMT(上皮细胞-间充质转化)过程中处于动态并具有背景依赖性(图2D)。鉴于EpCAM是一种黏附分子,推测EpCAM的表达下调是为了提高癌细胞迁移率,但细胞黏附分子通过干扰α-连环蛋白和F-肌动蛋白之间的联系而减弱E-钙粘附素介导的细胞间黏附作用。此外,EPCAM与EMT相关基因的表达呈正相关。在不同的研究中得到的结果并不一致。在TGF-β1诱导的食管癌细胞内皮细胞转化过程中,Epcam在细胞膜表面的表达显著减少,细胞的迁移、侵袭和扩散能力得到了提高。而低表达的EpCAM增强了癌细胞的EMT,并与子宫内膜癌的晚期肿瘤分期和淋巴转移发生相关。03EpCAM在临床肿瘤学中的应用图3 EpCAM的功能和应用EpCAM仅在上皮性肿瘤中表达,在外胚层或中胚层肿瘤中不表达。但EPCAM在乳腺癌、肝癌和胰腺癌中的表达水平与预后不良相关,而在甲状腺和肾癌中过度表达则预后较好。但在食道癌和结直肠癌中,EpCAM过度表达与患者生存之间的相关性仍然存在争议,这表明EpCAM对癌症或抑制或促进作用其实更取决于肿瘤微环境和癌症类型。但Epcam在肾癌中的表达有很高的预后价值。 表1 :EpCAM与其他生物分子联合检测对肿瘤预后和诊断的作用一肿瘤中表达及预后价值EpCAM参与了癌症多个进程。除了其在预测转移和检测CTCs方面的诊断和预后价值外,它在癌症中的独特表达模式使其成为诊断和预后的生物标记物,详见表2 表2:EpCAM在肿瘤治疗中的免疫治疗应用二基于EpCAM的CTC检测与诊断方法CTCs(肿瘤循环细胞)是检测癌症转移的重要标志。CTC在肿瘤转移过程中起主要作用,是多种癌症的预后指标。CTCs是非常罕见的细胞(每毫升患者血液中有1-10个CTCs),其中只有少数具有转移能力。测量外周血中的这些细胞,除了更准确地确定疾病的阶段外,对病人的伤害也较小。但值得注意的是epcam不会在CTCS表面表达。但epcam会在大多数上皮源性癌症高度表达,因此是检测CTCs的一个标志物。然而,通过EpCAM检测CTCs的方法存在不足之处。传统的基于EpCAM的CTC检测策略仅限于EpCAM阳性的CTC,并且由于EMT,还可能忽视最具侵袭性的肝癌CTC亚群的风险,导致循环中CTC的总数偏小。三化学修饰和靶向治疗先前研究表明,EpCAM在人类胚胎干细胞上广泛表达,并在分化过程中发挥关键作用。Kuan 等与传统的抗体介导的肿瘤治疗相比,可以用核酸适配体来提高药物递送的特异性和亲和力。由于EpCAM在肿瘤细胞上高度表达,尤其是CSCs,靶向EpCAM的适配体被广泛应用于癌症治疗。与双特异性抗体类似,用双特异性适配子同时靶向CD44和EpCAM比单适配子效果更好。此外,该适配子对寄主无毒性,对天然免疫无激活作用。04EpCAM在免疫治疗中的应用一单抗临床上已报道了许多有希望用于癌症治疗的EpCAM抗体(表3)。表3 EpCAM在肿瘤治疗中的免疫治疗应用第一个单克隆EpCAM抗体edrecolomab(17-1A)是从小鼠腹水中提取的IgG2a,但在多种腺癌中的治疗效果有限,这可能是因为它和肿瘤的亲和力较低。随后开发了抗体工程和人源化抗体ING-1和3622W94,并在腺癌中进行了测试。这两种抗体与EpCAM具有较高的亲和力,但耐受性较低,并会诱发胰腺炎。激素难治性前列腺癌患者的I期研究和EpCAM阳性复发或难治性晚期乳腺癌的IB期研究证实了adecatumab的有效性。EpAb2-6则是一种新的EpCAM中和抗体,它通过抑制EpicD/β-连环蛋白复合体的核转位和诱导结肠癌细胞凋亡发挥抗肿瘤作用。此外,EpAb2-6通过提高A2表达所需温度和降低PD-L1蛋白水平来增强CD8+T细胞的细胞毒活性来阻止肿瘤进展。二EpCAM双特异性抗体及其变体已开发双特异性或嵌合抗体来增强抗肿瘤疗效(上表3)。Catumaxomab(Removab)具有两个抗原结合位点(EpCAM和CD3)和一个Fc结构域,在体外可启动T细胞介导的杀伤、细胞因子相关的细胞毒作用、抗体依赖的细胞介导的细胞毒(ADCC)性和补体依赖的细胞毒性(CDC)。在II/III期研究的恶性腹水患者中,Catumaxomab治疗组的总生存期(OS)显著延长。MM-131是一种抗EpCAM/Met双特异性抗体,对Met信号通路既有依赖又有非依赖性抑制作用,对Met诱导的肝癌、BC、胃癌和肺癌的增殖均有抑制作用。双特异性T细胞结合抗体(BITE)通过将T细胞与癌细胞联系起来,刺激T细胞活化、肿瘤杀伤和细胞因子的产生,从而增强患者对肿瘤的免疫反应。Solitomab(MT110)是一种与EpCAM和CD3结合的双特异性T细胞结合抗体(BITE),可有效治疗原发性子宫和卵巢癌肉瘤。MT110的作用机制主要依赖于T细胞活化后穿孔素和颗粒酶的释放。但由于其胃肠道毒性,solitomab最终被停用。EpCAM反义寡核苷酸1H8/CD3成功地抑制了肝癌移植瘤的生长,并降低了大多数CSC生物标志物的表达。为了降低T细胞活化引起的有害细胞因子毒性,开发了靶向NK细胞上的CD16和肿瘤细胞上的EPCAM的双特异性NK细胞活化子(Bike),以此介导ADCC对EPCAM+HT-29结肠癌细胞的杀伤作用。经白介素15交联剂修饰的三特异性NK细胞激活剂(TRIKE)与BIKE相比,对NK细胞的激活、增殖和存活均有改善。三EpCAM ADCEpCAM抗体-药物结合物(ADC)也在应用于EpCAM+癌症治疗(表3)。Oportuzumab monatox由抗EpCAM单链可变区和假单胞菌外毒素A(ETA)片段组成,在ADC内化和ETA释放后发挥抗瘤作用。与之类似,Citatuzumab bogatox是由抗EpCAM Fab和非免疫原性九重葛毒素组成。针对各种癌症的I期和II期临床试验表明,它们对癌症治疗都具有良好的耐受性和有效性。Tucotuzumab celmoleukin(EMD 273,066,Huks-IL2)是通过将白细胞介素2(IL-2)基因融合到人源化的抗EpCAM单抗上而产生的一种免疫细胞因子,这种基于抗体的新疗法可能通过IL-2激活淋巴细胞。此外,Tucotuzumab celmoleukin与射频消融联合应用可增强小鼠结肠癌的抗肿瘤作用和免疫记忆。Tucotuzumab celmoleukin对癌症患者的安全性和有效性在I期和IB期研究中得到证实。体外细胞系分析和体内动物实验证明,更多ADC有望用于癌症治疗。ChiHEA125-AMA是α-Amanitin与嵌合的抗EPCAM单抗的偶联物,在胰腺癌、乳腺癌和其他癌症中展现出抑制肿瘤的潜力。相应地,吲哚苯二氮二聚体(IGN)与EpCAM(EpCAM-IGN)抗体的结合显示出剂量依赖性的抗肿瘤活性。四CAR-T除了抗体介导的治疗外,细胞免疫,特别是T细胞治疗,在癌症治疗中展示出一定前景。最近一项研究表明,异位表达miR-200C和EpCAM的CD8+T细胞会降低细胞凋亡,并增强抗瘤反应。靶向EpCAM的CAR - T疗法已取得了一定成功(表2),与EpCAM−急性髓系白血病细胞相比,EpCAM+急性髓系白血病细胞具有更强的致瘤性和化疗耐药性,因为正常骨髓细胞和外周血单核细胞均不表达EpCAM。因此,靶向EpCAM的CAR -T是治疗AML的理想方法。此外,雷帕霉素可抑制mTORC1活性,上调CXCR4,从而促进EpCAM Car T细胞在骨髓中的迁移和穿透能力,治愈急性髓系白血病(AML)。结语随着基础研究的进步,EpCAM被发现在癌症进展中起着多方面的作用。除其在细胞黏附中的作用外,EpCAM还会通过调节胞外和胞内的细胞信号来实现多种功能,EpCAM通过调节细胞特性,如增殖、干细胞、移动性、化疗/放射治疗来调控癌症的进展。但其实无法断言Epcam扮演的是致癌角色或肿瘤抑制角色。但从临床角度来看,EpCAM对癌症患者的诊断和预后有很大的潜在价值。靶向EpCAM的抗体已应用于临床,随着研发人员对epcam了解的不断深入,未来在癌症治疗中将更具价值。推文用于传递知识,如因版权等有疑问,请于本文刊发30日内联系医药速览。原创内容未经授权,禁止转载至其他平台。有问题可发邮件至yong_wang@pku.edu.cn获取更多信息。©2021 医药速览 保留所有权利往期链接“小小疫苗”养成记 | 医药公司管线盘点 人人学懂免疫学| 人人学懂免疫学(语音版) 综述文章解读 | 文献略读 | 医学科普|医药前沿笔记PROTAC技术| 抗体药物| 抗体药物偶联-ADC核酸疫苗 | CAR技术| 化学生物学温馨提示医药速览公众号目前已经有近12个交流群(好学,有趣且奔波于医药圈人才聚集于此)。进群加作者微信(yiyaoxueshu666)或者扫描公众号二维码添加作者,备注“姓名/昵称-企业/高校-具体研究领域/专业”,此群仅为科研交流群,非诚勿扰。简单操作即可星标⭐️医药速览,第一时间收到我们的推送①点击标题下方“医药速览” ②至右上角“...” ③点击“设为星标
免疫疗法细胞疗法临床结果临床1期临床终止
2025-02-26
作者|小麦
近些年来,随着技术的进步,双抗药物得到快速发展。2024年,全球双抗药物市场规模达到约130亿美元。
其中罗氏的用于治疗血友病的Hemlibra全球销量最高,2024年销售额达到45.03亿瑞士法郎(约53.61亿美元)。其次是罗氏的眼科药物Vabysmo增长迅速,2024年销售额为38.64亿瑞士法郎(约46.0亿美元),加上Columvi和Lunsumio,罗氏双抗规模已超百亿美元,占有绝对领先地位(图1)。
在我国,康方生物的两款双抗药物(开坦尼和依达方)表现突出,2024年合计销售额预计超过3亿美元。这表明中国药企在全球双抗市场中已占据重要地位。
图1. 获批上市的双抗药物信息
01
新颖双抗结构和技术
早在1960年,纽约罗斯威尔公园纪念研究所的Nisonoff及其合作者在Science发表的论文中首次提出了双特异性抗体的概念。但是直到 2009年4月,首个双抗Catumaxomab卡妥索单抗被欧洲药品管理局(EMA)批准上市。截止目前,全球已获批17款双抗药物(图1)。
从获批的双抗药物结构中,我们可以看到双抗技术得到了快速发展,双抗的设计和生产逐渐迎来了革新。
早期的双特异性抗体主要通过化学偶联或杂交杂交瘤技术制备,但存在制备复杂、稳定性差等问题。
后来随着基因工程、杂交瘤技术、生物大分子重组等技术的飞速发展,双抗的技术和类型都得到很大的改善,新的双抗技术脱颖而出,包括BiTEs、DART和TandAb等。
BiTE免疫疗法(Bispecific T-cell Engager,双特异性T细胞衔接器)是一种创新的免疫治疗技术,即以T细胞作为效应细胞的双特异性单链抗体,它是采用单链抗体技术,将两个不同抗体的重链及轻链可变区连接在一条多肽链上。
BiTEs具有两个抗原结合部位,可以同时和T细胞及癌细胞表面的抗原分子结合,从而有效地激活效应T细胞来达到杀伤病变细胞的目的(图2)[1]。
图2. BiTE和DART示意图
BiTEs具有以下优点:
1.高效性,能够显著增强T细胞对肿瘤细胞的杀伤作用,即使是在T细胞数量较少的情况下。
2.特异性,通过靶向肿瘤特异性抗原,BiTE疗法能够精准地攻击肿瘤细胞,减少对正常细胞的损伤。
3.广泛适用性,BiTE疗法可以针对多种肿瘤特异性抗原进行设计,具有广泛的应用潜力。
DART技术(Dual-Affinity Re-Targeting)是由MacroGenics公司和Servier公司联合开发的一种双特异性抗体构建技术。
与BiTEs相比,DART具有更有利的结构和生物学特性,包括更大的稳定性和将T细胞毒性靶向恶性细胞的最佳重定向。
基于DART技术开发的双抗分子是由两条多肽链结合形成的异源二聚体抗体。其构建原理是将一个抗体可变区的VH和VL序列分别与另一个抗体可变区的VL和VH序列连接,并在两条多肽链的C末端引入半胱氨酸,通过半胱氨酸形成链间二硫键,增强了抗体的稳定性和抗原结合能力(图3)[2]。
图3. BiTEs、DART和TandAb结构图
TandAb是一种四价双特异性抗体,由两条多肽链反向配对形成同源二聚体分子,其结构为Fv1-Fv2-Fv2-Fv1,包含4个单链可变片段(scFv),能够同时结合两种抗原,且每种抗原有两个结合位点,这种结构显著增强了抗体的结合能力和效力(图3)。
TandAb可以通过多种方法生成,包括重组DNA技术、化学交联和融合蛋白方法。其中,重组DNA技术是主要的生成方式,通过将两个不同的Fv片段串联,形成四价双特异性分子。
TandAb技术凭借其独特的结构设计和高效的功能,在双特异性抗体领域展现出强大的应用前景,为癌症治疗提供了新的策略。
02
代表性双抗药物
2.1 Hemlibra(艾美赛珠单抗)
Hemlibra是日本中外制药株式会社(Chugai Pharmaceutical)发现,并由中外制药和罗氏共同开发由罗氏研发的一种双特异性因子IXa和因子X定向抗体,可桥接活化的 IX 因子和 X 因子以替换缺失的活化因子 VIII 的功能,恢复A型血友病患者的凝血过程(图4)[3]。
图4. Hemlibra作用机制
Hemlibra于2017年11月首次被FDA批准上市并于2018年被FDA扩增新适应症,适用于成人和儿童血友病A患者,无论是否伴有因子VIII抑制剂,用于预防或减少出血事件的发生。
Hemlibra是近20年来FDA批准的首个用于治疗A型血友病的创新药物,凭借其便捷的给药方式和良好的疗效,在血友病A治疗领域占据重要地位。
2018年11月,Hemlibra在中国获批,成为国内首款上市的双特异性抗体药物。截至2024年,Hemlibra已在全球100多个国家获批用于治疗体内存在凝血因子VIII抑制物的A型血友病患者,并在80多个国家获批用于体内不存在凝血因子VIII抑制物的患者。
Hemlibra的研发是迄今为止最大的A型血友病临床研究项目之一,包括多个关键性III期HAVEN研究(HAVEN-1、HAVEN-2、HAVEN-3、HAVEN-4)。这些研究验证了Hemlibra在不同患者群体中的安全性和有效性,包括存在或不存在凝血因子VIII抑制物的患者。
Hemlibra自2017年上市后销售额逐年上升,并于2020年成功突破20亿美元销售额大关,成为重磅品种。2021年,Hemlibra全球销售额为30.88亿瑞士法郎(约34.34亿美元,按当下1瑞士法郎约等于1.112美元,下同),同比增长41%;2022年Hemlibra销售额为38.23亿瑞士法郎(约42.51亿美元),同比增加27%,2023年销售额达到41.47亿瑞士法郎(约49.3亿美元),2024年Hemlibra销售额达到45.03亿瑞士法郎,同比增长12%(图5)[4]。
图5. Hemlibra的销售额
2.2 Vabysmo(Faricimab)
Vabysmo (Faricimab)是由罗氏开发的第一个获批用于眼部疾病的双特异性抗体,作用于血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A),Ang-2和VEGF-A通过破坏血管稳定、导致新的渗漏血管形成和增加炎症,从而导致视力丧失。
通过阻断涉及 Ang-2 和 VEGF-A 的通路,Vabysmo 可以抑制许多威胁视力的视网膜疾病相关的两条信号通路(图6)。
图6. Vabysmo结构与作用机制
Vabysmo 在全球100多个国家获得批准,包括美国、日本、英国和欧盟等,用于治疗新生血管性或“湿性”年龄相关性黄斑变性和糖尿病性黄斑水肿患者等。
2022年1月,Vabysmo首次获 FDA 批准上市,获批适应症有湿性年龄相关性黄斑变性(wAMD)和糖尿病黄斑水肿(DME)。
2023年10月27日,FDA批准Vabysmo用于治疗视网膜静脉阻塞(RVO)患者,成为继wAMD和DME之后第三项获批适应症。
2024年7月,罗氏公布了Vabysmo治疗DME的RHONE-X四年临床试验数据。结果显示,Vabysmo在接受长达四年治疗的DME患者中耐受性良好,超过90%的患者达到DME症状消失的标准。
在该研究中,近80%的患者将治疗间隔延长至每三个月或四个月一次,同时保持了视力改善。
2024年ARVO会议上,在对关键性TENAYA(NCT03823287) 和 LUCERNE (NCT03823300)试验的事后分析中,Philip P Storey 医学博士提供的结果证明了Vabysmo延长的治疗结果,以及其将剂量减少到每20周一次的潜力。
这项为期两年的研究在 wAMD 患者中比较了Vabysmo与Eylea(阿柏西普)(每 8 周给药一次),结果显示近80%的Vabysmo患者实现了12周或16周的给药间隔。
此外,该研究确定,56%每16周给药一次的患者可以使用相同的标准延长至每20周给药一次,而44%的患者由于解剖变化(例如中央子视野厚度增加)不符合这种延长的条件[5]。
Elevatum(NCT05224102)是一项为期 1 年的4 期、多中心、开放标签、单臂、1 年试验,包括黑人或非裔美国人的患者(占总入组人数的 ~45%);西班牙裔或拉丁美洲人(占总入学人数的 ~45%);或美洲原住民、阿拉斯加原住民、夏威夷原住民或太平洋岛民(占总入学人数的 ~10%)。将从 47 个地点招募美国和肯尼亚的大约 120 名未接受过治疗的 DME 患者(年龄≥ 18 岁)。
在ELEVATUM 4期研究中,Vabysmo在种族和民族代表性不足的DME患者群体中显示出显著的视力改善,平均视力表改善12.3个字母(约2.5行),这一效果在不同种族和民族群体中保持一致[6]。
2024年12月13日,罗氏宣布欧洲药品管理局已批准 Vabysmo(faricimab) 6.0 mg 单剂量预充针(PFS)用于治疗nAMD、DME和RVO后黄斑水肿。这三种疾病共同影响了欧盟(EU)的900多万人。
Vabysmo PFS 是第一个也是唯一一个含有双特异性抗体的预充针,为目前可用的 Vabysmo 西林瓶提供了一种方便的替代品[7]。
Vabysmo自上市以来,销售额一直表现不错,2022年它的全球销售额达到5.91亿瑞士法郎(6.6亿美元),2023年全球销售额达到23.6亿瑞士法郎(26.34亿美元),2024年全球销售额高达38.64亿瑞士法郎(约46.0亿美元)(图7)[4]。
图7. Vabysmo近两年各个季度销售额
2.3 Blincyto(博纳吐单抗)
Blincyto是由安进研发的全球首个CD19-CD3双特异性T细胞接合器(BiTE)药物,由两个主要片段抗CD3 scFv(VL-VH)和抗CD19 scFv(VL-VH)组成,于2014年12月3日获FDA批准上市,用于治疗复发的费城染色体阴性的B细胞急性淋巴性白血病(B-ALL)。
2022年12月,Mark等人在ASH会议上报道了Blincyto的ECOG-ACRIN E1910 3期试验结果:中位随访时间为43个月时,Blincyto组和化疗组中位总生存期(OS)分别为未达到和71.4个月(HR=0.42,95%CI:0.24 -0.75)(图8)[8]。
图8. ECOG-ACRIN E1910 3期试验结果
2024年6月14日,安进宣布FDA已批准Blincyto 用于治疗巩固期 CD19 阳性费城染色体阴性 B 细胞前体急性淋巴细胞白血病 (B-ALL) 的成人和儿童一个月或一个月以上的患者,无论可测量的残留疾病 (MRD) 状态如何。
此次批准是 Blincyto的第三个适应症,主要基于 ECOG-ACRIN 癌症研究组领导的 3 期 E1910 临床试验,该试验研究了接受诱导后巩固治疗的新诊断的费城染色体阴性 B 细胞淋巴细胞淋巴瘤患者,旨在深化缓解以获得持久反应。
研究结果表明,与单纯化疗相比,Blincyto加入多期巩固化疗显示出更好的OS。Blincyto联合化疗组 (n=112) 的3年OS为84.8%,化疗组 (n=112) 的 3 年OS为69%,OS风险比为0.42。中位随访期为4.5年,Blincyto联合化疗组的5年OS为82.4%,化疗组为62.5%。
2025年1月29日,欧盟委员会基于ECOG-ACRIN癌症研究组主导的3期E1910临床试验结果批准Blincyto用于新诊断的CD19阳性、费城染色体阴性B细胞前体急性淋巴细胞白血病(B-ALL)成年患者的巩固治疗。
Blincyto自上市后销售额稳步增长,2021年达到4.72亿美元,然后可能由于Blincyto半衰期仅 2 小时,患者需要频繁给药,以及其它药物的竞争导致销售额在2022年下滑至3.36亿美元,不过由于BB-ALL患者的广泛处方销售额得到剧增,2023年Blincyto销售额达到8.61亿美元,2024年第四季度销售额为3.81亿美元,全年销售额达到15.9亿美元(图9)。
图9. Blincyto销售额
2.4 卡妥索单抗(Catumaxomab)
卡妥索单抗是首个获批的靶向CD3和EpCAM的双特异性抗体,是一种三单抗(Triomab)形式,它具有两个特异性抗原结合位点和一个功能性Fc结构域,能够同时靶向肿瘤细胞上的上皮细胞黏附分子(EpCAM)和T细胞上的CD3分子(图10)。
图10. 卡妥索单抗结构与作用模式
卡妥索单抗于2009年获得欧盟(EMA)批准上市,用于治疗恶性腹水。但是卡妥索单抗上市后市场表现不佳。从2009年至2013年,卡妥索单抗的全球销售额持续低迷,分别为166万、332万、443万、454万和270万美元。这种持续的市场表现不佳最终在2017年6月正式退市。
尽管如此,卡妥索单抗在临床试验中展现出的疗效并不差,尤其是在治疗因胃癌导致的恶性腹水方面表现出色。
基于此,凌腾医药重启了卡妥索单抗在国内的开发。2020年7月,卡妥索单抗开展了伴腹膜转移胃癌的国际多中心三期临床试验。2021年4月,卡妥索双抗获得国家药品监督管理局批准的一项用于治疗非肌层浸润性膀胱癌(NMIBC)的1/2期( NCT04799847)的临床试验许可。
2022年11月,凌腾医药欧洲合作伙伴Lindis Biotech 在14届欧洲泌尿系统癌症多学科大会(EMUC)上公布了卡妥索单抗CATUNIBLA I期临床试验最新结果:卡妥索单抗在NMIBC中显示良好的安全性和初步疗效。
2025年2月14日,Lindis Biotech递交的卡妥索单抗上市许可申请(MAA)已获得欧洲委员会(EC)批准,用于腹腔内治疗EpCAM阳性且不适合进一步全身抗肿瘤治疗的成人患者的恶性腹水。
这标志着卡妥索单抗在全球范围内重新获得认可,并为恶性腹水患者带来了新的治疗希望。
2.5 开坦尼和依达方
中国双抗市场竞争激烈,康方生物凭借开坦尼(卡度尼利单抗)和依方达(依沃西单抗)等产品在肿瘤免疫双抗领域占据重要地位。
开坦尼是由康方生物研发的靶向PD-1和CTLA-4 的一种对称的四价双特异性抗体,具有可结晶片段(Fc),于2022年6 月 29 日首次在国内获批上市,用于既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者(图11)。
图11. 开坦尼的结构
开坦尼是中国自主研发的首款双特异性抗体药物,也是全球首个获批的PD-1/CTLA-4 免疫双抗,具有里程碑式的意义。
2024年9月,开坦尼联合含铂化疗方案获批用于局部晚期不可切除或转移性胃或胃食管结合部腺癌患者的一线治疗。
2024年9月,开坦尼联合方案一线治疗晚期胃癌全人群适应症已获国家药品监督管理局(NMPA)批准上市。
该适应症的获批是基于Ⅲ期COMPASSION-15(AK104-302)研究的优异阳性结果:无论PD-L1表达水平如何,开坦尼联合方案相较于化疗能显著延长患者的总生存期并降低死亡风险,对于肿瘤治疗的客观缓解和远期生存获益尤为显著[9]。
开坦尼已被纳入多个临床治疗指南,包括《CSCO免疫检查点抑制剂临床应用指南(2024版)》、《基于PD-L1蛋白表达水平的胃癌免疫治疗专家共识(2023年版)》等,2024年11月,开坦尼被纳入《CACA胃癌整合诊治指南2024版》,成为唯一不限PD-L1表达的优先推荐肿瘤免疫治疗药物。
依达方是由康方生物自主研发的全球首创PD-1/VEGF双特异性肿瘤免疫治疗药物。这是一种四价双特异性抗体,融合了抗PD-1单抗的单链可变片段(scFv)和抗VEGF单抗的完整结构。
依达方于2024年5月获得NMPA批准上市,用于治疗EGFR-TKI治疗失败后的局部晚期或转移性非鳞状非小细胞肺癌(nsq-NSCLC)。
依达方是全球第一个获批上市的“肿瘤免疫+抗血管生成”机制的双特异性抗体新药,也是中国第二个获批上市独立自主的双特异性抗体新药[10]。
依达方获批是基于一项在中国开展的随机、双盲、多中心III期临床研究(AK112-301/HARMONi-A)结果。
研究结果显示:依达方联合化疗组的中位PFS为7.1个月,显著优于对照组的4.8个月(HR=0.46,P<0.001),降低了54%的疾病进展或死亡风险;数据成熟度达到52%时,依沃西单抗联合化疗组的中位OS为17.1个月,对照组为14.5个月,降低了20%的死亡风险[11]。
目前,依达方还在进行多项全球多中心临床研究,包括一线治疗鳞状非小细胞肺癌(sqNSCLC)的3期研究以及与化疗联合治疗EGFR突变非鳞状NSCLC的全球多中心3期研究等。
令人欣喜的是依达方已获得海外授权。康方生物与Summit Therapeutics达成合作,授予其在美国、加拿大、欧洲、日本等地区的开发和商业化权利。Summit也找到辉瑞,与后者的ADC药物开展联合用药研究,不断放大这款双抗药物的潜力。
此外,国产双抗出海交易在2024年呈现大爆发态势,如同润生物与默沙东达成的CD3/CD19双抗交易,金额高达13亿美元。
小结
双抗技术得到快速发展,从早期的主要通过化学偶联或杂交杂交瘤技术制备到现在发展了很多新的技术,如BiTEs、DART和TandAb等,双抗药物的稳定性和活性也得到了大幅度提升。
双抗药物的市场规模也在快速发展,根据市场分析,预计从2024年到2033年,全球双抗药物市场将以37.5%的复合年增长率增长,到2033年市场规模将达到约1926亿美元。
主要参考文献
1.Maria-Elisabeth Goebeler et.al, T cell-engaging therapies — BiTEs and beyond, Nat Rev Clin Oncol. 2020 Jul;17(7):418-434.
2.Sumit Goswami et.al, Developments and Challenges for mAb-Based Therapeutics, Antibodies 2013, 2, 452-500
3. Takehisa Kitazawa et.al, A bispecific antibody to factors IXa and X restores factor VIII hemostatic activity in a hemophilia A model, Nat Med. 2012 Oct;18(10):1570-4.4. Roche Full Year Results 2024
5. ARVO conference unveils positive Vabysmo data
6. Elevatum study design and rationale: a phase 4 trial of faricimab (VABYSMO) in underrepresented patients with DME
7. Roche’s Vabysmo prefilled syringe (PFS) approved in the EU for three retinal conditions that can cause blindness
8. Consolidation Therapy with Blinatumomab Improves Overall Survival in Newly Diagnosed Adult Patients with B-Lineage Acute Lymphoblastic Leukemia in Measurable Residual Disease Negative Remission: Results from the ECOG-ACRIN E1910 Randomized Phase III National Cooperative Clinical Trials Network Trial
9. 唯一不限PD-L1表达优先推荐的免疫药物,开坦尼®被纳入《CACA胃癌整合诊治指南2024版》
10. 康方生物PD-1/VEGF双抗新药依达方®获批上市
11. Ivonescimab combined with chemotherapy in patients with EGFR-mutant non-squamous non-small cell lung cancer who progressed on EGFR tyrosine-kinase inhibitor treatment (HARMONi-A): A randomized, double-blind, multi-center, phase 3 trial.
活动预告
2月27日,苏州播禾破局JPM2025:AI药物研发如何大有可为?|BT/IT 07期
▼
共建Biomedical创新生态圈!
如何加入BiG会员?
免疫疗法
分析
对领域进行一次全面的分析。
登录
或
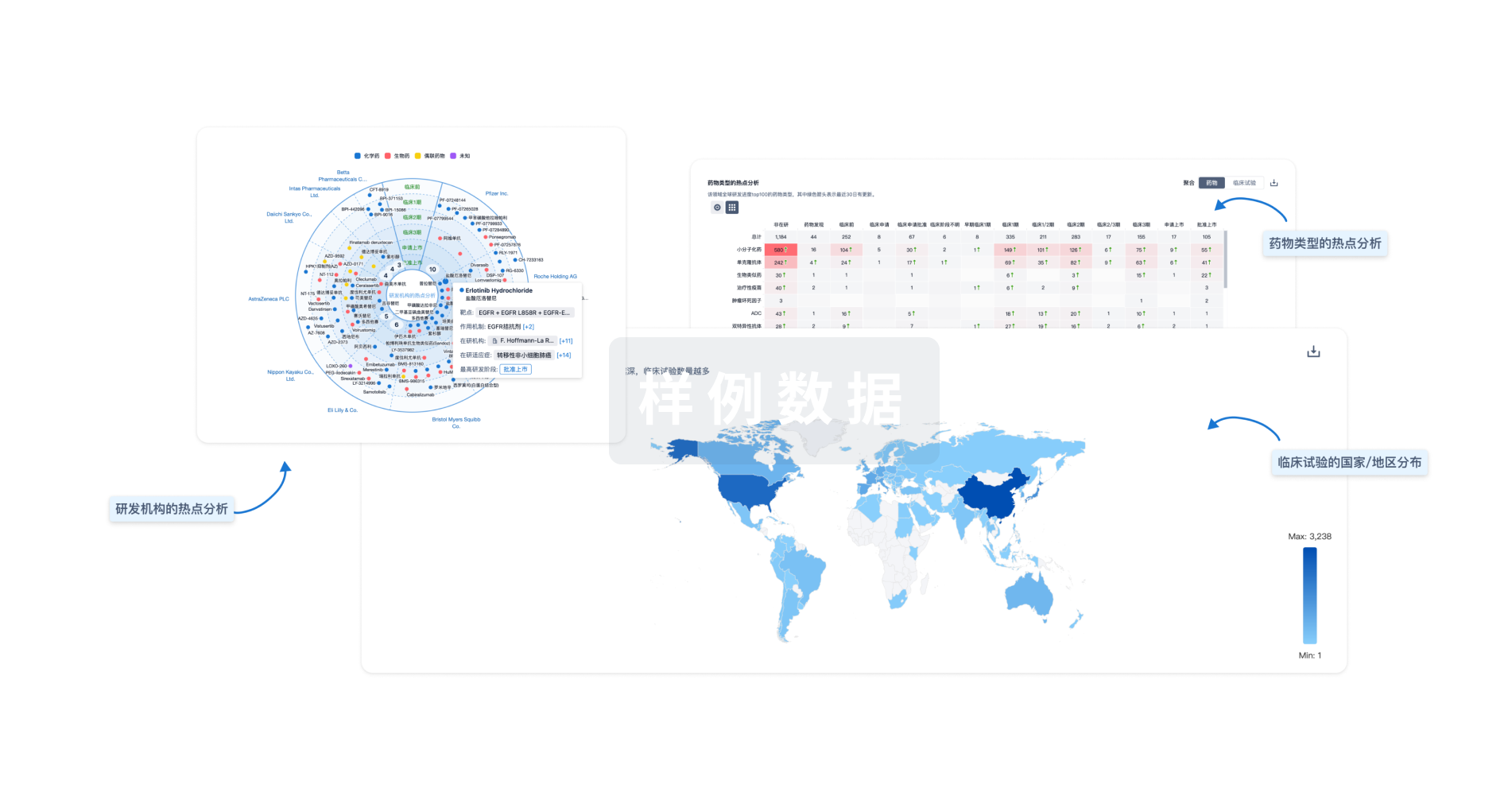
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用





