mRNA疫苗:变局求新 且行且进
2023年4月,在美国癌症研究协会年会(American Association for Cancer Research AACR)上,Moderna和默沙东公布了关于mRNA-4157与Keytruda联合治疗黑色素瘤的2b期临床试验的详细信息。该研究表明,在晚期黑色素瘤患者中,接受Moderna基于mRNA的癌症疫苗与默沙东的重点免疫药物Keytruda联合治疗后,约有79%的患者在18个月后未复发,而仅接受默沙东的Keytruda治疗的患者中有62%未复发。两家公司表示,计划在今年年底前启动三期临床研究。
在新冠疫苗之后,肿瘤治疗将成为mRNA疫苗的下一个重要领域。我们已经迈入了癌症治疗的新时代,但离真正的产品应用还有一段距离。
mRNA疫苗是通过将编码抗原蛋白的mRNA导入人体,直接翻译成抗原,从而诱导免疫系统产生免疫应答。与DNA和病毒载体不同,mRNA疫苗是非整合的、非感染性的,因此不存在潜在的感染或插入突变的风险,相对安全;此外,mRNA在体内表达时间短暂,允许进行重复接种。
新冠疫情的爆发促使mRNA疫苗成功应用,但除了传染病领域,这类产品还具有在肿瘤治疗领域应用的巨大潜力。
据波士顿咨询公司的预测,到2035年,整个mRNA疫苗市场的规模将达到230亿美元,其中mRNA癌症疫苗市场将占据32%的份额,即约为73.6亿美元。这个研发领域正在以极快的速度迅速发展,并展现出良好的前景。
与许多传染病疫苗相比,目前只有少数癌症疫苗被批准供人类使用。癌症疫苗是指可以激发人体产生针对肿瘤细胞或肿瘤微环境(TME)中有利于肿瘤生长的细胞或分子的主动特异性免疫反应,从而抑制或消除肿瘤的生长、复发或转移。癌症疫苗可以分为预防性癌症疫苗和治疗性癌症疫苗两种。目前,大家熟知的HPV疫苗、HIV疫苗等属于预防性癌症疫苗,在全球范围内尚未有治疗性癌症疫苗上市。
利用mRNA疫苗的形式,可以在人体内合成特定的肿瘤抗原蛋白,从而诱导免疫系统有针对性地攻击肿瘤。与现有的PD-1抑制剂和CAR-T细胞疗法不同,mRNA癌症疫苗可以调动患者整个免疫系统,引发更强大、更具针对性的免疫反应。
肿瘤抗原可分为两种类型:肿瘤相关抗原(TAA)和特异性抗原(TSA)。TAA在正常组织和肿瘤中均有表达,但在肿瘤中通常表达过量。因此,TAA具有较弱的肿瘤特异性和免疫原性,并且容易受到中枢免疫耐受的影响。这也是以往在开发癌症疫苗时面临的主要挑战之一。TSA,也被称为新生抗原,与TAA不同,通常在正常细胞中不表达,具有更强的肿瘤特异性和免疫原性,并且能够绕过T细胞对自身表位的中枢耐受。
TSA在大多数肿瘤中都可见。一项对13种不同肿瘤(共计2488个样本)进行的HLA结合肽分析研究发现,每种肿瘤可能产生数十个到数千个不同的新抗原。然而,需要注意的是TSA具有很高的异质性,即使在同一个患者中,突变的类型和数量也有所不同。这给被认为是最佳抗肿瘤靶点的TSA的筛选和鉴定带来了挑战。
尽管mRNA的制备速度快且经济高效(GMP级mRNA可在3周内完成),但对新生抗原的预测环节可能需要更长的时间和费用。此外,在疫苗制备过程中,患者的病情可能会发生变化,可能会错过最佳治疗时机。然而,幸运的是,借助目前大规模高通量的测序检测方法和人工智能的应用,对于新生抗原的预测和鉴定准确性有所提高。
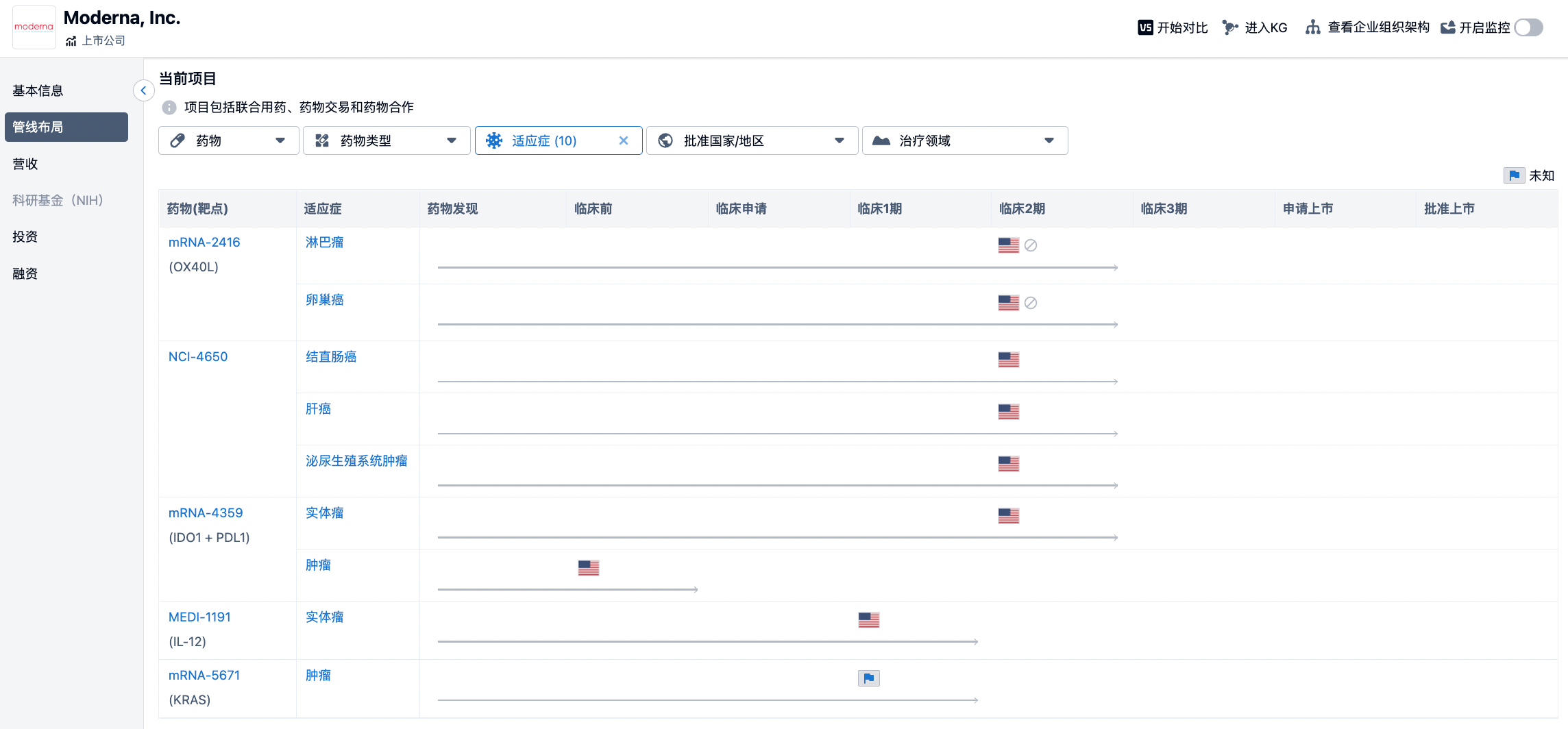
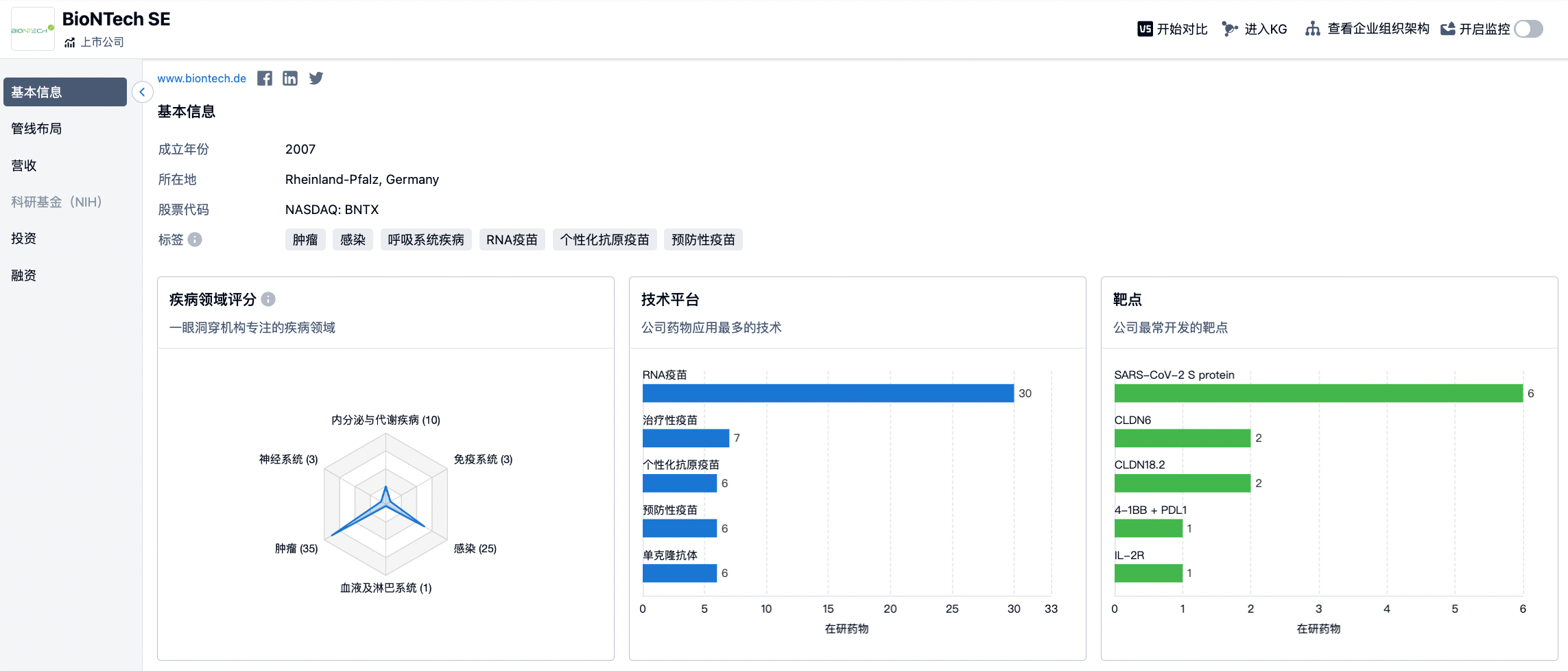
上述两种不同抗原的侧重大致代表了当前通用型和个性化肿瘤疫苗开发的两个方向,当然这种划分并非绝对。纵览BioNtech和Moderna等疫苗巨头的管线,发现均有涉猎。
(点击下方图片直达BioNtech/Moderna机构详情页,即时查看机构在研药物、适应症、临床试验等详细信息)
在肿瘤的发展过程中,对肿瘤相关抗原(TAA)的中央免疫耐受和外周免疫耐受(例如免疫检查点途径和肿瘤微环境)是制约癌症疫苗效果和持续时间的两大挑战。
为了应对中央免疫耐受,可以采用多个TAA或多个TSA的组合。而为了克服外周免疫耐受,可以联合应用免疫检查点抑制剂(如抗PD-(L)1和抗CTLA-4)等药物。
此外,对于个性化mRNA癌症疫苗目前所面临的抗原预测难题,随着个体数据的积累,我们逐渐能够建立共享新生抗原库,以解决同一癌种或不同癌种的抗原预测问题。尽管这是一个漫长的过程,但并非不可实现。随着时间的推移,这将大大加速生产流程。
目前,对于mRNA癌症疫苗的应用前景,业界已经达成了一定的共识,即用于不可手术的肿瘤以及手术、放疗或化疗后的预防复发。研发人员正在综合多种手段,将mRNA癌症疫苗推向免疫治疗的前沿,以发挥更好的疗效。
例如,Moderna的mRNA癌症疫苗mRNA-4157与默沙东的PD-1疗法Keytruda联合应用,在II期临床试验中取得了积极的结果,实现了对mRNA癌症疫苗临床概念验证的突破。然而,我们必须承认,离真正的产品落地还有一段不短的路程需要走。