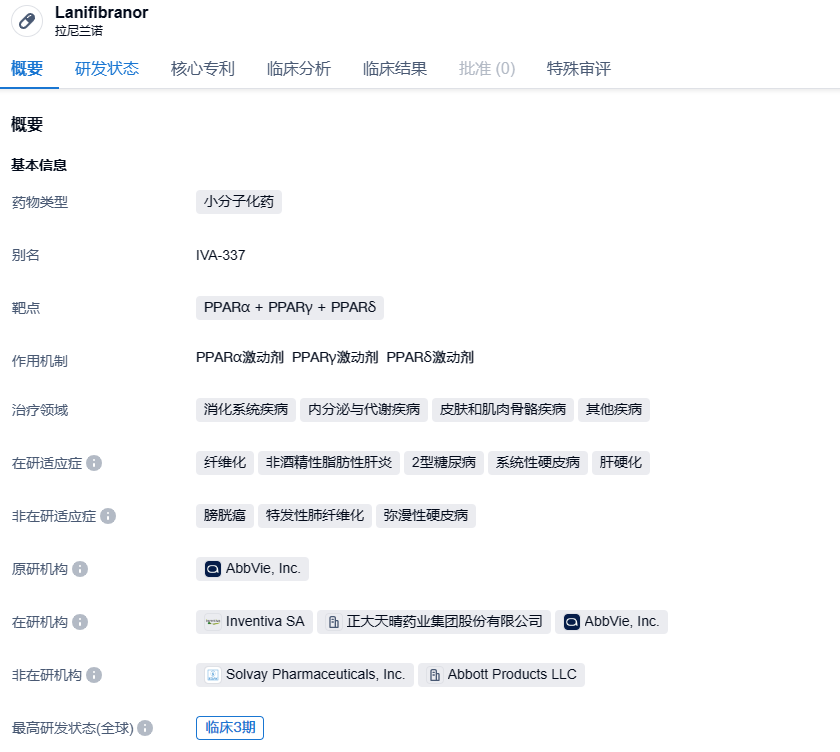
正大天晴泛PPAR激动剂Lanifibranor启动全球性多中心III期临床,治疗NASH
2023年9月11日,正大天晴在药物临床试验登记与信息公示平台上登记了一项全球性多中心III期临床试验,旨在评估Lanifibranor治疗无肝硬化、伴2期/3期(F2/F3)肝纤维化的非酒精性脂肪性肝炎(NASH)成人患者的有效性和安全性。
Lanifibranor是Inventiva开发的一种口服泛PPAR激动剂,对三种PPAR(α/γ/δ)都有中等激动活性,进而诱导抗纤维化、抗炎以及其他有益血管与代谢的身体变化。2022年9 月 22 日,中国生物制药宣布,于 2022 年 9 月 21 日集团附属公司正大天晴与 Inventiva S. A.(Inventiva)签订正式许可协议,以在中国大陆、香港、澳门、台湾(大中华区)开发、生产并商业化拉尼兰诺Lanifibranor。
该试验拟纳入175例患者,是正大天晴合作伙伴Inventiva启动的III期NATiV3研究的一部分,后者已于2021年8月启动并预计将于2025年9月完成。Inventiva表示,如果NATiV3研究取得积极结果,可以向FDA申请Lanifibranor的加速批准,该节点预计为2026年上半年。
此前,Inventiva曾公布过lanifibranor的两项II期临床结果。在纳入了247例伴有肝脂肪变性和中重度坏死性炎症且无肝硬化的成人NASH患者的NATIVE研究中,lanifibranor 1200mg剂量组脂肪变性活动性纤维化(SAF)活动度评分至少降低2分且肝纤维化不恶化的患者比例显著高于安慰剂组(49% vs. 27%;P=0.004或55% vs. 34%;P=0.015)。
在纳入了38例伴2型糖尿病的成人NASH患者的IRB201800838-A研究中,lanifibranor 800mg剂量组患者的肝脏脂肪含量相比安慰剂组显著下降(-44% vs. -12%;P=0.002)。此外,lanifibranor组肝脏脂肪含量降低30%以上的患者比例也显著高于安慰剂组(65% vs. 22%;P=0.008)。
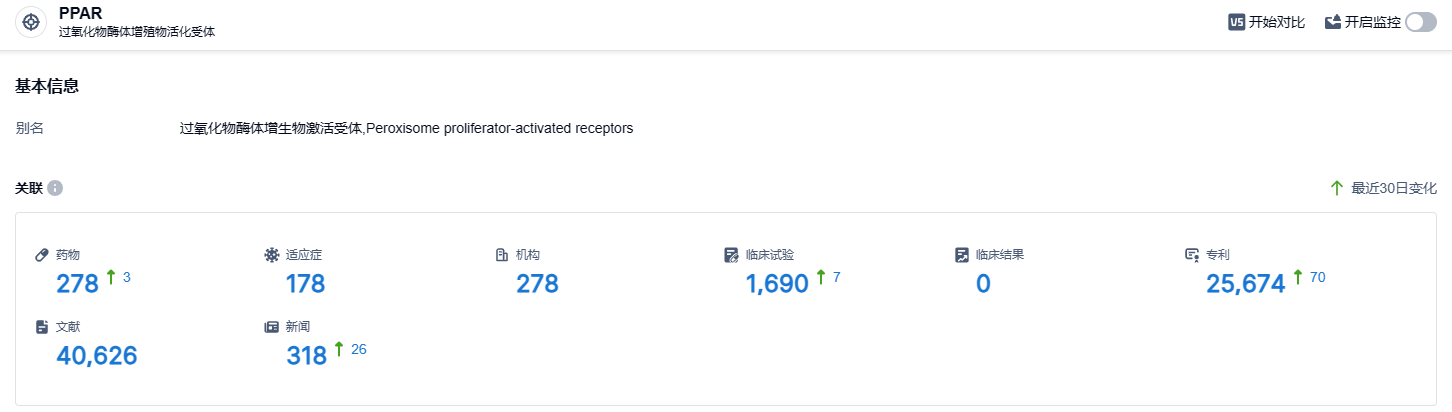
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 PPAR靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月12日,PPAR靶点共有在研药物278个,包含的适应症有178种,在研机构278家,涉及相关的临床试验1690件,专利多达25674件……自1980年NASH被发现以来,NASH药物的研发面临诸多难题,相关靶向药物的研发一直未能突围,吉利德(simtuzumab和selonertib)、诺华(emricasan)、辉瑞(PF-06835919)等头部药企管线均惨遭失败。前路未明,期待Lanifibranor能够研发成功,为NASH患者带来新的治疗选择。