华奥泰生物IL-36R单抗HB0034获得FDA孤儿药资格,治疗泛发性脓疱型银屑病
2023年10月18日,华海药业发布公告称,其下属子公司华奥泰生物在研抗IL-36R单抗HB0034注射液获得美国FDA授予孤儿药资格,用于治疗泛发性脓疱型银屑病(GPP)。据华海药业公告介绍,本次HB0034注射液获得FDA孤儿药资格,将有机会在产品研发、注册及商业化等方面享受相关政策支持。
HB0034为华奥泰生物开发的一款靶向IL-36R(白介素-36受体)的人源化IgG1(免疫球蛋白G1)型单克隆抗体,能特异性结合IL-36R,阻断IL-36炎症通路信号。HB0034 与 IL-36R 结合竞争性阻断受体激动剂(IL36α,β 和 γ)与 IL-36R 的结合,下调下游促炎信号通路和促纤维化信号通路,抑制上皮细胞/成纤维细胞/免疫细胞介导的炎症反应,从而减少炎性疾病/皮肤疾病(包括泛发性脓疱型银屑病、炎性肠病、系统性红斑狼疮、纤维化疾病等)中驱动致病的细胞炎症因子的释放,达到控制疾病的目的。
HB0034在GPP病人的Ib期临床结果显示其单次给药能够迅速控制GPP的急性发作,并且疗效至少可以持续12周。在接受单次HB0034治疗后,第1周77.8%的患者GPPGA脓疱亚项评分达到0/1(无/几乎无可见脓疱),44.4%的患者GPPGA评分达到0/1(清除或几乎清除)。此外,单次HB0034治疗后第1周GPPASI评分较基线平均改善百分比为66.4%,第4周为78.7%,第12周为90.0%。同时,单次HB0034治疗后第1周脓疱BSA较基线平均改善百分比可达92.4%。
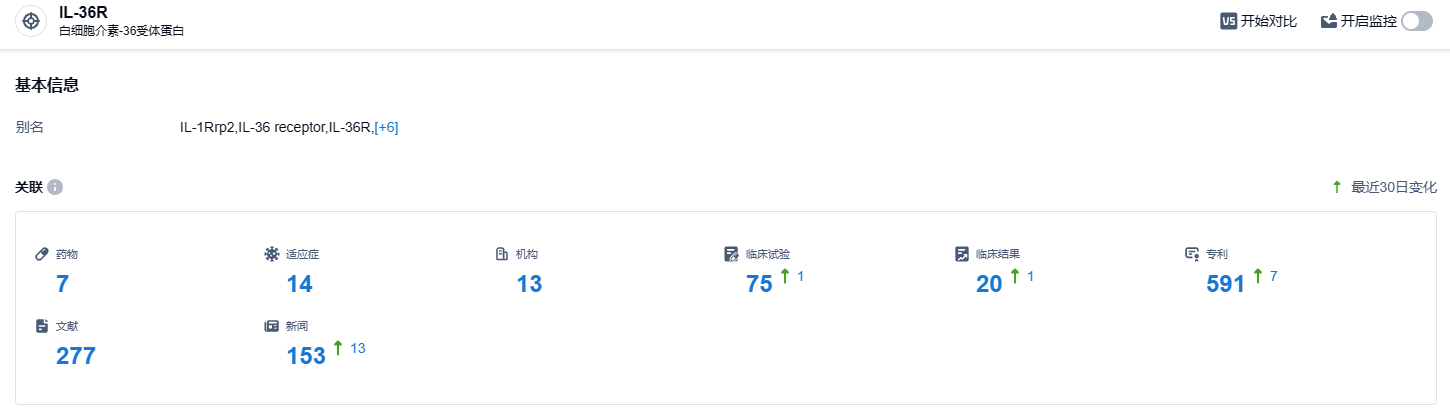
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 IL-36R 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月21日,IL-36R 靶点共有在研药物7个,包含的适应症有14种,在研机构13家,涉及相关的临床试验75件,专利多达591件……目前已获FDA孤儿药认定用于治疗泛发性脓疱型银屑病(GPP)的IL-36R单抗有Boehringer Ingelheim的Spesolimab和AnaptysBio的ANB019 (Imsidolimab),HB0034是全球第三个获此认定的靶向IL-36R药物。期待HB0034后续开发顺利。