预约演示
更新于:2025-05-07
albumin x CLDN18.2 x CD3
更新于:2025-05-07
关联
2
项与 albumin x CLDN18.2 x CD3 相关的药物作用机制 CD3刺激剂 [+2] |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床申请 |
首次获批国家/地区- |
首次获批日期1800-01-20 |
作用机制 CD3刺激剂 [+2] |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期1800-01-20 |
100 项与 albumin x CLDN18.2 x CD3 相关的临床结果
登录后查看更多信息
100 项与 albumin x CLDN18.2 x CD3 相关的转化医学
登录后查看更多信息
0 项与 albumin x CLDN18.2 x CD3 相关的专利(医药)
登录后查看更多信息
1
项与 albumin x CLDN18.2 x CD3 相关的文献(医药)Cancer Immunology, Immunotherapy
DR30318, a novel tri-specific T cell engager for Claudin 18.2 positive cancers immunotherapy
Article
作者: Liu, Yuanyuan ; Zhou, Zhenxing ; Ou, Fengting ; Zong, Sidou ; Sheng, Shimei ; Yu, Lushan ; Huang, Yanshan ; Duan, Wenwen ; Zhang, Xin ; Ma, Zhe ; Yao, Gaofeng ; Li, Changkui ; Dahar, Maha Raja
6
项与 albumin x CLDN18.2 x CD3 相关的新闻(医药)2025-01-02
·药时代
2025年1月2日,信达生物公告,宣布公司及其全资附属公司与罗氏达成全球独家合作与许可协议。信达将授予罗氏开发、生产及商业化IBI3009的全球独家权益。
据悉,IBI3009是一款靶向Delta样配体3(delta-like ligand 3, 后文简称为DLL3)的新一代ADC产品,目前已在澳大利亚、中国和美国获得IND批准,处于I期临床阶段,于2024年12月完成首例患者给药。
根据协议,信达生物将与罗氏共同负责该ADC的早期开发,后续临床试验则由罗氏负责。通过交易,信达将获得8000万美元首付款+最高10亿美元的里程碑付款+未来基于全球年度销售净额的最高达中双位数的梯度特许权使用费。
新年伊始即顺利BD,是个好兆头。
值得注意的是,这是一周内第二款出海的国产DLL3 ADC。就在2024年12月29日,恒瑞医药公告,宣布与一家成立近10年的美国Biotech——IDEAYA Biosciences公司达成协议,将具有自主知识产权的1类新药注射用SHR-4849项目有偿许可给IDEAYA Biosciences,获得7500万美元首付款+最高9.7亿美元的里程碑付款+实际年净销售额一到两位数百分比的销售提成。
详细信息显示,SHR-4849也是一款DLL3 ADC。
无论是赶在2024年末出海结了个好尾的恒瑞,还是新年开了个好头的信达,两家针对DLL3 ADC的交易总额均超过了10亿美元。这也让业内的注意力一下子聚焦到了“DLL3”上。
DLL3燃起来了!
DLL3赛道已有产品获批上市。
2024年5月16日,FDA加速批准安进的DLL3/CD3双抗Tarlatamab上市,用于治疗铂类化疗期间或之后疾病出现进展的广泛期小细胞肺癌(ES-SCLC),商品名Imdelltra。
图片来源:FDA官网
与非小细胞肺癌(NSCLC)相比,小细胞肺癌(SCLC)的癌细胞小且形状较为一致,且增值速度快。SCLC约占肺癌发病率的15%-20%左右,分为局限期(LS)和广泛期(ES)。LS指的是肿瘤病变局限在一侧胸腔或者在一个放射治疗野内,ES指的是病变超越了一侧胸腔,且包括心包积液、恶性胸腔或血行转移。由于SCLC恶性程度高,通常比NSCLC更具致命性和侵袭性,几乎所有的患者确诊时都有全身扩散的倾向。目前,化疗联合免疫治疗已成为ES-SCLC的标准治疗模式。
在Tarlatamab的II期DeLLphi-301研究中,99名既往两线或多线治疗失败且每两周接受10 mg Tarlatamab治疗患者的ORR为40%,mPFS为4.9个月,mOS为14.3个月。这项研究的最终和完整的生存数据尚未成熟,不过现有数据足以证明其在既往接受过治疗的SCLC患者中持久的抗肿瘤活性。基于这项研究数据,FDA提前PUDFA日期一个月加速批准这款产品上市。
根据安进的介绍, Tarlatamab可同时与肿瘤细胞上的DLL3和T细胞上的CD3结合,激活T细胞杀死表达DLL3的SCLC细胞。
图片来源:安进官网
此外安进指出,约85~96% 的SCLC患者癌细胞表面表达DLL3,高表达率已使DLL3成为SCLC领域备受关注的靶点。
Tarlatamab是全球首款靶向DLL3/CD3的双抗产品,也是DLL3赛道中唯一获批上市产品。通过其优异的临床数据,不难看出DLL3的确是个值得下注的靶点。
目前,全球范围内进入II期及以上临床阶段的DLL3产品几乎均为双抗/三抗产品。除已上市其中包括BI的BI 764532(DLL3/CD3双抗)、苏州泽璟制药的ZG-006(CD3/DLL3/DLL3三抗)、以及现由默沙东和第一三共 共同开发的MK-6070( CD3/albumin/DLL3三抗)和凡恩世的PT217(DLL3/CD47双抗)。值得注意的是,MK-6070并非默沙东自研产品,由默沙东2024年初6.8亿美元收购Harpoon Therapeutics所得,是Harpoon进展最快的管线之一。
DLL3 :艾伯维折戟,但后继者不断
DLL3被认为是肺癌潜力股并不是这一两年的事儿,艾伯维于2016年就认识到了DLL3的潜力。
2016年4月,艾伯维宣布以58亿美元的现金和股票交易+40亿美元里程碑付款的高价收购Stemcentrx,获得了Rovalpituzumab tesirine (Rova-T),一款靶向DLL3的ADC产品。当时的新闻稿中,艾伯维特别强调了其对Rova-T的期待,认为其有数十亿美元单品的潜力。并指出,在Rova-T的I/II期研究中对DLL3高表达SCLC患者实现了44%的ORR,数据积极,预计将于2018年实现商业化。
但该项目的后续进展确并未按艾伯维预期中的方向发展。2018年12月,艾伯维宣布停止了Rova-T III期TAHOE研究的患者招募,原因是:与拓扑替康对照组相比,Rova-T组的OS更短,独立数据监测委员会(IDMC)建议停止入组。且Rova-T的另一项II期临床试验同样表现不佳。
一系列试验失败和收效甚微的试验进展迫使艾伯维放弃了向FDA申请加速批准Rova-T用于复发或难治性SCLC三线治疗的计划。并于2019年3月宣布裁撤了178名(总共240名)Stemcentrx员工。消息披露后,业内一阵唏嘘,直呼艾伯维花出去的58亿打了水漂。
至此,DLL3 ADC第一位选手正式退赛。
艾伯维2016年的这次大手笔收购是DLL3受到关注的具体写照。从DLL3相关文献发表情况来看,自2016年起,业内对于DLL3的关注度的确日益增长。
图片来源:PUBMED
2024年相关文献发表数量更是再创新高。另从交易和临床试验情况来看,2024年的DLL3赛道也相当热闹。
除上文已经提及的默沙东收购Harpoon且与第一三共进一步达成合作,安进DLL3/CD3双抗获FDA加速批准上市外,还有(若有遗漏欢迎评论分享):
2024年1月,Orano Med与Molecular Partners就临床前管线MP0712(一款靶向DLL3的放射性疗法)达成授权合作。且年中时,两家公司披露了该管线的积极进展。
2024年4月,中国生物与BI建立战略合作伙伴关系,引入包括Brigimadlin,Zongertinib和BI 764532在内的多项早期资产。其中,BI 764532上文提到是一款处于II期临床阶段的CD3/DLL3双抗。
2024年7月,英诺湖医药与诗健生物达成新型连接子-载荷技术平台EZWi-Fit®的授权合作,共同开发ILB-3103,一款B7H3/DLL3双抗ADC。
2024年10月,再鼎医药公布ZL-1310(一款DLL3 ADC)I期数据,显示ZL-1310在ES-SCLC患者中达到了74%的ORR。
2024年10月,宜联生物与安进达成合作协议,双方将评估YL201(B7-H3 ADC)和Imdelltra(DLL3/CD3双抗)在SCLC的联合治疗潜力
目前,除上文已经提到的双抗、三抗、ADC及放射性疗法外,包括安进和传奇生物/诺华还押注了相应的CAR-T疗法。
如果您对DLL3 ADC产品感兴趣,欢迎联系药时代BD团队!我们的邮箱是BD@drugtimes.cn。
参考资料:
1.各公司官网
2.https://pubmed-ncbi-nlm-nih-gov.libproxy1.nus.edu.sg/
3.其他公开资料
封面图来源:自制
往期推荐
重磅!全球首款 CLDN18.2 单抗国内获批上市!
2025年,拥有优质二期临床数据的Biotech更能吸引投资?
药明康德出售CGT业务背后的“隐情”
版权声明/免责声明
本文为原创文章。
本文仅作信息交流之目的,不提供任何商用、医用、投资用建议。
文中图片、视频、字体、音乐等素材或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络,部分素材根据CC0协议使用,版权归拥有者,药时代尽力注明来源。
如有任何问题,请与我们联系。
衷心感谢!
药时代官方网站:www.drugtimes.cn
联系方式:
电话:13651980212
微信:27674131
邮箱:contact@drugtimes.cn
点击,查看更多精彩!
抗体药物偶联物免疫疗法临床申请引进/卖出加速审批
2024-12-03
关注并星标CPHI制药在线
2024年11月29日,南京维立志博生物科技股份有限公司 (以下简称“维立志博”)在港交所递交招股书,拟香港主板IPO上市。
维立志博成立于2012年,主要致力于肿瘤、自身免疫性疾病及其他重大疾病方面的研发需求。在持续了将近3年的资本寒冬下,IPO终止现象屡见不鲜,据公开数据显示,2023年IPO终止的企业数量达到39家,2024年现象持续恶化。如此背景下,维立志博无疑是一个可以参照的Biotech创新样本。我们从其管线出发,来看一看这家公司别样的生存之道。
01
聚焦高门槛靶点,持续输出FIC/BIC新药
维立志博从成立之初就将“解决中国乃至全球患者尚未满足的临床需求或临床空白”作为自身发展的使命,走在肿瘤免疫治疗的前沿,致力于开发使PD-1/PD-L1单抗或其他免疫疗法治疗无效的癌症患者重新获益的创新疗法,为患者带来全球领先的首创新药(First-In-Class,FIC)或同类最佳新药(Best-In-Class,BIC)。
目前,维立志博拥有12款创新候选药物的差异化管线,6款已进入临床阶段,其中4款临床进度全球领先:LBL-024、LBL-034、LBL-033、LBL-007。以LBL-024为例,我们来一窥维立志博精益求精的创新精神。
LBL-024是维立志博的核心产品,该创新药为一款PD-L1/4-1BB双抗。目前,LBL-024已进入肺外神经内分泌癌(EP-NEC)的单臂关键性临床试验,一旦获批成功,将成为全球首款靶向4-1BB的药物。
4-1BB(又称CD137),是一种在免疫系统多种细胞上表达的共刺激受体,包括活化的CD4+和CD8+T细胞、自然杀伤T细胞(NKT)和自然杀伤细胞(NKs)、树突状细胞(DC)以及Treg细胞等。
由于其表达广泛,而且4-1BB能够增加T细胞存活和细胞因子的产生,从而增强免疫效应,因此4-1BB已成为癌症免疫治疗的明星靶点。
在4-1BB的布局上,BMS等较早入场,但是并未如愿上市。BMS的urelumab(BMS-663513)是第一个进入临床试验的靶向4-1BB治疗药物,是一种IgG4单克隆抗体。然而,由于Ⅰ期和Ⅱ期临床数据均显示出较高的肝脏毒性而使研发进展缓慢。
肝毒性也是其他靶向4-1BB的单抗药物进展缓慢的原因。为了克服这一挑战,LBL-024采用了维立志博的独创X-body平台,进行了独特设计。维立志博将LBL-024的结构调整为2:2,这样既能与肿瘤相关抗原PD-L1特异性地结合,将对4-1BB的共刺激定位在肿瘤环境内;还能降低对4-1BB的亲和力,大大减少了LBL-024与体内其他部位4-1BB的相互作用,从而降低了器官系统毒性的风险。
在单药治疗晚期肿瘤的Ⅰ/Ⅱ临床研究中,LBL-024耐受性良好,安全性可控,与当前已批准免疫治疗方案比较,未见新的安全性信号。截至目前的临床数据与现有治疗相比,LBL-024单药治疗晚期肺外神经内分泌癌(EP-NEC)的客观缓解率(ORR)、总生存期(OS)均提高了2倍以上。LBL-024于2024年10月9日获CDE突破性治疗药物认定。
在针对4-1BB药物开发领域,目前布局企业研发的产品有单抗,双抗以及多抗。鉴于MNC在4-1BB单抗临床开发和研究过程中已经观察到,单抗的疗效和安全性数据表现难以令人满意,目前入局的国内药企已将火力转向双抗或多抗领域。如天境生物与韩国ABL Bio合作开发的Claudin 18.2 &/4-1BB 双抗TJ-CD4B、基石药业靶向PD-L1/4-1BB/HSA的三抗产品CS2006、百利药业的四抗——GNC-038(PD-L1/4-1BB/CD3/CD19,用于血液瘤)、GNC-039(PD-L1/4-1BB/CD3/EGFRvⅢ,实体瘤)、GNC-035(PD-L1/4-1BB/CD3/CD19/ROR)目前都已进入临床。
全球目前还有多款4-1BB药物进入临床研究阶段,尽管对4-1BB的探索由来已久,但受安全性制约,全球尚无一款4-1BB靶向药物获批上市。LBL-024是最早敲开监管大门的4-1BB双抗药物,如若获批上市,将在巨大的4-1BB市场占据重要地位。
维立志博的第二款核心产品LBL-034,是一款靶向GPRC5D/CD3的TCE,基于维立志博独有的LeadsBody平台开发而成,其采用2:1非对称结构,拥有2个靶向GPRC5D的高亲和力Fab以及1个靶向CD3的低亲和力scFc。临床前研究表明,LBL-034在多种细胞增殖抑制试验中和体内药效模型中表现出优于已获批GPRC5D/CD3双抗Talquetamab的疗效。2024年10月,LBL-034获FDA孤儿药资格认定,用于治疗多发性骨髓瘤(MM)成人患者。目前,LBL-034是全球临床进度第二的GPRC5D/CD3双抗。
维立志博的第三款核心产品LBL-033,是目前全球仅有的两款已进入临床阶段的MUC16/CD3 TCE之一。MUC16(粘蛋白16)是一种高度糖基化的跨膜蛋白,在卵巢癌等多种恶性肿瘤细胞表面高度表达,并与生长因子相互作用,诱导肿瘤的发生和发展。LBL-033双抗同时靶向表达MUC16的肿瘤细胞和表达CD3的T细胞,介导T细胞对MUC16阳性肿瘤细胞的特异性杀伤,从而起到抗肿瘤作用。在结构设计上,公司对靶向MUC16的结合表位以及靶向CD3的亲和力等多个方面做了大量的优化,以期达到安全性和有效性的平衡。在临床前模型中,LBL-033表现出较强的抗肿瘤作用。
维立志博的第四款核心产品LBL-007 ,是一款靶向LAG-3的全人源IgG4单克隆抗体。其设计为LAG-3的独特表位,能以高亲和力与LAG-3结合,并阻断LAG-3与所有已识别免疫抑制配体结合,增强免疫应答。
在临床研究中,LBL-007结合PD-1抑制剂的联合疗法在各种肿瘤类型中均表现出良好的协同抗肿瘤效果及良好的安全性。2021年,百济神州以7.72亿美元引进LBL-007,目前该药在全球处于临床阶段的LAG3 靶向单克隆抗体中临床进度位居前三。
可以看出,维立志博一直在致力于具有极大潜力的高门槛靶点的研发。另外在11月7日,维立志博宣布,与Aditum Bio成立研发公司Oblenio Bio,并将CD3/CD19/BCMA三抗授权给Olenio Bio。通过此次运作,维立志博将收获3500万美元预付款和近期里程碑金额,以及5.79亿美元的开发、监管、销售里程碑金额。维立志博在专注于研发的同时,也在通过BD合作更好地反哺研发。
02
真创新,是维立志博的底气
除了TCE管线和多抗管线之外,维立志博还搭建了ADC技术平台。在招股书中,公司公开了两款处于IND准备阶段的ADC,分别为靶向PSMA的LBL-013和靶向FGFR2b的LBL-052。这两款药物系2023年4月,维立志博与百凯医药签订合作开发协议,共同开发而来,LBL-013主要针对前列腺癌,LBL-052的开发方向为乳腺癌及胃癌。
致力于开发FIC、BIC的真创新,是维立志博在寒冬下前行的底气。公司始终坚持创新研发和产品差异化,这也是国内生物医药企业深化发展的策略和方向。
当下,经济下行周期中投资者由于对风险的厌恶,造成了对创新药的避而不投。然而潮起潮落终有时,当投资者信心恢复,只有少数具有“真创新”能力的创新药企能够穿越市场周期,迎来新的发展阶段。
参考文献:
1.https://www1.hkexnews.hk/app/sehk/2024/106941/documents/sehk24112901736_c.pdf.
2.www.leadsbiolabs.com.
3.Sharma P, Siddiqui B A, Anandhan S, et al.The Next Decade of Immune Checkpoint Therapy[J].Cancer Discov,2021, 11 (4): 838-85.
END
【智药研习社近期直播预告】
来源:CPHI制药在线
声明:本文仅代表作者观点,并不代表制药在线立场。本网站内容仅出于传递更多信息之目的。如需转载,请务必注明文章来源和作者。
投稿邮箱:Kelly.Xiao@imsinoexpo.com
▼更多制药资讯,请关注CPHI制药在线▼
点击阅读原文,进入智药研习社~
免疫疗法IPO临床2期
2024-11-08
摘要:双特异性抗体(bsAbs)能够实现传统基于IgG的抗体无法达到的新型作用机制和/或治疗应用。因此,这些分子在过去十年中引起了极大的兴趣,并且截至2023年底,已有14种bsAbs获得批准:11种用于治疗癌症,3种用于非肿瘤学指征。bsAbs有不同格式,针对不同的目标,并通过不同的分子机制介导抗癌功能。在这里,我们提供了bsAbs在癌症治疗领域最新进展的概述。我们专注于已批准或处于临床开发中的bsAbs,包括bsAb介导的信号通路双重调节剂、肿瘤靶向受体激动剂、bsAb-药物偶联物、双特异性T细胞、自然杀伤细胞和先天免疫细胞的招募者,以及双特异性检查点抑制剂和共刺激因子。最后,我们对处于更早开发阶段的下一代bsAbs进行了展望,包括三特异性抗体、bsAb前药、诱导肿瘤目标降解的bsAbs以及作为细胞因子模拟物的bsAbs。
引言
bsAbs用于双重受体抑制 bsAbs用于配体-受体抑制 bsAbs用于受体激活 bsAbs用于靶向载荷递送 bsAbs用于癌症免疫治疗、 新兴概念 、展望,双特异性抗体通过新生儿Fc受体(FcRn)循环利用。Fc部分的突变可以改变与FcRn的结合,从而改变抗体的半衰期。在不包含Fc部分的bsAbs中,可以通过其他方式实现类似IgG的药代动力学,例如结合到人血清白蛋白(HSA)或其他可以延长半衰期的分子。目前有超过几百种不同类型的bsAb格式,其中多种格式在已批准和处于临床开发中的分子中使用。目前,大多数已批准的bsAbs和处于药物开发高级阶段的分子主要用于癌症免疫治疗。其他针对新型药物递送的实体也在开发中,例如基于bsAb的抗体-药物偶联物(bsADCs)或双重靶向与癌症相关的信号通路(图1)。我们最近在ClinicalTrials.gov、Cortellis和The Antibody Society的数据搜索显示,有超过200种不同的双特异性分子的300多项临床试验正在进行中,其中约75%用于治疗实体瘤,25%用于治疗血液恶性肿瘤(图1)。目前有十种bsAb药物已获批准用于癌症治疗,其中九种在美国和/或欧洲获批准,卡多尼利单抗在中国获批准。在这十种bsAbs中,有九种可以归类为TCEs。卡塔莫单抗是首个获批准的bsAb,于2013年退出市场(表1和图2)。值得注意的是,今天在临床开发中的相当一部分bsAbs已经处于后期阶段(第二阶段和第三阶段)。我们发现,用于治疗实体瘤的bsAbs主要由免疫调节剂主导,包括双重CPIs(约45%)和TCEs(约33%),其次是针对双重通路的bsAbs、ICEs和双重ADCs。相比之下,TCEs是用于治疗血液恶性肿瘤的主要bsAbs类别(约75%),其次是ICEs、双重CPIs和NKCEs(图3)。我们数据集中的bsAbs针对60多个不同的目标,使用超过50种不同的bsAb格式,涉及100多种目标组合。然而,我们承认,该领域的增长速度很快,新的bsAbs,可能具有新的目标和格式,已经进入临床试验,自我们分析以来。尽管如此,本综述旨在提供一份基于MoA的全面概述,介绍作为癌症治疗开发的bsAbs的最新进展,重点关注截至2023年底在同行评审出版物中描述的bsAbs。
双受体抑制的bsAbs
许多参与细胞信号传导的细胞表面蛋白,如RTKs及其相关受体,是抗体基疗法的验证目标。几十年前,对这些蛋白的研究,包括历史上的先行者表皮生长因子受体(EGFR;也称为HER1)、HER2、血管内皮生长因子(VEGF)和针对它们的抗体,为几乎所有后续的抗体基治疗发展奠定了基础。尽管结合一个定义的信号实体的抗体基疗法相当有效,但与疾病相关的表现型通常由多个通路触发。这种冗余允许细胞通过使用其他补偿性信号通路来克服单一目标或通路的药理学生长抑制或诱导细胞毒性。同时调节不同的与疾病相关的信号受体和/或通路的bsAbs可以减少或克服这种限制。Amivantamab(JNJ-61186372)靶向EGFR和肝细胞生长因子受体(MET)。两种受体都会触发非小细胞肺癌(NSCLC)的增殖,因此,阻断两者可以比仅阻断一个通路更有效地抑制NSCLC的生长。Amivantamab已获批准用于治疗携带EGFR外显子20插入突变的NSCLC亚型。
图1 | 用于癌症治疗的双特异性抗体在临床开发中。目前有200多种双特异性抗体(bsAbs)正在进行临床开发,根据癌症类型、临床阶段和作用模式进行分组。正在进行临床开发的bsAbs中有50%处于II期和III期或已经获批。大约四分之三的bsAbs被开发用于治疗实体瘤,实体瘤治疗主要由T细胞招募剂(TCEs;32.9%)和具有检查点抑制和/或免疫调节作用机制(MoAs)的bsAbs(45.1%)所主导。相比之下,血液系统恶性肿瘤的治疗主要由TCEs(75%)和其他MoAs(21.9%)所主导,这些MoAs涉及免疫学活动,如通过检查点抑制和/或免疫调节激活自然杀伤细胞和其他免疫细胞,这归功于高度肿瘤选择性或谱系特异性抗原的可用性。值得注意的是,约有10%用于实体瘤治疗的bsAbs采用双重信号抑制。迄今为止,正在开发的bsAb抗体-药物偶联物(ADCs)用于治疗实体瘤。CPI,检查点抑制剂;ICE,先天细胞招募剂;NKCE,自然杀伤细胞招募剂。
双特异性抗体用于配体-受体抑制
受体激活可以通过干扰受体二聚体化或复合物形成,或通过阻断受体的配体结合位点来抑制。在癌症中,通常来自几个互补或补偿通路的配体和受体有助于肿瘤进展和治疗抗性。bsAbs可以同时阻断两种不同的配体,无论是可溶的还是细胞膜结合的,或者是配体和受体的组合。这种方法不仅用bsAbs来解决,也用双特异性或双位点基于支架的结合剂来解决,这里我们不包括。双重靶向VEGF和血管素2(ANG2)以阻断分别参与血管生成的VEGFR和血管素-1受体(TIE2)的激活,已成为包括微转移的血管生成转换在内的实体瘤中几项临床试验的主题。BI836880是一种三特异性纳米抗体(Nb)融合蛋白,由三个靶向VEGFA、ANG2和HSA的纳米抗体组成,后者用于延长其血清半衰期。这种化合物目前正在对头颈鳞状细胞癌、NSCLC和其他实体瘤患者进行I期研究。值得注意的是,vanucizumab,一种靶向VEGFA和ANG2的bsAb,在与化疗联合使用的临床前模型中显示出抗肿瘤、抗血管生成和抗转移效应,但在与化疗联合使用时,并未在结直肠癌患者中提高无进展生存期,超过VEGF抑制。将VEGF抑制与另一种拮抗活性相结合的概念进一步应用于靶向VEGF和Delta样规范Notch配体4(DLL4)的bsAbs。DLL4是一种细胞表面配体,激活Notch-1受体通路,该通路在肿瘤血管生成中起着核心作用。几种靶向VEGF和DLL4的双特异性抗体已经进入临床试验,包括navicixizumab、dilpacimab和CTX009/ABL001。Navicixizumab是一种四价双特异性抗体,具有四个结合位点,其中两个基于单链可变片段(scFv)融合,它在与紫杉醇联合使用时在铂类耐药卵巢癌患者中展示了有希望的临床活性,并具有可管理的毒性,表明这种方法可能在某些适应症中提供临床益处。相比之下,另一项针对四价双特异性抗体dilpacimab的II期研究,与亚叶酸、氟尿嘧啶和伊立替康(FOLFIRI)联合使用,揭示了安全问题。
表1 | 批准用于癌症治疗的双特异性抗体
ADCC,抗体依赖性细胞毒性;ALL,急性淋巴细胞性白血病;BCMA,B细胞成熟抗原;BiTE,双特异性T细胞招募剂;bsAb,双特异性抗体;DLBCL,弥漫性大B细胞淋巴瘤;EGFR,表皮生长因子受体;EpCAM,上皮细胞粘附分子;GPRC5D,G蛋白偶联受体C类5成员D;MoA,作用机制;NSCLC,非小细胞肺癌;NHL,非霍奇金淋巴瘤;scFv,单链可变片段;TCR,T细胞受体;TDCC,T细胞依赖性细胞毒性。批准区域限于美国、欧洲联盟(EU)、日本和中国;产品也可能在其他国家获得批准。状态截至2023年底。
靶向VEGF和PDL1或PD1的双特异性抗体
基于VEGF抗体和免疫检查点抑制剂(CPI)联合治疗的积极结果,上述概念进一步适应于设计靶向VEGF和肿瘤细胞上的PDL1或T细胞上的PD1的双特异性抗体,从而将抗血管生成与免疫肿瘤学方法相结合。使用这种方法最先进的分子是ivonescimab(AK112),它针对PD1和VEGF。目前,ivonescimab的上市申请正在中国接受监管审查。其他双特异性抗体靶向PDL1和VEGF,包括PM8002,目前正在进行II/III期研究(NCT05756972),针对NSCLC患者。
受体激活的双特异性抗体
许多抗肿瘤反应是通过激活细胞表面受体介导的,包括免疫反应或通过诱导凋亡的细胞死亡。癌症治疗的一种方法是通过将受体激活配体(如生长因子、细胞因子和(共)免疫刺激配体)融合到抗体或抗体片段上,实现受体激活配体的靶向递送,以诱导局部或组织特异性的激动活性,从而引发细胞反应。越来越多的这些抗体-配体融合蛋白正在进入临床试验。受体激活也可以通过激动性抗体来实现。肿瘤坏死因子(TNF)超家族的成员,包括死亡配体(如TNF配体超家族成员10(TNFSF10);也称为TRAIL)及其各自的死亡受体(如TRAIL受体1和2;也称为DR4和DR5),或具有免疫细胞共刺激活性的配体(如TNFSF9;也称为4-1BBL)及其受体(如TNFRSF9;也称为4-1BB或CD137)在癌症治疗中引起了特别关注。然而,单克隆抗体在临床试验中取得了相当令人失望的结果。原因是许多TNFRSFs需要超过两个受体的交联以激活,这只能通过Fc-FcγR介导的抗体在细胞表面的超聚集来实现,因此依赖于TME中表达足够数量FcγR的先天免疫细胞。作为替代方案,针对目标抗原和TNFRSF成员的双特异性抗体已被证明可以作为强大且肿瘤选择性的激动分子,模仿表面展示配体的活性。这尤其适用于DR4和DR5,DR5需要多个受体的聚集才能激活。值得注意的是,针对DR5和表面抗原的双特异性抗体,如成纤维细胞激活蛋白-α(FAPα;也称为脯氨酸内肽酶FAP)、钙粘蛋白17(CDH17)或叶酸受体-α(FRα),不仅有效地诱导受体激活,还避免了通过诱饵受体的隔离50。RG7386(RO6874813),一种针对癌症相关成纤维细胞上的FAPα和DR5的四价双特异性抗体,在体外和体内在表达FAPα的基质的小鼠中触发了强效且选择性的肿瘤细胞杀伤,并已进入临床测试,但由于战略投资组合优先级而随后中止。此外,BI905711,一种针对DR5和CDH17的四价双特异性IgG-scFv融合蛋白,目前正在进行I期临床研究,显示出在CDH17阳性目标细胞上的效力比单克隆抗体提高了1000倍以上,转化为在结直肠癌模型中的强效且选择性的抗肿瘤活性。相同的格式用于针对DR5和FOLR1的双特异性抗体,FOLR1是一种富集于卵巢癌的受体,已被证明介导顺式(在同一细胞上)和反式(在两个不同细胞上)的细胞毒性,其中FOLR1作为有效DR5激活的聚集点。从概念上讲,这种MoA也可以转移到依赖于受体聚集的TNFRSF家族的共刺激成员,包括4-1BB、OX40和CD40(见图3),使用针对肿瘤相关抗原(TAAs)的双特异性抗体,但也针对其他目标,如PDL1,从而将共刺激与检查点抑制相结合(见下文)。
用于靶向载荷递送的双特异性抗体
存在两种概念上不同的方法,用于使用双特异性抗体进行有效载荷(如细胞毒素或放射性)的靶向递送。第一种方法,预靶向治疗,使用双特异性抗体的一个结合特异性来靶向肿瘤细胞,另一个结合特异性随后捕获肿瘤上的载荷。这类双特异性抗体结合到肿瘤上的癌症靶标,如癌胚抗原(CEACAM5)或HER2,然后捕获由双特异性抗体的第二个结合特异性识别的放射性标记载荷/复合物。
图2 | 已批准用于癌症治疗的双特异性抗体概览。a, 双特异性T细胞招募剂(TCEs)。b, 其他双特异性抗体(bsAbs)(非T细胞招募剂(非TCEs))。11种已批准的bsAbs中有6种具有IgG样结构,由2条重链(恒定区域以深灰色显示,Vh结构域以深蓝色或深红色显示)和2条轻链(恒定结构域以浅灰色显示,Vl结构域以浅蓝色或浅红色显示)组成。它们大多数具有1+1的化学计量比 —— 每个抗原一个结合位点 —— 还有一个TCE通过将一个额外的Fab片段融合到一条重链上,利用2+1的化学计量比。其他的bsAbs要么是不含Fc的融合蛋白,由两个单链可变片段(scFv)片段组成(blinatumomab),要么是将scFv片段与T细胞受体(TCR)片段融合,或者是具有2+2化学计量比的IgG-scFv融合蛋白。除了由小鼠和大鼠杂交瘤细胞技术生产的catumaxomab外,所有其他的bsAbs都是通过重组技术生产的。对于IgG样异二聚体分子,通过在CH3域使用突变来强制异二聚体化 —— 如旋钮-入洞技术 —— 或控制的Fab臂交换(cFAE),解决了两种不同重链的正确组装问题,cFAE还允许从两种不同的单特异性IgG组装IgG样分子。cFAE还解决了轻链问题,即轻链和重链的配对。或者,如CrossMab方法所示,对Fab臂进行进一步的修改,以强制正确的轻链和重链配对。值得注意的是,所有重组IgG样bsAbs都包含一个具有沉默或减少效应功能的Fc区域,这是通过在铰链/CH2域引入突变来避免或减少Fcγ受体和补体结合来实现的。BCMA,B细胞成熟抗原;EGFR,表皮生长因子受体;EpCAM,上皮细胞粘附分子;GPRC5D,G蛋白偶联受体C类5成员D。
最近,被称为SADA的双特异性抗体利用改良的p53四聚体化域来延长GD2×DOTA在肿瘤中的滞留时间。GD2×DOTA是一种双特异性抗体,能够识别在癌症中高表达的二唾液酸神经节苷脂GD2,以及放射性载荷177Lu-DOTA,在肿瘤微环境中组装并滞留在那里,但没有四聚体化,它会迅速从周围清除,因为它缺乏半衰期延长。到目前为止,很少有临床试验中的双特异性抗体使用这种MoA,可能是由于与预靶向放射性相关的复杂物流限制了其普遍适用性。
图3 | 目前正在临床试验中的双特异性抗体的作用机制。a, 通过受体阻断两种不同的信号受体(以不同颜色表示)来抑制信号传导。b, 通过抑制可溶性配体(蓝色)和受体来抑制信号。c, 通过双重阻断两种不同的配体来抑制信号。d, 通过双特异性抗体(bsAb)药物偶联物(偶联物以浅蓝色表示)进行药物传递。e, 针对性阻断“别吃我信号”(CD47–SIRPα相互作用),导致巨噬细胞的吞噬作用。f, 结合检查点抑制,阻断“别吃我信号”。g, 通过T细胞受体(TCR)上的CD3或自然杀伤细胞上的CD16(FcγRIIIa)激活效应细胞。h, 肿瘤细胞结合介导的免疫细胞(共)刺激。i, PDL1结合介导的免疫细胞(共)刺激。j, 双重免疫细胞共刺激。k, 肿瘤靶向PDL1途径抑制。l, 肿瘤靶向PD1途径抑制。m, 检查点结合介导的免疫细胞(共)刺激。n, 双重检查点抑制。o, 通过配体阻断实现双重检查点和可溶性转化生长因子-β(TGFβ)信号的抑制。展示了用于实体瘤和血液系统恶性肿瘤的目标分子和肿瘤相关抗原(TAAs)的例子。注意:bsAbs可以同时发挥多种作用机制(MoAs)。Ang2,血管生成素2;APC,抗原呈递细胞;BCMA,B细胞成熟抗原;CDH17,钙粘蛋白17;DLL4,典型Notch配体4;EGFR,表皮生长因子受体;EpCAM,上皮细胞粘附分子;FRα,叶酸受体α;GPRC5D,G蛋白偶联受体C类5成员D;HLA,人类白细胞抗原;ICOS,诱导性T细胞共刺激因子;LAG3,淋巴细胞相关基因3;TIGIT,具有免疫球蛋白和ITIM结构域的T细胞免疫受体;VEGF,血管内皮生长因子。
双特异性抗体药物偶联物
第二种方法通过同时靶向肿瘤细胞表面的两个表位或两个目标,实现了通过双特异性抗体药物偶联物(bsADCs)传递细胞毒素载荷的特异性靶向。处于临床开发中的bsADCs的例子包括zanidatamab zovodotin(ZW49),这是一种双特异性HER2结合抗体zanidatamab与auristatin衍生的细胞毒素载荷偶联,双特异性MET×MET bsADC REGN5093或izalontaxab brengitecan(BL-B01D1),一种EGFR×HER3 bsAb与一种新型TOPO-I抑制剂偶联(NCT05194982)(表2)。
双特异性抗体用于癌症免疫治疗
大多数用于癌症免疫治疗的双特异性抗体通过T细胞驱动的自然或内源性免疫发挥作用,例如通过增强现有的抗肿瘤反应和/或克服检查点抑制,或通过提供合成免疫,例如通过bsAb驱动的免疫细胞的参与、激活和招募(图3)。在这一部分中,我们提供了包括CPIs、效应细胞招募剂(包括TCEs和ICEs)和共刺激双特异性抗体在内的最突出的MoAs的概述。
双重CPIs
许多干扰免疫检查点(如CTLA4或PD1/PDL1)的单特异性抗体已获批准用于癌症免疫治疗,包括ipilimumab、tremelimumab、nivolumab、pembrolizumab、atezolizumab、avelumab、durvalumab或cemiplimab。将免疫检查点抑制抗体治疗扩展到包括双特异性抗体可能会减少不良副作用并提高观察到的单特异性抗体治疗的疗效。第一个方面,检查点抑制的安全性,包括预防自身免疫相关事件和/或不希望的免疫细胞激活。为了实现这一目标,正在开发针对检查点抑制功能和TAAs(如RTKs)的双特异性抗体,目的是将其活动更优先地集中在肿瘤上,正在开发中。第二个方面,检查点免疫治疗的疗效,通过双特异性抗体同时靶向两种不同的检查点蛋白来提高疗效并降低抗性的可能性,或提供互补的免疫刺激信号。值得注意的是,这些双特异性抗体的共同设计原则是提高对表达两种检查点蛋白的T细胞的选择性,如CTLA4/PD1或PD1/淋巴细胞相关基因3(LAG3),这些蛋白可能更具肿瘤反应性,目标是提供比单独检查点阻断更优越的治疗指数。
表2 | 晚期临床开发中选择的双特异性抗体概览
BiTE,双特异性T细胞招募剂;BCMA,B细胞成熟抗原;bsAb,双特异性抗体;BTC,胆管癌;cL,普通轻链;DART,双亲和重定向;DLL4,类似Delta的典型Notch配体4;EGFR,表皮生长因子受体;EpCAM,上皮细胞粘附分子;Fchet,异二聚体化Fc;LAG3,淋巴细胞相关基因3;Nb,纳米抗体;NHL,非霍奇金淋巴瘤;NSCLC,非小细胞肺癌;PDC,胰腺导管腺癌;scFv,单链可变片段;TIGIT,具有免疫球蛋白和ITIM结构域的T细胞免疫受体;TGFβ,转化生长因子β;VEGF,血管内皮生长因子。a晚期包括关键性II期、II/III期和III期临床研究。
例如,通过降低自身免疫不良事件的发生率 —— 而不是与联合检查点阻断相比。探索肿瘤靶向检查点抑制的工作包括开发双特异性抗体,这些抗体靶向肿瘤细胞表面的HER家族RTKs,并结合PD1/PDL1信号通路的阻断作为第二功能,从而将PDL1结合剂定向到肿瘤细胞。这些分子的特定肿瘤靶向导致了对表达EGFR的肿瘤细胞更具特异性和增强的活性。类似地,一种特别结合HER2和PDL1的双特异性抗体被证明可以在HER2表达的肿瘤细胞中特异性阻断PDL1活性,从而比单独使用每个实体或在不作为双特异性抗体结合时联合应用产生更大的治疗效果。
另一种双特异性抗体介导的靶向免疫治疗方法包括将PDL1阻断与识别黑色素瘤上的软骨素硫酸蛋白聚糖4(CSPG4)的结合物相结合。特定的肿瘤靶向增强了抗肿瘤T细胞的特异性、激活状态和疗效。概念上相关的方法包括将PDL1结合物与黑色素细胞刺激激素化学偶联。通过这种方式,PDL1抑制活性被定向到黑色素瘤细胞上的黑色素皮质素-1受体。同时靶向两个检查点蛋白而不额外包括常见的肿瘤细胞表面靶标的双特异性抗体的例子包括同时结合肿瘤细胞上的PD1和PDL1的双特异性抗体。Wan等人分析了这种双特异性抗体在高级别浆液性卵巢癌类器官与免疫细胞共培养中引发的联合活性。与单特异性结合物相比,双特异性抗体介导了优越的疗效,并在T细胞和自然杀伤细胞中诱导了表型变化,包括激活状态和细胞毒性的改变。双特异性抗体LY3434172也采用了这种方法。通过完全抑制PD1/PDL1途径,LY3434172显示出比每个亲本抗体或两者组合更大的抗肿瘤活性,再次证明以双特异性抗体形式的结合很重要,并且可以增加疗效。超越PD1/PDL1方法的界限,包括CTLA4在内的其他免疫受体的双特异性抗体正在开发或已获批准。同时靶向PD1和CTLA4是双特异性抗体cadonilimab的作用机制。Cadonilimab由于四价性,介导了对高密度PD1和CTLA4的增加亲和力驱动的目标结合,这与Fc突变以废除FcγR结合相结合,可能是其有利的治疗指数的基础。值得注意的是,cadonilimab还在PD1+和CTLA4+ T细胞之间介导了跨结合。在晚期实体瘤患者的I/Ib期研究中,cadonilimab显示出抗肿瘤活性和有利的安全性概况,免疫相关不良事件的发生率低。Cadonilimab已在中国获批准用于治疗在铂类化疗后或化疗期间进展的复发或转移性宫颈癌。其他在高级临床试验中结合相同特异性的双特异性抗体是MGD019和MEDI5752。MGD019结合了PD1和CTLA4结合物,在进行中的临床研究中观察到可接受的安全性和组合阻断以及在多种实体瘤中的客观反应。MEDI5752目前正在进行临床评估,它结合了PD1和CTLA4,并显示了PD1介导的靶向,因为它优先饱和了PD1+ T细胞上的CTLA4,并引起了PD1的快速内化和降解。与cadonilimab相比,MGD019和MEDI5752似乎对双阳性T细胞显示出更强的亲和力驱动的选择性增益。双重失活也在探索中,通过结合PD1/PDL1阻断与LAG3或TIM3抑制。例子是IBI323和FS118,它们都结合了PDL1和LAG3,并在临床前模型中显示出增强的双重功效。LY3415244结合了PDL1和TIM3的阻断,作为一种不同的免疫调节剂,但由于在I期研究中观察到的免疫原性,该分子的开发被终止。最近,I期剂量递增和扩展数据的临床试验显示,PD1×LAG3双特异性抗体tebotelimab在实体瘤或血液系统恶性肿瘤患者中作为单药治疗以及与HER2抗体margetuximab联合治疗时显示出有希望的活性。双配体抑制是另一种基于双特异性抗体的检查点抑制方法。PDL1和转化生长因子-β(TGFβ)是具有互补且非冗余免疫抑制活性的受体结合配体。TGFβ不仅具有免疫抑制作用,还可以进一步诱导促血管生成因子的上调和癌症相关成纤维细胞的激活。目前正在开发几种靶向PDL1和TGFβ的双特异性抗体,如类似双特异性抗体融合蛋白的bintrafusp alfa(M7824)。在这种情况下,PDL1的结合是通过一个“标准”的抗体结合模块实现的,而TGFβ则被人类TGFβ受体II的细胞外域捕获。Bintrafusp alfa在临床前研究中显示了激活先天和适应性免疫系统,从而比单独使用抗PDL1抗体或TGFβ陷阱模块更好地抑制肿瘤生长和转移,目前正在进行临床试验。Retlirafusp alfa(SHR-1701),另一种以类似方式靶向PDL1和TGFβ的双功能融合分子,正在对宫颈癌和胃癌或胃食管结合部癌症患者进行III期研究(表2)。YM101是一种TGFβ×PDL1双特异性抗体,目前处于临床前开发阶段。YM101的一个替代品,Y101D,正在对晚期实体瘤患者进行评估(NCT05028556)。所有同时对抗抑制性TGFβ和PD1/PDL1途径的方法在体内模型中显示出比单独使用各自结合物更高的抗肿瘤活性,但迄今为止尚未在临床上证明概念。针对性的TGFβ信号阻断也已经在临床前研究中通过阻断CD4+ T细胞中的TGFβ信号的双特异性抗体实现。为此,将非免疫抑制性的CD4靶向抗体ibalizumab与TGFβ陷阱以类似于上述的双特异性抗体方式结合。这导致在辅助T细胞中针对性阻断TGFβ信号,可以释放抗肿瘤反应。通过双特异性抗体招募磷酸酶抑制PD1是一种最近报道的新型MoA88。这是通过一个单域(Vhh)融合到一个scFv实现的,将PD1连接到细胞表面磷酸酶CD45,这反过来触发细胞内去磷酸化。这种方法与单独使用PD1抗体介导的配体阻断相比,增强了检查点阻断的抑制。按照同一原则,双特异性抗体可以将细胞表面磷酸酶CD45与抑制性自然杀伤细胞表面受体NKG2A或Ly49连接,以进行后续去磷酸化。这样的双特异性抗体可以阻断并同时去磷酸化它们的目标,可能比相应的单特异性抗体及其抑制信号的组合更有效的拮抗剂,以增强自然杀伤细胞和T细胞的抗肿瘤活性。使用双特异性抗体对CD73的不同表位进行双位点靶向是另一种双特异性抗体相关方法,以抵消免疫抑制活性或增强针对肿瘤的免疫能力。CD73产生免疫抑制性腺苷,其通过内化的双特异性抗体介导的抑制和耗尽比单一位点CD73抗体更有效。
效应细胞招募剂 T细胞招募剂
在过去二十年中,专门结合肿瘤表面抗原和TCR的CD3ε链的T细胞招募剂(TCEs)在这一类双特异性抗体中占据主导地位,描述了数百种TCEs,并且有100多种进入临床开发。事实上,第一个获准上市的双特异性抗体是鼠/大鼠嵌合的上皮细胞粘附分子(EpCAM)×CD3ε双特异性抗体catumaxomab,它在2009年被欧洲联盟(EU)批准用于恶性卵巢腹水的腹腔内治疗,但后来因商业原因退出市场。目前正在中国再次进行临床试验,用于腹腔内给药。系统应用的catumaxomab显示出严重的输注反应和高免疫原性发生率,可能由于其鼠/大鼠嵌合的恒定区域和保留的FcγR结合,导致在没有抗原结合的情况下非特异性FcγR和TCR激活。随后,下一代TCEs被设计为缺乏Fc部分,如基于串联scFv的CD19×CD3ε双特异性T细胞招募剂(BiTE)blinatumomab,它在2014年首次被批准用于治疗B细胞前体急性淋巴细胞性白血病(B-ALL)。然而,由于缺乏通过FcRn的循环,这种疗法需要持续输注,FcRn通过从分拣内体循环到细胞表面,从内溶酶体降解中挽救IgG。基于blinatumomab的成功,针对血液和实体瘤的各种目标的BiTEs被开发出来,但最终没有进入晚期临床试验,由于BiTEs和相关短半衰期的药代动力学特性不佳。人们尝试通过纳入FcγR结合惰性Fc结构域(沉默Fc)或HSA结合部分来实现bsAbs的IgG样半衰期,目前大多数处于开发中的TCEs是基于IgG和/或具有IgG样药代动力学的。值得注意的是,大多数TCEs使用单个单价结合位点用于CD3作为T细胞上的触发分子,以避免在没有同时目标结合的情况下TCR交联引起的系统性T细胞激活。然后它们使用一个(1+1)或两个(2+1)肿瘤目标的结合位点,因为双价结合可以在肿瘤选择性和效力方面提供优势。CD20×CD3ε双特异性抗体mosunetuzumab106和B细胞成熟抗原(BCMA)×CD3ε双特异性抗体teclistamab是第一批异二聚体1+1 IgG基TCEs,分别在2022年被批准用于治疗复发/难治性滤泡性非霍奇金淋巴瘤(NHL)或多发性骨髓瘤。在2023年,异二聚体2+1 CD20-TCE glofitamab104,108和1+1 CD20-TCE epcoritamab109被批准用于治疗复发/难治性弥漫大B细胞淋巴瘤(DLBCL),以及1+1 G蛋白偶联受体C类5成员D(GPRC5D)-TCE talquetamab110和BCMA-TCE elranatamab111用于复发/难治性多发性骨髓瘤(表1)。CD20-TCE odronextamab112和BCMA-TCE linvoseltamab的上市申请正在等待监管决定。鉴于它们在复发/难治性B细胞和浆细胞恶性肿瘤患者中显示出的有希望的临床疗效和完全缓解率 —— 包括在CAR-T细胞治疗后复发的患者中的活性 —— 以及它们作为现成疗法的简单可用性以及皮下给药的可能性,可以预期TCEs将成为CAR-T细胞疗法的主要替代品,特别是随着它们开始被开发用于更早期的治疗线并且可以让患者轻松获得。免疫动员单克隆T细胞受体针对癌症(ImmTACs)是结合了工程化TCR以识别人类白细胞抗原(HLA)呈递的肽抗原与抗CD3 scFv的TCEs,实现对细胞内TAAs的靶向。值得注意的是,短暂存在的ImmTAC tebentafusp,它包含一个针对由HLA-A*02:01呈递的黑色素细胞谱系特异性抗原糖蛋白(gp100)表位的可溶性TCR融合到CD3靶向scFv,已在2022年被批准用于治疗葡萄膜黑色素瘤,为TCEs在实体瘤中的细胞内靶标空间开辟了新的领域。值得注意的是,tebentafusp介导了总体生存益处,尽管它只诱导了少数临床反应,因此直接杀死肿瘤细胞可能不是其唯一的MoA。与此同时,各种基于重组TCR或使用类似TCR的抗体(TCR模拟物)的TCEs已进入临床开发,包括针对WT1和突变新抗原如KRAS122或p53的TCEs。重要的是,高通量动力学筛选和通用TCR类似库可以促进高度选择性的TCR和TCR模拟物的开发,用于TCEs。有趣的是,使用共价KRASG12C抑制剂sotorasib,可以产生一种类似TCR的TCE,可以特异性识别HLA呈递的sotorasib-肽共轭物,并随后诱导KRASG12C突变细胞的T细胞杀伤。细胞因子释放综合征的发生,主要是由于靶向T细胞激活,一直是TCEs临床开发的一个主要挑战。尽管在许多情况下,这可以通过使用类固醇预处理和逐步剂量增加来管理,但最近的努力已经研究了使用具有降低CD3ε亲和力的CD3ε抗体,目标是将T细胞杀伤与细胞因子分泌解耦。与CAR-T细胞一样,由于TCEs的杀伤效力非常高,因此需要严格肿瘤特异性和/或谱系特异性表达目标抗原,以避免靶向非肿瘤毒性。对于血液癌症中的B细胞和浆细胞抗原,如CD19、CD20、CD79b、BCMA140141和FcRH5,通常认为它们只存在于B细胞和浆细胞恶性肿瘤以及非必需的B细胞和浆细胞谱系中。然而,即使对于CD19等抗原,其在正常组织中的表达可能并非绝对不存在,有报道称CD19在围绕内皮细胞的壁细胞/血管周细胞上表达,这些细胞对血脑屏障完整性至关重要,作为一种靶向非肿瘤机制与神经毒性有关。相比之下,在急性髓系白血病中,典型的抗原如CD33或CD123也存在于髓系造血谱系上,使得它们的临床开发更具挑战性。类似地,许多主要的(上皮)实体瘤抗原如EGFR、HER2、EpCAM、肿瘤相关钙信号转导蛋白2(也称为细胞表面糖蛋白Trop-2)、MUC1、CEACAM5和glypican 3也可以在(必需的)正常组织中找到。因此,由于更免疫抑制性的肿瘤微环境,TCEs(和CAR-T细胞)在实体瘤的开发在过去几年中进展较少。重要的是,必须认识到对于TCEs,与ADCs150相比,由于更高的效力,对肿瘤选择性的要求更严格,固体瘤ADC靶标如HER2和TROP-2可能无法用传统的TCEs靶向。与此同时,与TCEs相比,ADCs可能由于在肿瘤微环境中释放有毒载荷而受益于更强的旁观者杀伤效应,对抗原阴性肿瘤细胞进行杀伤。因此,很少有肿瘤选择性抗原似乎是TCEs的可行靶标,包括新抗原如p95-HER2和EGFRvIII,或者MUC16、claudin 18.2、DLL3和STEAP1等靶标。对于DLL3靶向的TCE tarlatamab,目前正在美国食品药品监督管理局(FDA)的优先审查中,已在小细胞肺癌中报告了有希望的I期临床数据,总反应率达到23%。随后的II期研究证实了活动性,持久的客观反应和有希望的生存结果,使用每2周10毫克剂量治疗的患者。基于这些数据,已启动了一项随机关键研究,比较tarlatamab与标准护理(NCT05740566)。同样,xaluritamig,一种2+1 STEAP1 TCE,具有亲和力驱动的活性,能够选择性地针对高表达STEAP1的肿瘤细胞与正常细胞相比,已在转移性去势抵抗性前列腺癌患者的I期剂量递增研究中展示了有希望的临床活性。综上所述,这些概念验证数据表明,TCEs仅限于血液癌症活跃的共同假设,特别是B细胞恶性肿瘤,并不适用,并且TCEs也有可能治疗某些实体瘤,只要能够管理靶向非肿瘤活性。正在使用多种方法来克服实体瘤选择性挑战。例如,在双特异性抗体中使用具有降低亲和力的肿瘤抗原结合物(2+1格式)可以实现亲和力介导的选择性增益(也称为亲和力调节),目标是利用肿瘤和正常组织之间的表达差异,如CEACAM5、HER2和FOLR1,以提高肿瘤选择性。或者,双重靶向和亲和力介导的选择性增益应用于三特异性TCEs,这些TCEs选择性地杀死共同表达这些靶标的肿瘤细胞,但不会影响只表达这些靶标中一个的正常细胞。此外,针对两种不同的肿瘤抗原如CD19和CD22的三特异性TCEs可以防止通过抗原丢失的免疫逃逸。尽管大多数传统的TCEs可以招募常规T细胞和非传统先天样γδ T细胞(表达TCRγ/δ而非TCRα/β的T细胞),但一类特定的γδ TCEs已被设计为通过TCRγδ特别招募γδ T细胞,目标是通过只针对可以在患者中进一步扩展的T细胞亚群来提高安全性和有效性。在临床前研究中,γδ TCEs作为单一药物显示出强大的抗肿瘤活性。或者,为了此目的,制造了针对肿瘤的双特异性异二聚体BTN2A1和BTN3A1抗体融合蛋白。由于γδ T细胞生物学在小鼠模型中没有完全反映,这种方法的最终概念验证将不得不依赖于正在进行的临床试验的临床数据,如针对PSMA的γδ TCE LAVA-1207(NCT05369000)。而不是针对CD3ε或TCRα/β的双特异性抗体,肽-MHC复合物可以被应用来特别招募特定pMHC复合物的T细胞,如由于自然发生和普遍的巨细胞病毒感染而存在的巨细胞病毒衍生肽。在另一种方法中,病毒表位可以被传递到肿瘤细胞中,以便加载相应的MHC分子,并招募病毒特异性T细胞攻击这些细胞。还描述了用于更有效介导双特异性抗体介导的聚集和补体依赖性细胞毒性的双特异性抗体。有趣的是,通过应用两对独立的抗体,可以建立一种逻辑门,通过补体依赖性细胞毒性选择性地消除共表达两种抗原的细胞。例如,使用这种方法,可以消除共表达CD20和CD52的B细胞,而单独表达这些抗原的细胞则不会被杀死。随着对采用CAR-T细胞疗法的极大兴趣,一类特定的TCEs,作为CAR-T细胞和肿瘤细胞之间的双特异性适配器,已被设计为特别招募采用转移的T细胞用于治疗各种癌症,同时不涉及自然T细胞。其中一个例子是合成激动性受体(SAR)-T细胞系统,其中一种双特异性抗体识别肿瘤抗原和一个引入到采用转移的T细胞中的合成抗原受体。这种在合成生物学背景下的方法提供了多种方式。
进一步工程化和控制采用T细胞疗法方法,超出了传统抗体疗法或经典CAR-T细胞疗法所能提供的范围。另一种结合细胞疗法和双特异性抗体的方法是体外武装T细胞与多种TCEs,目标是克服肿瘤异质性。为此,T细胞在体外与针对肿瘤抗原如GD2、HER2、PSMA和STEAP1的TCEs孵育,并给药于肿瘤携带动物,在这些动物中,由于抗原丢失,它们阻止了肿瘤进展。
固有细胞招募剂
尽管TCEs在效应细胞招募剂领域占据主导地位,但正在大力开发下一代ICEs,包括NKCEs和双特异性抗体,这些抗体招募髓系衍生细胞(MDCs)进行吞噬作用,包括中性粒细胞和巨噬细胞/单核细胞。介导ADCC的单克隆抗体,如利妥昔单抗、西妥昔单抗或曲妥珠单抗,因为ADCC/抗体依赖性细胞吞噬作用对其MoA至关重要,除了其他作用如信号抑制外,可以被视为第一代ICEs。基于这种经验,已经批准了几种与常规单克隆抗体相比具有增强ADCC功能的Fc工程化IgG1抗体,包括obinutuzumab、mogamulizumab、tafasitamab、margetuximab和amivantamab。基于这种经验和目标,进一步增强ADCC功能,超越Fc工程化IgG1抗体,已经开发了各种双特异性NKCEs,它们针对自然杀伤细胞上的不同表面分子,如CD16、NKG2D、NKp46或NKp30,作为免疫疗法。这些NKCEs中最先进的是一种短半衰期的CD30×CD16双特异性抗体,用于治疗霍奇金淋巴瘤,可以作为单一疗法、与检查点抑制联合或与自然杀伤细胞输注联合使用。最近,开发了针对抗原如EGFR或BCMA的半衰期延长的四价IgG基双特异性抗体,以及利用双重靶向实现肿瘤选择性的三特异性抗体。对称的三特异性NKCEs通过ADCC特别针对通过其CD16结合区域共表达EGFR和PDL1的细胞,使用两种合一抗体技术。另一种激活自然杀伤细胞的方法依赖于双特异性融合蛋白,该蛋白由NKG2D配体(例如UL-16结合蛋白2(ULBP2))与针对HER2的scFv融合,以实现有效的ADCC介导的肿瘤细胞杀伤。或者,保留FcγRIII结合的双特异性抗体,针对NKp46或NKp30和各种肿瘤抗原,可以提供强大的抗肿瘤效果。与TCEs不同,其中FcγR结合是不需要的,这些双特异性抗体依赖于保留或增强的FcγRIII结合,以实现有效的自然杀伤细胞参与。值得注意的是,当IL-2变体被融合到NKp46双特异性抗体上,产生四功能分子时,由于同时诱导自然杀伤细胞扩增,效果大大增强。另一个积极研究的领域是双特异性抗体,这些抗体通过结合,例如,巨噬细胞和中性粒细胞上的FcαRI受体(CD89)或通过双特异性IgE抗体的IgE受体,参与吞噬作用或MDCs以及中性粒细胞的杀伤。或者,肿瘤靶向双特异性抗体可以阻断肿瘤细胞上基于'不要吃我信号'的CD47–SIRP1α相互作用,以便这些细胞被MDCs攻击和吞噬。双特异性CD19 x CD47或间皮素x CD47抗体结合了肿瘤靶向和CD47抑制以及通过效应功能完整的Fc部分招募效应细胞。在这种情况下,对CD47具有低亲和力的双特异性抗体有利于克服不必要的结合到红细胞上的CD47。
各种团队应用这一概念进行PDL1×CD47共靶向。或者,SIRPα融合蛋白可以用来阻断CD47–SIRPα“不要吃我”信号。
共刺激双特异性抗体
有效、持久且局部限制的抗肿瘤免疫反应需要共刺激和共抑制信号来紧密调节细胞毒性T细胞、自然杀伤细胞和巨噬细胞的激活、分化和维持。TNFRSF家族成员(如4-1BB、CD40、OX40、TNFRSF18(也称为糖皮质激素诱导的TNFR相关蛋白(GITR))、CD27或CD30)以及CD28免疫球蛋白超家族(如CD28、CTLA4、PD1、诱导性T细胞共刺激因子(ICOS)和B淋巴细胞和T淋巴细胞衰减因子(BTLA))及其相应的配体,在通过细胞-细胞接触(如抗原呈递细胞(APCs)和T细胞之间)提供的局部免疫调节信号中发挥着显著作用。这些受体为T细胞提供了所谓的信号2,这对于维持TCR通过肽-MHC-TCR相互作用或通过TCE交联TCR所提供的信号1是必需的。针对这些免疫调节途径的靶向可能增强免疫疗法。研究表明,针对共刺激受体的激动性单克隆抗体通常只会导致微弱的激活,但这种激活可以通过FcγR介导的受体超聚集显著增加。此外,抗体与受体之间的化学计量比、结合亲和力和表位特异性等因素可以影响共刺激抗体的活性。因此,降低免疫调节抗体的亲和力可以作为一种策略,通过增加受体聚集来增强激动性活性,这一原则经常应用于双特异性抗体激动剂(见上文)。然而,由于增加的趋化因子和细胞因子产生导致的免疫相关系统性不良事件是共刺激抗体药物开发的限制因素。抗体-细胞因子融合蛋白和双特异性抗体能够以目标依赖的方式提供共刺激信号,通过双重靶向两种不同的共刺激受体或通过靶向共刺激受体和CPI来规避这一限制。
肿瘤靶向共刺激双特异性抗体
用一个臂结合到TAA上,另一个臂结合到免疫细胞上的共刺激受体上的双特异性抗体,可以通过在癌细胞和免疫细胞之间跨作用来局部介导受体聚集,从而提供信号2。目前正在临床试验中的共刺激双特异性抗体包括针对4-1BB、CD40和CD28的分子。T细胞激活后诱导表达的4-1BB使其成为增强CD8 T细胞反应的T细胞共刺激的有吸引力的靶标。使用针对4-1BB的激动性抗体(如urelumab和utomilumab)作为单一疗法在临床试验中的安全性问题和较差的疗效,使人们重新将努力集中在可以克服这些毒性的双特异性抗体上,通过引入肿瘤特异性共刺激。大约一半的癌症靶向共刺激双特异性抗体在临床试验中通过4-1BB发挥作用。先进的双特异性抗体包括PRS-343(cinrebafusp),一种针对HER2和4-1BB的四价双特异性抗体-抗钙蛋白融合蛋白,在IND使能研究中被发现耐受性良好,没有明显和相关药物相关毒性;FAP-4-1BBL(RG7872),作为单一疗法和与PDL1抑制联合使用时显示出药理活性;或englumafusp alfa,正在研究中作为与glofitamab联合用于DLBCL的信号2提供者。其他在临床试验中通过4-1BB进行肿瘤选择性共刺激的双特异性抗体目标包括EGFR、PSMA、CLDN18.2、B7H4、CEACAM5、HER2、PDL1(见下文)和FAP48。此外,使用CD28作为共刺激受体的双特异性抗体,目前在临床试验中。通过与APC上的CD80(也称为B7.1)或CD86(也称为B7.2)的结合,CD28为幼稚T细胞提供了必要的二次信号,以实现完全的T细胞激活和存活。这种信号也可以通过激动性CD28抗体提供,即使在没有初级TCR参与的情况下,如超激动剂TGN1412所示,它在I期研究中因大量细胞因子释放综合征而显著失败。后来发现,TGN1412特别在低剂量下作用于调节性T细胞(Treg细胞),而在高剂量下激活传统T细胞和Treg细胞,为选择性靶向T细胞亚群提供了窗口,但也突出了T细胞共刺激与超激活之间的微妙平衡。一些双特异性抗体可以以目标依赖的方式提供这种二次共刺激信号,以增强肿瘤限制性的抗肿瘤T细胞反应。值得注意的是,双特异性抗体可以被设计为单独使用时活性有限且无毒性,但可以增强T细胞激活和TCEs的抗肿瘤活性。REGN5837是一种针对CD22和CD28的双特异性抗体,已进入与针对CD20的TCE odronextamab联合用于NHL治疗的I期试验。肿瘤靶向CD28双特异性抗体也可以与PD1协同作用,提供长期抗肿瘤免疫反应,目前,多个针对TAAs如EGFR、MUC16、PSMA、B7-H3、CD19、CD22或PDL1的双特异性抗体正在进行临床试验,与检查点抑制联合使用或作为单一疗法。
MDCs和树突细胞激活双特异性抗体
CD40在包括APCs、其他MDCs和B细胞在内的多种细胞类型中表达,但也在广泛的恶性细胞上表达。单克隆激动性CD40抗体可以通过诱导APCs成熟和激活抗原特异性T细胞和其他免疫细胞来触发抗肿瘤效应,从而促进肿瘤特异性免疫反应,特别是通过启动细胞毒性T细胞。除了具有剂量限制毒性的激动性CD40抗体外,还开发了针对CD40和各种TAAs如CEACAM5、EpCAM或间皮素的双特异性抗体。与其他TNF超家族成员一样,受体聚集在受体激活中起着关键作用。将CD40激动性抗体与针对肿瘤靶向抗原的抗体结合在双特异性抗体中,允许共刺激活性定向到TME,从而提高安全性和有效性。例如,针对CD40和CEACAM5或EpCAM的四价双特异性抗体的概念验证表明,与单一CD40抗体相比,它们增强了T细胞交叉启动。针对间皮素和CD40的双特异性抗体(ABBV-428)在体外和体外模型中展示了增强的APC和T细胞激活,并且在I期试验中显示出可接受的安全性概况。为了在肿瘤内而不是外周选择性激活CD40,生成了FAP×CD40,一种包含两个CD40结合位点和一个FAP结合位点的双特异性抗体。该抗体提供了一个强烈的FAP依赖性CD40刺激信号,展示了良好的安全性概况以及肿瘤积聚和肿瘤内免疫激活,目前正在进行I期临床试验。MP-0317是一种多功能设计ankyrin重复蛋白(DARPin),应用相同的概念,针对FAP、CD40和HSA进行半衰期延长,目前正在进行I期临床研究。或者,双特异性抗体可以通过Clec12a标记物直接靶向树突细胞。
双特异性抗体的双重共刺激
在免疫细胞上双重靶向两种不同的共刺激受体已被用于诱导强大的抗肿瘤反应。FS120是一种针对活化T细胞上表达的4-1BB和OX40的四价双特异性抗体,以一种不依赖FcγR的方式激活CD4和CD8 T细胞。这种活性需要两个受体的共刺激才能有效激活免疫细胞并发挥抗肿瘤活性,支持使用四价双特异性抗体双重靶向共刺激受体以诱导有效的受体聚集和激活的概念。在动物研究中,FS120的替代品没有引起肝脏炎症和肝毒性,这是激动性4-1BB抗体观察到的限制。FS120目前正在进行I期临床试验。类似的方法中,开发了一种双价双特异性抗体,用于双重靶向4-1BB和CD40(BNT-312,tecaginlimab),因此靶向T细胞和APCs。APCs的CD40激活导致共刺激分子的上调和免疫刺激性细胞因子的分泌,从而在不依赖CD4 T细胞帮助的情况下,实现强大的CD8 T细胞介导的抗肿瘤免疫反应。
双特异性抗体用于双重检查点抑制和共刺激
抗共刺激受体的抗体还被与CPIs结合使用,以释放T细胞免受抑制信号的影响,同时增强T细胞反应,特别是在对检查点抑制有抵抗力或难治性的肿瘤中。大多数目前正在临床试验中的双特异性抗体使用跨作用的方式结合这些信号,通过靶向肿瘤细胞上的PDL1和免疫细胞上的共刺激受体,其中4-1BB是最突出的靶标。超过十种不同的针对PDL1和4-1BB的双特异性抗体正在进行I期或II期试验。II期候选物包括一种IgG-anticalin融合蛋白(PRS-344),其中配体结合anticalin框架代表第二特异性,一种双价双特异性IgG抗体(acasunlimab,也称为GEN1046)和一种三价,三特异性单链二抗体-scFv融合蛋白,进一步包含一个HSA结合位点以延长半衰期(NM21-1480)。这些类型的双特异性抗体可以增强免疫反应,超越单一抗体及其组合,进一步提供针对PDL1表达肿瘤细胞的靶向共刺激,以及TME中的MDCs和肿瘤引流淋巴结。与此一致,TME中表达4-1BB的肿瘤浸润CD8 T细胞亚群表达高水平的PD1,因此容易受到PDL1×4-1BB双特异性抗体的治疗。值得注意的是,由于4-1BB信号需要超聚集,与PDL1的结合可以导致TME中条件聚集和激活的4-1BB,减少肝脏毒性,如四价双特异性IgG-scFv(ABL503)所示。遵循这一概念的进一步双特异性抗体包括四价双特异性单克隆抗体(FS222)和双价双特异性IgGs,如MCLA-145。同样,CD28共刺激和检查点抑制可以通过在肿瘤内顺式作用的T细胞双重靶向进一步实现。ATOR-1015的可行性已得到证明,它是一种针对OX40的IgG,融合到针对CTLA4的优化版本的V型域的CD86上。与4-1BB类似,CTLA4和OX40在活化的T细胞上上调,并由Treg细胞表达,特别是在TME中。与GITR和ICOS不同,CD27由naive T细胞表达,因此有助于促进新的T细胞反应。
PDL1×CD27双特异性抗体在临床前研究中比PD1阻断和CD27共刺激的组合更有效,同时展现出良好的安全性概况。在概念上类似的方法中,PD1的结合位点与其他TNF超家族的共刺激成员结合,包括4-1BB(如与IBI319结合)、GITR和ICOS(XmAb23104)。GITR也在活化的T细胞上上调,并由Treg细胞恒定表达,在其中发挥着增强初始免疫反应的关键作用。PD1×GITR-L双特异性融合蛋白的概念验证已经展示。对于这些药物中的一些,与联合或分别协同效应相比,检查点抑制的相对贡献并不一定确立。
新兴概念
支持双特异性抗体开发的概念从早期探索性方法迅速发展到临床开发,双特异性抗体现在已确立为治疗原则。然而,双特异性抗体领域仍在不断进展,以进一步探索和扩展技术和应用。学术界以及生物技术和制药工业追求的各种早期探索性双特异性抗体方法是有希望的,其中一部分可能提供尚未由当前开发中的双特异性抗体解决的治疗概念。本综述的范围不允许我们涵盖所有或许多这样的早期方法,实际上在这个快速增长的领域中可能无法全面覆盖。因此,我们通过提及一些我们认为相关并有潜力进一步推动基于双特异性抗体的癌症治疗界限的新兴主题来结束我们的综述。
三特异性TCEs与集成共刺激
共刺激信号可以与双特异性TCEs结合,以促进有效的T细胞激活。这已经通过上述的双特异性TCEs和共刺激双特异性抗体的组合实现,但也通过在双特异性TCE中包含第三个结合位点来针对共刺激受体,从而生成三特异性抗体。目前有两种这样的三特异性TCE正在进行临床试验,它们针对TAA和CD3,并进一步包含一个针对CD28的结合位点。SAR443216是一种三价三特异性免疫球蛋白基抗体,针对HER2×CD3×CD28,包含一个突变的IgG4,缺乏Fc介导的效应功能。这种三特异性抗体目前正在I期临床试验中,能够激活初级CD4和CD8 T细胞,诱导T细胞增殖,释放细胞因子和颗粒酶B以及T细胞介导的HER2表达肿瘤细胞的杀伤,包括HER2表达低的细胞。类似地,一种针对在多发性骨髓瘤中过度表达的CD38的结合位点与CD3和CD28结合位点结合在三特异性抗体SAR442257中,目前也在I期临床试验中。
前药方法
一种新兴的方法旨在通过提供“安全关键”的特异性作为前药,在肿瘤处选择性激活,从而生成具有高度肿瘤特异性功能的双特异性抗体。一些应用于失活抗体以生成前药并在肿瘤处重新激活的概念如图4所示。前药转化为功能性双特异性抗体可以通过肿瘤微环境中存在的肿瘤特异性蛋白酶等环境触发因素来实现。例如,具有空间屏蔽的双特异性抗体可以通过蛋白酶激活。需要肿瘤特异性蛋白酶表达的蛋白酶激活TCEs,即所谓的probodies,需要肿瘤特异性蛋白酶在TME中的表达才能激活。另一种早期阶段的双重肿瘤靶向方法依赖于从两个具有分裂CD3ε结合基团的双特异性抗体中肿瘤特异性组装功能性CD3ε抗体片段。这些实体需要被设计为在循环中作为单独实体时不活跃,以便它们只在肿瘤抗原结合和随后的原位组装后被激活,如已经为半抗体或前药激活链交换(PACE)分子所描述的那样。这类分子面临的主要挑战仍然是以单体形式大规模生产它们,并防止在没有目标结合的情况下过早组装。通过目标链交换介导的分裂型I细胞因子的重建就是一个例子,说明如何实现肿瘤特异性组装。值得注意的是,最近开发了一种引入到抗4-1BB抗体结合位点的ATP依赖性开关,以增加肿瘤选择性并避免靶上、靶外毒性。这种开关使用肿瘤中升高的ATP水平作为触发因素,可能也适用于其他结合实体。
图4 | 双特异性抗体领域的新兴概念。a, 带有集成共刺激的三特异性T细胞招募剂(TCEs),用于通过CD3结合同时激活T细胞受体(TCR)(信号1)和通过结合CD28进行共刺激(信号2)。b, 双特异性抗体(bsAb)前药的作用方式。用于生成前药并重新激活所需作用位点的抗体的一般概念包括:阻断结合位点以使抗体失活,以及通过蛋白酶诱导激活被阻断的抗原结合位点,对目标环境(如酸性pH或ATP)的亲和性调节,以及由于通过高浓度局部富集互补前药而进行的组装或交换反应。c, 通过结合表面抗原(肿瘤相关抗原(TAA))和降解分子,例如膜E3连接酶,实现蛋白酶体靶向嵌合体(PROTAC)方法,这导致细胞表面目标的内化和蛋白酶体降解。d, 例如通过基因疗法将bsAb传递到CAR-T细胞中。e, 细胞因子模拟bsAb触发细胞因子受体途径,如通过将受体域引入立体接近性,模仿细胞因子作用的IL-2Rβ–IL-2Rγ异二聚体。
PROTAC双特异性抗体
另一个新兴概念和新的作用机制最近被描述,它使用双特异性抗体通过靶向降解来灭活与增殖相关的过程。类似于新兴的双特异性或多特异性小分子蛋白水解靶向嵌合体(PROTACs)领域,双特异性抗体可以被设计为触发内部化并随后降解参与癌症发展和/或进展的表面蛋白。这样的双特异性抗体同时结合到被靶向降解的蛋白质,以及触发结合目标蛋白的内部化和随后降解的因素,如膜可及的E3泛素连接酶或转铁蛋白受体。目前还没有已知的抗体-PROTAC概念进入临床研究,但这类实体的开发与“标准”双特异性抗体的开发完全兼容,并为靶向新途径并尽快将其概念带入临床提供了独特的可能性。
双特异性抗体的传递
双特异性抗体发展的另一个重要新兴概念是局部生产和随后的局部传递双特异性抗体,例如通过脂质纳米粒子介导的mRNA传递CLADN6 TCE,溶瘤病毒或类似基因疗法的方法,包括CAR-T细胞。
细胞因子模拟抗体
最后,双特异性抗体也可以作为细胞因子模拟物或所谓的合成细胞因子激动剂。在这种情况下,已经描述了scFvs或基于单一结构域Vhh的方法,通过模仿IL-2或IL-15、IL-18、I型干扰素和IL-10有效地触发细胞因子信号。或者,可以通过使用分裂方法使用新设计的IL-2模拟蛋白neoleukin实现肿瘤特异性细胞因子受体激动活性。这种基于抗体的细胞因子模拟物在癌症免疫疗法中可能有各种应用。
展望
双特异性抗体领域近年来取得了显著进展,到2023年底,已有十多种双特异性抗体获得批准,许多不同的方法正在临床测试中。然而,我们认为,由于癌症的异质性和适应性,这些方法中不太可能有一种成为通用的癌症免疫疗法。相反,抗体将需要为特定应用量身定制,并将依赖于与其他方法的结合,以最大化它们的疗效和安全窗口。具有多重特异性的抗体治疗的发展增长可能会在未来几个领域发生:针对具有明确依赖性的肿瘤的肿瘤相关RTKs的双特异性抗体;用于以增加的选择性靶向肿瘤的双特异性ADCs;用于靶向降解适用于各种途径的细胞表面蛋白的双特异性PROTACs;以及用于癌症免疫疗法的多特异性抗体。在后一个领域,特别是对于非常有效的基于T细胞的疗法,如TCEs或CAR-T细胞,识别高度肿瘤选择性抗原将是至关重要的,将需要能够通过肿瘤特异性蛋白酶激活和更好地调节效应功能来特别实现肿瘤特异性活性,同时保护正常组织。另一个重要方面是提供双重检查点抑制和/或补充共刺激信号给T细胞,以维持和延长T细胞反应,如已被证明对CAR-T细胞疗法的临床成功至关重要。重要的是,这种方法不仅适用于与TCEs的组合,也适用于与内源性免疫方法的组合。另一个重要方面是通过激活先天免疫系统,包括自然杀伤细胞、MDCs和树突细胞,促进二次免疫反应的产生。与其他癌症药物一样,通过改进的诊断方法和新的发展范式,使双特异性抗体和多特异性基于抗体的治疗能够在疾病早期应用于患者将是实现治愈癌症患者目标的关键。
免疫疗法引进/卖出抗体药物偶联物细胞疗法申请上市
分析
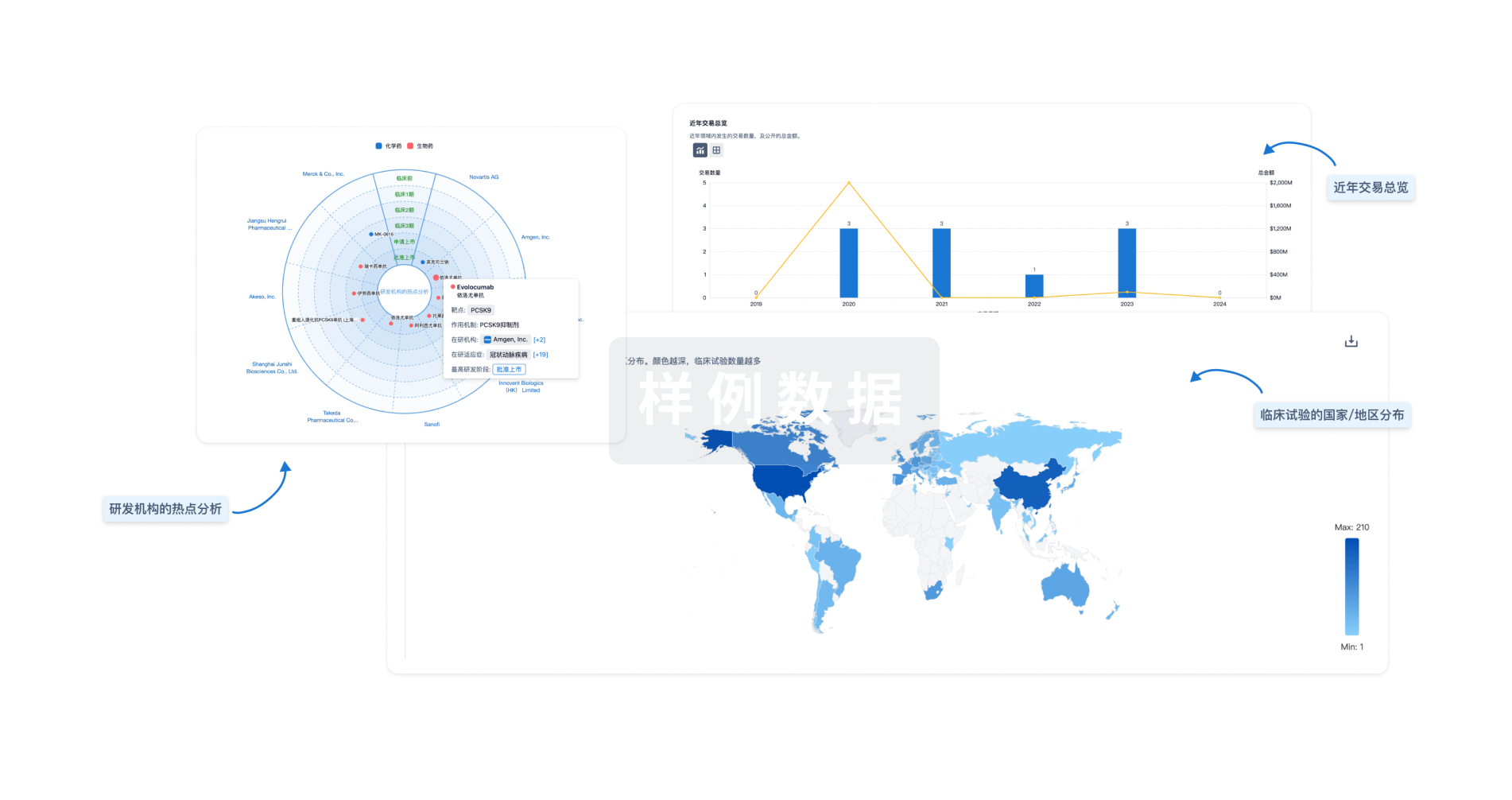
对领域进行一次全面的分析。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
