预约演示
更新于:2025-01-23
OTOF Q829X
更新于:2025-01-23
基本信息
别名- |
简介- |
关联
2
项与 OTOF Q829X 相关的药物作用机制 OTOF Q829X 调节剂 |
在研机构  辉大(上海)生物科技有限公司初创企业 辉大(上海)生物科技有限公司初创企业 |
原研机构  辉大(上海)生物科技有限公司初创企业 辉大(上海)生物科技有限公司初创企业 |
在研适应症 |
非在研适应症- |
最高研发阶段早期临床1期 |
首次获批国家/地区- |
首次获批日期1800-01-20 |
作用机制 OTOF Q829X 调节剂 [+1] |
在研机构  辉大(上海)生物科技有限公司初创企业 辉大(上海)生物科技有限公司初创企业 |
原研机构  辉大(上海)生物科技有限公司初创企业 辉大(上海)生物科技有限公司初创企业 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期1800-01-20 |
1
项与 OTOF Q829X 相关的临床试验NCT06025032
An Open-label, Multiple-cohort, Dose-finding, Investigator-initiated Trial to Evaluate the Safety, Tolerability, and Efficacy of HG205 RNA Base-Editing Therapy in Subjects With OTOF-p.Q829X Mutation-associated Hearing Loss
The purpose of the study is to determine whether HG205 as CRISPR/Cas13 RNA base-editing therapy is safe and effective for the treatment of hearing loss caused by p.Q829X mutation in OTOF gene.
开始日期2024-11-30 |
申办/合作机构  辉大(上海)生物科技有限公司初创企业 辉大(上海)生物科技有限公司初创企业 [+1] |
100 项与 OTOF Q829X 相关的临床结果
登录后查看更多信息
100 项与 OTOF Q829X 相关的转化医学
登录后查看更多信息
0 项与 OTOF Q829X 相关的专利(医药)
登录后查看更多信息
7
项与 OTOF Q829X 相关的新闻(医药)2024-08-13
遗传性耳聋是一种常见的由遗传因素引起的感觉障碍。全球约有2600万人受先天性耳聋影响,其中遗传因素约占病例的60%。
听神经病谱系障碍(Auditory neuropathy spectrum disorder,ANSD)是一种常见的常染色体非综合征型听力损失,其特征是听觉信号从耳蜗经听神经传入大脑的突触编码和/或神经传播受损。OTOF是第一个被发现的影响ANSD的基因,其编码耳畸蛋白(Otoferlin),与41%-91%的ANSD病例有关。此外,OTOF基因突变占遗传性耳聋病例的2%-8%。
OTOF基因的c.2485C>T(p.Q829X)突变是OTOF突变致耳聋的高加索人群中最常见的隐性致病突变,携带纯合子OTOF p.Q829X突变的患者通常表现为语前发病的严重、双侧和对称感音神经性听力损失。
遗憾的是,目前还没有可用于治疗这种严重的听力损失的药物上市,几项针对OTOF突变所致耳聋的早期临床试验显示出了良好的治疗效果,但这些治疗方法的长期疗效和安全性仍有待全面阐明。
2024年8月12日,复旦大学附属眼耳鼻喉科医院舒易来教授团队在 Nature Biomedical Engineering 期刊发表了题为:A base editor for the long-term restoration of auditory function in mice with recessive profound deafness 的研究论文。派真生物有幸为该研究提供了AAV服务,支持了这一关于遗传性耳聋疾病基因治疗的重要研究工作。
该研究利用腺嘌呤碱基编辑器(ABE)介导的基因编辑疗法有效修复了耳聋小鼠模型的Otof致病突变,恢复了88%的内耳内毛细胞的耳畸蛋白(Otoferlin)表达水平,同时改善了内耳内毛细胞的突触胞吐功能,并在长达1.5年的时间内将听力恢复到接近野生型的水平,且没有明显的脱靶效应。据悉,这是耳聋基因治疗领域,在动物模型中迄今观察时间最长的有效结果。
近年来,碱基编辑器(base editor)在高胆固醇血症、苯丙酮尿症、酪氨酸血症、早衰症、杜氏肌营养不良、Leber氏先天性黑蒙症、镰状细胞病及β-地中海贫血等多种遗传病的治疗中显示出巨大潜力。
值得注意的是,碱基编辑疗法已开始进入早期临床试验,用于治疗PCSK9基因突变引起的杂合子家族性高胆固醇血症,以及治疗急性淋巴细胞白血病。
碱基编辑器,例如腺嘌呤碱基编辑器(ABE)和胞嘧啶碱基编辑器(CBE),它们分别可以精确地将A·T转换为G·C,将C·G转换为T·A,而不会引起DNA双链断裂,被认为比基于CRISPR-Cas9的基因编辑技术更安全。
2020年6月,碱基编辑技术开创者刘如谦教授等人在 Science Translational Medicine 期刊发表论文【2】,通过双AAV载体递送胞嘧啶碱基编辑器(CBE),部分恢复了Tmc1基因隐性突变导致的完全耳聋小鼠的听力。这是人类首次通过基因编辑技术解决隐性遗传突变导致的遗传疾病,但治疗的小鼠只有部分听力恢复,并且这一效果在6周内减弱。这强调了在临床转化中进一步优化长期治疗疗效的必要性。
在这项最新研究中,研究团队评估了6种优化的腺嘌呤碱基编辑器(ABE)及sgRNA对Otof c.2482C>T(p.Q828X)从无义突变的A·T突变修复为野生型的G·C碱基对的效率。然后,研究团队将其中最有希望的ABE(由脱氨酶ABE7.10max和Cas9变体SpCas9-NG组成)-sgRNA组合包装到双载体腺相关病毒(AAV)血清型PHP.eB中(该AAV血清型对毛细胞转导效率高),并通过内耳注射给出生后1-3天的OtofQ828X/Q828X小鼠模型。
结果显示,这种ABE介导的基因编辑疗法有效修复了Otof致病突变,恢复了88%的内耳内毛细胞的耳畸蛋白(Otoferlin)表达水平,同时改善了内耳内毛细胞的突触胞吐功能,并在长达1.5年的时间内将听力恢复到接近野生型的水平,且没有明显的脱靶效应。
此外,即使给出生13-14天的OtofQ828X/Q828X小鼠模型治疗,它们的听觉功能也能得到显著恢复。研究团队还开发了针对人OTOF c.2485C>T(p.Q829X)位点的ABE治疗策略,将人源化OtofQ829X/Q829X小鼠模型的听力恢复到了与野生型小鼠相当的水平。
这些发现提示,腺嘌呤碱基编辑器(ABE)可用于挽救听觉突触病病例的听力功能,从而为遗传性听力损失提供了潜在的精准治疗策略。
Nature Biomedical Engineering 期刊同期还发表了 News & Views 文章,介绍了这项使用碱基编辑器纠正耳聋基因突变的新进展。
值得一提的是,2024年1月25日,复旦大学附属眼耳鼻喉科医院舒易来、李华伟、王武庆团队联合哈佛大学医学院及东南大学的研究人员在国际顶尖医学期刊《柳叶刀》(The Lancet)上发表了题为:AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial 的研究论文【3】。
这项在6名因OTOF双等位基因突变而听力严重障碍的患儿中进行的临床试验结果显示,AAV1-hOTOF作为一种常染色体隐性遗传性耳聋的新型基因疗法,具有良好的安全性和有效性。6名接受治疗的患儿中有5人获得了稳健的听力恢复和语言感知能力的改善。这些结果支持在常染色体隐性耳聋患儿中进行进一步的基因治疗研究。
据悉,这是迄今为止治疗患者最多、随访时间最长的基因疗法治疗遗传性耳聋的人体临床试验,也是全球第一项获得临床疗效的内耳基因治疗和双AAV载体的人体试验(Frist in Human)。
派真生物很荣幸能为该研究提供AAV服务,助力研究顺利开展。派真生物多年来专注于AAV包装服务,已经为20多个国家客户提供上万批次的AAV定制样品。未来,派真生物将继续创新地开发高效的AAV,助力更多遗传性疾病基因治疗的研究。
推荐阅读
1.复旦舒易来团队发布国际首个双耳基因治疗临床数据2.舒易来/杨辉/李华伟团队研发迷你型RNA碱基编辑器,治疗遗传性耳聋3.热烈祝贺全球首个先天性耳聋基因疗法取得重大突破,舒易来医生在欧洲分享临床试验结果!
转自:生物世界
关于派真生物
基因疗法临床研究临床结果
2024-08-13
·药时代
遗传性耳聋是一种常见的由遗传因素引起的感觉障碍。全球约有2600万人受先天性耳聋影响,其中遗传因素约占病例的60%。
听神经病谱系障碍(Auditory neuropathy spectrum disorder,ANSD)是一种常见的常染色体非综合征型听力损失,其特征是听觉信号从耳蜗经听神经传入大脑的突触编码和/或神经传播受损。OTOF是第一个被发现的影响ANSD的基因,其编码耳畸蛋白(Otoferlin),与41%-91%的ANSD病例有关。此外,OTOF基因突变占遗传性耳聋病例的2%-8%。
OTOF基因的c.2485C>T(p.Q829X)突变是OTOF突变致耳聋的高加索人群中最常见的隐性致病突变,携带纯合子OTOF p.Q829X突变的患者通常表现为语前发病的严重、双侧和对称感音神经性听力损失。
遗憾的是,目前还没有可用于治疗这种严重的听力损失的药物上市,几项针对OTOF突变所致耳聋的早期临床试验显示出了良好的治疗效果,但这些治疗方法的长期疗效和安全性仍有待全面阐明。
2024年8月12日,复旦大学附属眼耳鼻喉科医院舒易来教授团队在 Nature Biomedical Engineering 期刊发表了题为:A base editor for the long-term restoration of auditory function in mice with recessive profound deafness 的研究论文。
该研究利用腺嘌呤碱基编辑器(ABE)介导的基因编辑疗法有效修复了耳聋小鼠模型的Otof致病突变,恢复了88%的内耳内毛细胞的耳畸蛋白(Otoferlin)表达水平,同时改善了内耳内毛细胞的突触胞吐功能,并在长达1.5年的时间内将听力恢复到接近野生型的水平,且没有明显的脱靶效应。据悉,这是耳聋基因治疗领域,在动物模型中迄今观察时间最长的有效结果。
近年来,碱基编辑器(base editor)在高胆固醇血症、苯丙酮尿症、酪氨酸血症、早衰症、杜氏肌营养不良、Leber氏先天性黑蒙症、镰状细胞病及β-地中海贫血等多种遗传病的治疗中显示出巨大潜力。
值得注意的是,碱基编辑疗法已开始进入早期临床试验,用于治疗PCSK9基因突变引起的杂合子家族性高胆固醇血症,以及治疗急性淋巴细胞白血病。
碱基编辑器,例如腺嘌呤碱基编辑器(ABE)和胞嘧啶碱基编辑器(CBE),它们分别可以精确地将A·T转换为G·C,将C·G转换为T·A,而不会引起DNA双链断裂,被认为比基于CRISPR-Cas9的基因编辑技术更安全。
2020年6月,碱基编辑技术开创者刘如谦教授等人在 Science Translational Medicine 期刊发表论文【2】,通过双AAV载体递送胞嘧啶碱基编辑器(CBE),部分恢复了Tmc1基因隐性突变导致的完全耳聋小鼠的听力。这是人类首次通过基因编辑技术解决隐性遗传突变导致的遗传疾病,但治疗的小鼠只有部分听力恢复,并且这一效果在6周内减弱。这强调了在临床转化中进一步优化长期治疗疗效的必要性。
在这项最新研究中,研究团队评估了6种优化的腺嘌呤碱基编辑器(ABE)及sgRNA对Otof c.2482C>T(p.Q828X)从无义突变的A·T突变修复为野生型的G·C碱基对的效率。然后,研究团队将其中最有希望的ABE(由脱氨酶ABE7.10max和Cas9变体SpCas9-NG组成)-sgRNA组合包装到双载体腺相关病毒(AAV)血清型PHP.eB中(该AAV血清型对毛细胞转导效率高),并通过内耳注射给出生后1-3天的OtofQ828X/Q828X小鼠模型。
结果显示,这种ABE介导的基因编辑疗法有效修复了Otof致病突变,恢复了88%的内耳内毛细胞的耳畸蛋白(Otoferlin)表达水平,同时改善了内耳内毛细胞的突触胞吐功能,并在长达1.5年的时间内将听力恢复到接近野生型的水平,且没有明显的脱靶效应。
此外,即使给出生13-14天的OtofQ828X/Q828X小鼠模型治疗,它们的听觉功能也能得到显著恢复。研究团队还开发了针对人OTOF c.2485C>T(p.Q829X)位点的ABE治疗策略,将人源化OtofQ829X/Q829X小鼠模型的听力恢复到了与野生型小鼠相当的水平。
这些发现提示,腺嘌呤碱基编辑器(ABE)可用于挽救听觉突触病病例的听力功能,从而为遗传性听力损失提供了潜在的精准治疗策略。
Nature Biomedical Engineering 期刊同期还发表了 News & Views 文章,介绍了这项使用碱基编辑器纠正耳聋基因突变的新进展。
值得一提的是,2024年1月25日,复旦大学附属眼耳鼻喉科医院舒易来、李华伟、王武庆团队联合哈佛大学医学院及东南大学的研究人员在国际顶尖医学期刊《柳叶刀》(The Lancet)上发表了题为:AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial 的研究论文【3】。
这项在6名因OTOF双等位基因突变而听力严重障碍的患儿中进行的临床试验结果显示,AAV1-hOTOF作为一种常染色体隐性遗传性耳聋的新型基因疗法,具有良好的安全性和有效性。6名接受治疗的患儿中有5人获得了稳健的听力恢复和语言感知能力的改善。这些结果支持在常染色体隐性耳聋患儿中进行进一步的基因治疗研究。
据悉,这是迄今为止治疗患者最多、随访时间最长的基因疗法治疗遗传性耳聋的人体临床试验,也是全球第一项获得临床疗效的内耳基因治疗和双AAV载体的人体试验(Frist in Human)。
论文链接:
1. https://www-nature-com.libproxy1.nus.edu.sg/articles/s41551-024-01235-1
2. https://www-science-org.libproxy1.nus.edu.sg/doi/10.1126/scitranslmed.aay9101
3.https://www-thelancet-com.libproxy1.nus.edu.sg/journals/lancet/article/PIIS0140-6736(23)02874-X/fulltext
封面图来源:123rf
版权声明/免责声明
本文为授权转载文章。
本文仅作信息交流之目的,不提供任何商用、医用、投资用建议。
文中图片、视频、字体、音乐等素材或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络,部分素材根据CC0协议使用,版权归拥有者,药时代尽力注明来源。
如有任何问题,请与我们联系。
衷心感谢!
药时代官方网站:www.drugtimes.cn
联系方式:
电话:13651980212
微信:27674131
邮箱:contact@drugtimes.cn
为何扫尽脑内“垃圾”,仍不记得你? 还需回归整体观!
首付款7亿美元!国产双抗出海默沙东
被两大老牌药企盯上,CAR-T何以成为“香饽饽”?
点击这里,发现价值信息!
基因疗法临床结果临床研究
2024-04-23
4月15日,辉大基因宣布,美国FDA授予该公司的迷你型dCas13X-RNA碱基编辑器(mxABE)疗法儿科罕见病药物资格(RPDD),用于治疗OTOF(otoferlin)基因中Q829X突变相关的儿童听力损失。这是辉大基因继2024年2月29日获得孤儿药(ODD)认定后FDA再次认可其潜在临床价值,成为首个获得ODD和RPDD双认定的Cas13X-RNA碱基编辑器疗法。
2023年发表在Cell-Molecular Therapy杂志的临床前研究数据显示,辉大基因研发的迷你型dCas13X-RNA碱基编辑器疗法有潜力为因OTOF基因中Q829X突变而患有严重听力损失的儿童恢复听力。
在本项研究中,研究人员引入了一种通过AAV9变体传递的增强型迷你型dCas13X的小型化RNA碱基编辑器——emxABE。由于emxABE小型化的特点,克服了AAV病毒载体递送尺寸的限制,只需单个AAV载体即可递送。此外,与基于CRISPR-Cas9的基因编辑相比,emxABE不会对基因组DNA造成永久性改变,而是对mRNA进行精准的单碱基改变,具有更高的安全性。
在人源化OtofQ829X/Q829X小鼠出生后0-3天期间通过耳蜗内蜗管注射AAV-emxABE,观察到近乎100%的内耳毛细胞中恢复了OTOF的表达。此外,它们的听觉功能显著改善,达到与野生型小鼠相似的水平,这种听觉功能至少持续了7个月,显示出该疗法具有长期效果。该研究还对出生后5-7天和30天的小鼠进行了治疗,通过内耳圆窗膜注射注射AAV-emxABE,同样有效恢复了听觉功能。
听力损伤是最常见的先天性缺陷,每1000名新生儿中就有1~2名先天性耳聋患儿,其中60%是由基因缺陷导致的。到目前为止,还没有有效的药物能够治疗先天性耳聋。当前的主要方法是植入人工耳蜗。但人工耳蜗存在诸多不足,例如在嘈杂的环境中对语音接受理解受限,且音乐感知能力差。
OTOF基因编码otoferlin蛋白,主要表达在内毛细胞,是内毛细胞突触传递过程中的关键蛋白。约2~8%的先天性非综合征型听力损伤是由OTOF基因突变引起。OTOF基因突变也是听神经谱系障碍的主要原因。全世界大约有16万人受OTOF基因缺陷影响,在中国预计有3万名OTOF耳聋患者,每年预计新增400名新患者。
OTOF是最早被发现的耳聋基因,有研究表明OTOF突变患者内毛细胞发育未受影响,内毛细胞形态正常。对于这样的患者,基因治疗有希望带来比人工耳蜗更好的治疗效果。
近年来,基因疗法成功治疗了多种人类但基因遗传疾病。对于OTOF基因突变导致的耳聋,除了碱基编辑器疗法,另一种常见的基因治疗策略是使用腺相关病毒(AAV)将正确版本的OTOF基因的DNA递送到内耳毛细胞,替代突变基因,进而恢复听力,也就是基因过表达策略。为了解决OTOF基因过大而超过单个AAV载体载荷的问题,目前候选药物均采用AAV双载体,旨在将OTOF cDNA分段包装于两个AAV载体。目前全球有3款AAV双载体在研疗法包括再生元(Regeneron Pharmaceuticals)收购Decibel Therapeutics公司时所获得的DB-OTO、礼来(Eli Lilly and Company)收购Akouos公司获得的AK-OTOF和Sensorion的 SENS-501,目前也都处于早期临床阶段。其中,DB-OTO的临床进展更快。前不久,再生元公布了DB-OTO治疗首例患者的临床试验结果,1名不到2岁的患者在接受治疗后的第6周观察到了听觉反应有改善。
AK-OTOF的设计原理也是利用两种AAV携带OTOF基因的不同片段,表达时通过基因片段的自修复,在细胞内完成全长OTOF基因的表达。礼来在2022年10月以12.50美元/股的价格收购了Akouos,加码基因疗法。目前,该疗法处于1/2期临床试验阶段。今年1 月 23 日, Akouos 宣布了 1/2 期 AK-OTOF-101 研究的初步临床结果。该研究表明第一位参与者(一位 11 岁的男孩)在服用 AK-OTOF 后,30 天内观察到听力恢复,该男孩自出生起就听力丧失。
Sensorion也开发了一款治疗Otoferlin基因介导的听力损失的双载体AAV基因疗法SENS-501。今年1月,Sensorion宣布其基因疗法SENS-501在欧洲提交的临床试验申请(CTA)已经被批准,将率先在法国启动1/2期临床试验,旨在评估SENS-501在6-31个月患儿中的安全性、耐受性和有效性。未来,该疗法可能会在意大利、德国等国家开展临床试验。
国内方面,鼎新基因和星奥维妥走在前列。鼎新基因是国内率先采用AAV双载体递送技术的基因治疗公司,其与复旦大学附属眼耳鼻喉科医院合作推进的RRG-003是一款靶向OTOF基因的双AAV内耳基因疗法,采用了基因补偿的方式,通过局部微创给药将RRG-003递送到耳蜗内,补偿缺陷的耳畸蛋白。在2023年第30届欧洲基因与细胞治疗学会(ESGCT)年会上,RRG-003的IIT研究结果显示,首批接受治疗的患者中有4例患者在治疗后得到了明显的听力改善,已可以日常对话,并且耐受性和安全性良好。
星奥拓维已经搭建了AAV递送系统智能开发平台、跨物种内耳基因治疗实验平台、高通量类器官与再生筛选平台、基因编辑平台和超容量基因递送平台,正开发AAV的双载体、三载体系统。其已经布局了超过5条产品管线,进展最快的是用于治疗OTOF基因突变引起的感音神经性耳聋的AAV基因疗法OTOV-101,其IIT研究已经初步展现出良好的疗效和安全性。
虽然目前国内针对耳聋的基因疗法才刚刚迈入临床,但是已经在该领域积累了不错的科研成果,并且已经开始向临床转化。从国内外研究与应用的方向,我们大体可以总结出,在耳聋领域的基因疗法未来将围绕载体和基因编辑工具不断进行优化,或通过基因导入、基因修复、毛细胞再生等途径实现治疗,甚至mRNA疗法、细胞疗法也会诞生。先天性耳聋是医学界最大的未满足需求的领域之一,影响着全世界数以万计的儿童,相信未来必将有更多企业投身于此。
参考来源
1. 企业官网
2. Jiang L, Wang D, He Y, Shu Y. Advances in gene therapy hold promise for treating hereditary hearing loss. Mol Ther. 2023 Apr 5;31(4):934-950. doi: 10.1016/j.ymthe.2023.02.001. Epub 2023 Feb 8. PMID: 36755494; PMCID: PMC10124073.
3. Yuanyuan Xue.(2023)RNA base editing therapy cures hearing loss induced by OTOF gene mutation. Molecular Therapy.DOI:https://doi-org.libproxy1.nus.edu.sg/10.1016/j.ymthe.2023.10.019
4. Jun Lv et al., (2024). AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial. The Lancet, https://doi-org.libproxy1.nus.edu.sg/10.1016/S0140-6736(23)02874-X
内容来源于网络,如有侵权,请联系删除。
基因疗法孤儿药临床结果信使RNA临床研究
分析
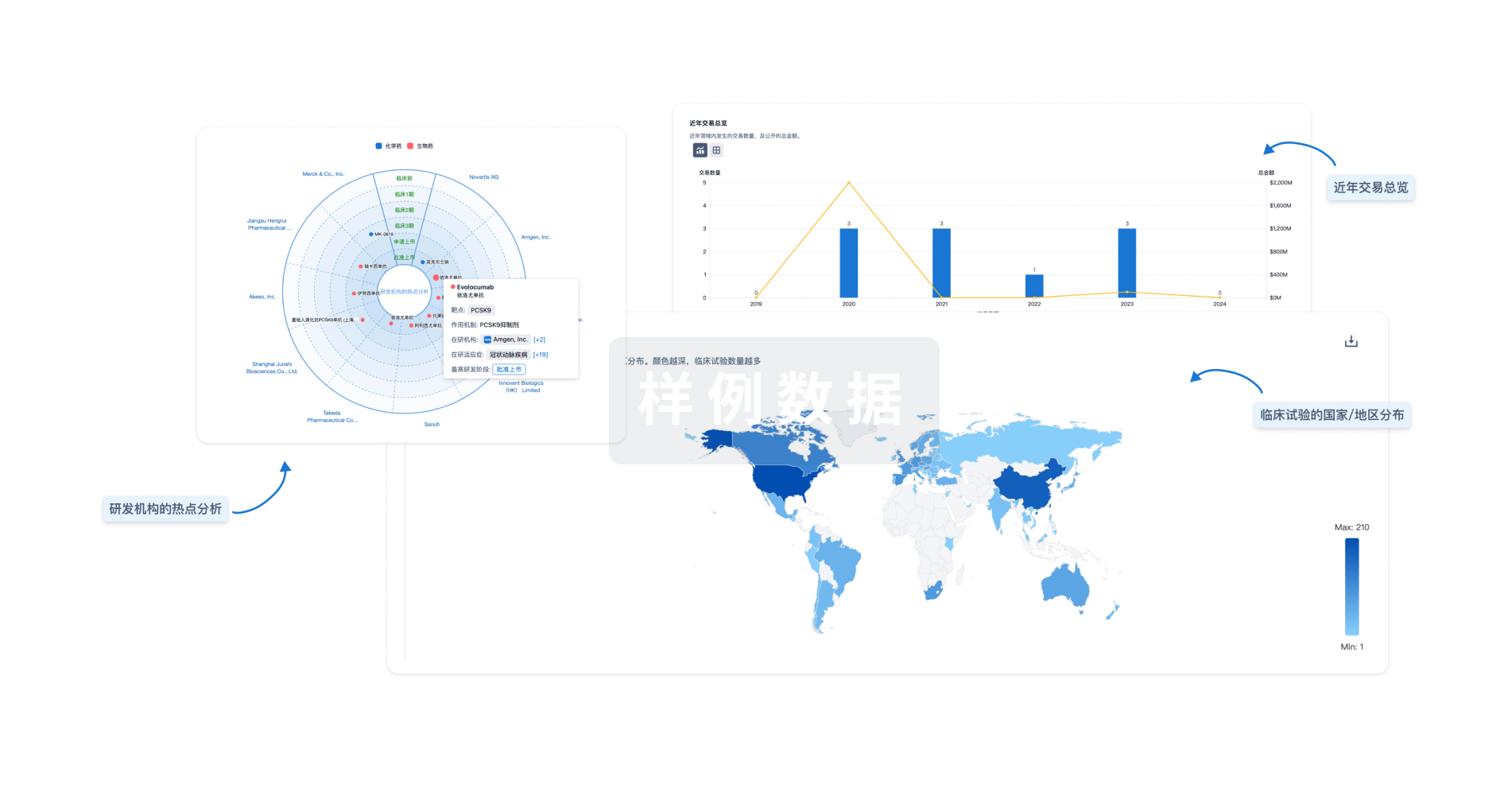
对领域进行一次全面的分析。
登录
或
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用