预约演示
更新于:2025-09-27

Claruvis Pharmaceutical Co.
重庆誉颜制药有限公司|子公司|2020|中国重庆市
重庆誉颜制药有限公司|子公司|2020|中国重庆市
更新于:2025-09-27
概览
标签
皮肤和肌肉骨骼疾病
神经系统疾病
其他疾病
毒素
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 疾病领域 | 数量 |
|---|---|
| 神经系统疾病 | 1 |
| 排名前五的药物类型 | 数量 |
|---|---|
| 毒素 | 2 |
| 排名前五的靶点 | 数量 |
|---|---|
| SNAP25(突触相关蛋白25) | 2 |
关联
2
项与 重庆誉颜制药有限公司 相关的药物靶点 |
作用机制 SNAP25 抑制剂 |
在研机构 |
原研机构 |
非在研适应症- |
最高研发阶段申请上市 |
首次获批国家/地区- |
首次获批日期- |
靶点 |
作用机制 SNAP25 modulators |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床2期 |
首次获批国家/地区- |
首次获批日期- |
5
项与 重庆誉颜制药有限公司 相关的临床试验NCT06481475
A Randomized Double-blind Vehicle-controlled Parallel-dose Phase II Study Evaluating the Safety and Efficacy of a Recombinant Botulinum Neurotoxin Type a Injection (YY003) for the Treatment of Moderate to Severe Glabellar Lines in Adults
The study is a two-part (Part A and Part B) randomized double-blind vehicle-controlled multi-center study in a total of 174 participants with moderate to severe glabellar lines. The objective of this study is to test the safety, efficacy, immunogenicity of YY003, and compare to vehicel control, in improving the appearance of moderate to severe glabellar lines.
开始日期2025-01-09 |
申办/合作机构 |
NCT06783114
A Clinical Study to Evaluate the Efficacy and Safety of Recombinant Botulinum Toxin Type a (YY001) for Injection in the Treatment of Upper Limb Spasticity in Adults (REHAB-1)
This is a randomized, double-blind, dose escalation, placebo- and active-controlled parallel-group multi-center phase II study to evaluate the efficacy and safety of Recombinant Botulinum Toxin Type A (YY001) for injection in the treatment of upper limb spasticity in adults
开始日期2024-09-14 |
申办/合作机构 |
NCT06583486
A Multi-center, Open-label Study on the Efficacy and Safety of Repeated Treatments With Recombinant Botulinum Toxin Type A for Injection in the Treatment of Moderate to Severe Glabellar Lines
This is a Multi-center, Open-label Study on the Efficacy and Safety of Multiple Treatments with Recombinant Botulinum Toxin Type A for Injection in the Treatment of Moderate to Severe Glabellar Lines. The study has been designed to evaluate the long-term safety, tolerability, efficacy , maintain time and immunogenicity of multiple treatments with Recombinant Botulinum Toxin Type A for Injection (YY001) in the treatment of moderate to severe glabellar lines.
开始日期2024-03-19 |
申办/合作机构 |
100 项与 重庆誉颜制药有限公司 相关的临床结果
登录后查看更多信息
0 项与 重庆誉颜制药有限公司 相关的专利(医药)
登录后查看更多信息
42
项与 重庆誉颜制药有限公司 相关的新闻(医药)2025-07-30
·药事纵横
在生物创新药的浪潮下,老牌药企(Pharma)正积极拥抱变革,通过自研、并购、合作开发等多种方式,加速在生物创新药领域的布局,拓展其研发管线。其中,与生物技术公司(Biotech)的互动合作成为了一种重要的战略选择。Pharma与Biotech之间,正形成一种优势互补、互利共赢的合作模式。Pharma凭借其深厚的底蕴,提供资金、渠道和市场经验,助力Biotech的创新成果走向市场;Biotech则以其敏锐的洞察力和创新活力,为Pharma的研发管线注入新的活力。这种合作模式,不仅加速了生物创新药的诞生,也为生物医药行业的未来发展指明了方向,预示着一个充满机遇与挑战的新时代。一、医药新格局:老牌药企联手Biotech,共赴创新未来当下,老牌药企与Biotech之间双向奔赴的合作已然成为了医药领域讨论的热点话题!国内老牌药企通常是指成立时间较长、具有一定规模和市场影响力的制药企业,一般成立时间在数十年甚至上百年。由于医药行业竞争激烈,市场需求不断变化,老牌药企只有持续推出新药,才能跟上行业发展步伐,保持企业的市场地位和盈利能力。然而,国内老牌药企在创新药研发方面存在着诸多困境,例如:研发成本与周期压力、创新人才短缺、研发效率低等。近年来,随着医药行业的快速发展,新药研发市场竞争日益激烈。不仅有跨国药企在高端新药领域占据优势,还有众多Biotech公司凭借其创新能力和灵活性在新兴领域迅速崛起。相比较而言,老牌药企的资金、市场渠道、临床经验与商业化能力,可与Biotech的创新研发能力、技术平台形成了完美的互补。因此,老牌药企要想实现产品创新升级,和Biotech的合作也成为了快捷的突破之路。通常情况下,老牌药企和Biotech之间最为典型的合作方式为BD交易,也就是发挥各自的长处,由Biotech负责研发创新、老牌药企则负责市场和商业化,二者形成明确的分工。这种合作模式加速了新药从实验室到市场的转化,有效降低了研发风险。那么,Pharma与Biotech之间具体都有哪些合作呢?二、老牌药企联合明星Biotech,为行业带来惊喜2.1 从单抗到siRNA:华东医药与Biotech合作矩阵再升级华东医药是一家大型综合性医药上市公司,业务覆盖医药全产业链。以下是华东医药与Biotech之间的合作案例。1)华东医药再度联手荃信生物(QX005N):完成全球最大规模结节性痒疹关键性临床试验2024年7月21日,华东医药全资子公司中美华东与荃信生物再度联手,中美华东将深度参与QX005N注射液(重组人源化IL-4Rα单克隆抗体)在授权区域(中国大陆、香港、澳门及台湾地区)内的后续临床开发并承担相关适应症50%的III期临床开发及后续注册费用;同时中美华东获得QX005N注射液在授权区域内的独家市场推广选择权,以及该产品上市许可持有人转让的优先合作权。值得一提的是,2025年3月19日,QX005N注射液针对结节性痒疹的III期临床试验已完成全部409例受试者入组,这是国内首个由中国企业开展的针对该适应症的III期临床试验,也是目前全球范围内最大人群规模的结节性痒疹关键性临床试验。华东医药与荃信生物就QX005N注射液达成合作协议(来源:华东医药股份有限公司)除此之外,此前荃信生物与华东医药共同开发的QX001S(HDM3001)注射液(乌司奴单抗生物类似物)的上市申请已于2023年8月获得NMPA受理,并于2024年11月5日正式获得上市许可申请获得批准,用于治疗成年中重度斑块状银屑病,并成为国内首个获批的乌司奴单抗生物类似物。2)华东医药联合与澳宗生物(TTyp01)的合作:1亿首付款,助力脑卒中及渐冻症治疗新突破2024年7月12日,华东医药全资子公司中美华东与澳宗生物就TTyp01片所有适应症在中国大陆、香港、澳门和台湾地区的开发、注册、生产和商业化达成独家战略合作协议。澳宗生物将获得1亿元人民币的首付款,最高不超过11.85亿元的开发、注册及销售里程碑付款。TTyp01片作为澳宗生物自主开发的改良型新药,是一款依达拉奉口服片剂,急性缺血性脑卒中适应症已完成国内临床Ⅲ期研究。值得注意的是,2024年12月25日, TTYP01片已向美国食品药品监督管理局(FDA)正式递交了新药上市申请(NDA),用于治疗肌萎缩侧索硬化症(ALS,又称渐冻症)。华东医药与澳宗生物就TTyp01片达成合作协议(来源:华东医药股份有限公司)3)华东医药与与艺妙神州的合作(IM19):直击血液肿瘤,上市申请已受理2024年8月4日,华东医药与艺妙神州联合宣布,双方针对靶向CD19的自体CAR-T候选产品IM19嵌合抗原受体T细胞注射液达成在中国大陆地区的商业化合作。艺妙神州将获得1.25亿元人民币首付款,并有权获得最高不超过9.5亿人民币的注册及销售里程碑付款,艺妙神州将继续负责IM19注射液在中国大陆地区的开发、注册和生产,华东医药将获得IM19注射液在中国大陆的独家商业化权益。目前,IM19注射液作为艺妙神州领先的管线产品,正在中国开展弥漫大B细胞淋巴瘤、套细胞淋巴瘤和急性B淋巴细胞白血病三个适应症的临床研究。同时,针对弥漫大B细胞淋巴瘤末线治疗的研究已开展II期临床试验。与此同时,2024年11月28日,IM19的上市申请获国家药品监督管理局(NMPA)药品审评中心(CDE)受理,极有可能于今年获批上市。华东医药与艺妙神州就CD19自体CAR-T产品IM19注射液达成合作协议(来源:华东医药股份有限公司)4)华东医药与圣因生物的合作(siRNA药物):慢性代谢性疾病新希望,LEADTM平台助力开发突破性创新治疗方案2023年11月,华东医药与圣因生物达成战略合作,双方将基于圣因生物专有的小核酸药物LEADTM(Ligandand Enhancer Assisted Delivery)创新技术平台,共同开发针对慢性代谢性疾病的siRNA药物,并进一步探讨在其他治疗领域开发新型siRNA药物的合作机会。值得注意的是,圣因生物首款创新型RNAi药物SGB-3403注射液已经于2023年10月在中国获批临床,SGB-3403注射液是一种靶向肝细胞PCSK9的siRNA-GalNAc结合物,可通过RNAi抑制肝脏PCSK9的合成。此次,华东医药与圣因生物的合作也将有效利用LEADTM开发平台的优势和技术,加速为慢性代谢性疾病患者提供突破性创新治疗方案的进程。华东医药与圣因生物达成战略合作(来源:圣因生物)2.2 从股权投资到商业化运营,华润医药全方位布局Biotech合作版图华润医药是华润集团旗下的一家大型医药企业,涵盖医药研发、生产、销售等多个领域。值得注意的是,在2024中国医药跨境交易License-in交易榜单中,华润医药成功闯入TOP10,以下是华润医药与Biotech之间的一些合作案例。2024中国医药跨境交易License-in交易TOP10(来源:2024中国医药授权许可BD交易年度报告)1)华润医药与因明生物的合作(YY001):新型肉毒素YY001获NMPA受理,助力美丽事业2021年11月13日,华润医药与因明生物在北京签署战略合作协议,合作内容:双方将积极推进因明生物新型肉毒素产品及眼科药物的商业化合作,探索因明生物产品管线的产业化合作,以及推进对因明生物的股权投资合作。其中,2023年11月,华东医药已与因明生物达成合作,获得了YY001在中国大陆、香港、澳门地区医美适应症领域的独家商业化权益,并将负责YY001在中国香港、澳门地区医美适应症领域内的独家临床开发和注册申报。YY001作为一种通过新型的重组蛋白生产途径生产的肉毒毒素,旨在解决从宿主肉毒杆菌提取天然肉毒毒素的生物安全问题,因明生物控股企业重庆誉颜制药对其拥有全球知识产权。值得注意的是,2024年12月31日,YY001用于改善中度至重度眉间纹的上市许可申请获国家药品监督管理局受理。YY001上市许可申请获得国家药品监督管理局正式受理(来源:CDE)2)华润医药与翰宇药业的合作(翰安依替巴肽注射液):开启心脑血管领域新篇章2021年5月20日,华润医药与翰宇药业就“翰安依替巴肽”注射液产品合作协议签约仪式,双方将就该产品的推广销售进行深度合作。依替巴肽作为一种用于急性冠脉综合征PCI围手术期抗血小板治疗的重点产品,通过此次合作,华润医药将在心脑血管领域产品线带来更多的产品;翰宇药业也可以充分借助华润生物在心脑血管领域的优势,快速完成在PCI领域产品管线广度及深度的开发覆盖。值得一提的是,翰安依替巴肽注射液目前已成功获得美国美国食品药品监督管理局(FDA)批准上市,成功完成出海!华润医药与翰宇药业就翰安依替巴肽达成战略合作协议(来源:华润医药)3)与天士力生物医药产业集团的合作(数智本草大模型):中药创新里程碑,构建数智中药研发新范式2024年8月4日,华润医药与天士力医药签署战略合作协议,双方将在中药创新发展、数智本草大模型及滴丸技术与装备开发方面展开合作。华润医药以62亿元控股天士力,这场并购也被视为“传统药企与数字革命的联姻”。双方计划以合资公司为载体,开展全球首个中医药研发多模态大模型“数智本草”的迭代升级,把中医药理论、临床经验与数字科技相结合,构建数智中药研发新范式。值得注意的是,通过与华为云合作开发“数智本草大模型”,天士力医药将AI技术贯穿于靶点发现、分子筛选到组方优化的全流程,使研发效率提升33%,成本降低70%。除此之外,双方还成立滴丸技术创新联合体,推动滴丸技术迭代升级,并把天士力建设成高科技、高质量的滴丸新剂型专业化生产基地,为更多企业提供产业化服务。华润医药与天士力医药达成战略合作协议(来源:医药经济报)2.3 从抗体到细胞治疗:东北制药搭建ADC药物和CAR-T技术平台,剑指未来东北制药集团股份有限公司前身为东北制药总厂,始建于1946年,被称为“民族制药工业的摇篮”,1996年在深圳证券交易所上市。公司拥有化学原料药、化学制剂、医药商业、医药工程、生物医药等主要业务板块,覆盖医药研发、制造、分销全产业链条。以下是东北制药与Biotech之间的一些合作案例。1)东北制药与MedAbome合作(MAB11-22.1抗体):打造ADC药物和CAR-T细胞治疗技术平台2022年东北制药提出筛选引进创新药,助力创新转型计划。此后,2022年9月东北制药与美国MedAbome公司签署《mab11-22.1抗体项目转让、合作开发及技术服务协议》。MedAbome向东北制药转让MAB11-22.1抗体项目和技术,并基于该抗体双方进行ADC药物和CAR-T细胞治疗产品的合作开发。MAb11-22.1作为MedAbome公司研发的可选择性识别恶性肿瘤细胞、而不与正常外周血细胞和主要脏器组织反应的单克隆抗体。该抗体在抗体偶联药物(ADC药物)和CAR-T上的应用目前处于临床前研发阶段。目前,已经完成的体外和体内抑瘤生长实验和小动物初步毒理学实验结果展现出较好的疗效和安全性。除此之外,MedAbome公司已就MAb11-22.1抗体开发的技术成果申请了美国专利和PCT专利。东北制药引进MAb11-22.1抗体项目(来源:东北制药)此次合作,MedAbome主要负责申报美国、加拿大、墨西哥三个国家以外的临床试验(IND)证书和新药上市(NDA)证书,同时帮助和指导东北制药设计、建设ADC药物平台和CAR-T细胞治疗技术平台,包括研发、中试、生产及质量控制平台等。同时,东北制药将按照项目进度向MedAbome支付协议项下费用,包括首付款600万美元及600万元人民币,后续达成条件后的700万美元及700万元人民币里程碑付款,以及项目新药的净销售额提成费。2)收购国产Biotech鼎成肽源:1.87亿收购70%股权,快速切入细胞免疫治疗领域2024年,东北制药为优化自身业务结构,快速切入特异性细胞免疫治疗的技术研究、产品开发和临床应用,培育新的业务和盈利增长点,拟收购鼎成肽源70%的股权,作价1.87亿元。鼎成肽源成立于2014年,主要从事细胞治疗,其自主搭建的TCR技术平台,围绕如何正确选定靶点、精准靶向、系统评价以及释放T细胞的潜力建立了6大子平台,从靶点发现、序列发现、序列评价、工艺开发、功能增强到TCR蛋白药平台形成闭环。TCR-T(T cell receptor T)则是一种基于人体T细胞的免疫治疗技术,使用从癌症患者中获取的T细胞,通过转入能特异性识别肿瘤抗原的TCR基因,使T细胞具备识别和攻击肿瘤细胞的能力,经过体外培养最终回输到患者体内以治疗癌症。值得注意的是,2024年8月8日,根据CDE官网显示,鼎成肽源DCTY1102注射液获得国家药监局临床试验默示许可。DCTY1102注射液为国际上首款靶向HLA-A*11:01基因型、KRAS G12D突变的TCR-T细胞治疗产品,适应症为晚期胰腺癌、结直肠癌等恶性实体肿瘤。东北制药收购鼎成肽源(来源:东北制药)2.4 从收购到整合:绿叶制药布局多研发中心和管线,构建生物药领域核心竞争力绿叶制药是一家致力于创新药物的研发、生产和销售的国际化制药公司。公司在中国、美国和欧洲设有研发中心,在微球、脂质体、透皮释药等先进药物递送技术领域达到国际先进水平,并在新分子实体、生物抗体领域收获多项创新成果。以下是绿叶制药与Biotech之间的一些合作案例。1)布局多研发中心和管线:14.47亿收购博安生物,强势布局生物药领域2019年12月1日,绿叶制药集团宣布收购山东博安生物技术有限公司98%股权,交易总价为14.47亿人民币。博安生物拥有涵盖不同研发阶段的强大的在研产品线,包括生物类似药和创新药。生物类似药如LY01008(Avastin生物类似药)、ly06006(Prolia生物类似药)等,创新药如TS1804(4-1BB抗体)、ts1901(Claudin18.2抗体)等。另一方面,在成为绿叶制药的子公司后,博安生物获得了更强大的资源支持和更广阔的市场渠道,有利于其进一步发展和壮大。此次,绿叶制药获得了博安生物的所有在研产品,进一步扩充了其生物药的研发管线,打造了未来在生物药领域强大的产品线组合。除此之外,绿叶制药在中国、美国和欧洲设有研发中心,具有900以上研发人员;并不断丰富的在研产品线,其中国有超过30个,海外超过10个管线。博安生物产品管线(来源:博安生物)2)绿叶制药与欧康维视合作(LY09004):临床数据亮眼,OT-702打造眼科药物新标杆2020年10月,绿叶制药与欧康维视达成合作及推广协议,双方共同加速推进抗VEGF药物阿柏西普生物类似药OT-702(LY09004)的研发及上市。OT-702为重组人血管内皮生长因子受体-抗体融合蛋白眼用注射液,是Eylea(阿柏西普)的生物类似药,适用于治疗新生WAMD、视网膜静脉阻塞(RVO)后黄斑水肿、糖尿病性黄斑水肿(DME)及糖尿病性视网膜病变(DR)的患者。值得注意的是,OT-702的I期临床试验结果显示,具有良好的安全性及耐受性,且未发生严重不良反应。此外,OT-702也在中国完成Ⅲ期临床试验,试验组与原研参照药组在4周至24周时“眼最佳矫正视力”(BCVA)均较基线显示出具有临床意义的显著改善(采用ETDRS视力表),疗效高度可比、起效迅速并持久,达到了所有研究终点。与此同时,2024年7月16日,欧康维视也宣布抗VEGF药物OT-702(阿柏西普眼内注射溶液)上市申请已获CDE正式受理。绿叶制药与欧康维视携手推进OT-702(阿柏西普生物类似药)研发及商业化(来源:欧康维视)三、老牌药企遇上Biotech:医药创新“联姻”热潮涌动,携手开创新篇国内老牌药企与Biotech公司在新药研发领域的合作,正日益成为推动医药行业创新发展的重要引擎。双方通过优势互补、风险共担、注重知识产权保护以及广泛合作领域等方式,取得了显著的进展,展现出强大的生命力和广阔的前景。然而,挑战依然存在,例如:企业文化差异与管理协同、利益分配与风险控制的平衡、创新成果的产业化落地等多个方面。展望未来,国内老牌药企与Biotech的合作需要进一步深化和拓展。首先,应加强战略协同,从项目合作走向更深层次的战略合作,共同制定长期发展规划,实现资源共享、平台共建。其次,需要建立更加高效的合作机制,简化决策流程,提高合作效率,加速创新药物的研发进程。再次,应积极探索多元化的合作模式,除了传统的BD交易和联合开发,还可以探索风险投资、战略联盟等多种合作方式,以适应不同阶段、不同类型的项目需求。总而言之,国内老牌药企与Biotech的合作是医药行业创新发展的重要趋势,双方秉持互利共赢的原则,有利于提高创新药的研发效率以及市场开拓,同时也并将为患者带来更多创新药物,推动我国医药产业迈向新的高度!参考资料:[1] 各公司财报、公告、官网[2] 《2024中国医药授权许可BD交易年度报告》[3] 国家药品监督管理局药品审评中心, https://www.cde.org.cn/作者介绍:Ketty,主要从事药物研发和科普,制药行业政策和发展研究工作。药事纵横投稿须知:稿费已上调,欢迎投稿
并购siRNA
2025-01-05
·信狐药迅
本周药品注册受理数据,分门别类呈现,一目了然。(12.30-1.5)
新药上市申请药品名称企业注册分类受理号苯扎溴铵无菌溶液广东迈恒医药研发有限公司2.2CXHS2500002苯扎溴铵无菌溶液广东迈恒医药研发有限公司2.2CXHS2500001赛沃替尼片和记黄埔医药(上海)有限公司2.4CXHS2400134赛沃替尼片和记黄埔医药(上海)有限公司2.4CXHS2400133注射用重组A型肉毒毒素重庆誉颜制药有限公司2.4CXSS2400144
新药临床申请药品名称企业注册分类受理号KR230109乳膏江西科睿药业有限公司1CXHL2500002KR230109乳膏江西科睿药业有限公司1CXHL2500001RDc001片河南省锐达医药科技有限公司1CXHL2401511RDc001片河南省锐达医药科技有限公司1CXHL2401510RDc001片河南省锐达医药科技有限公司1CXHL2401509HS-10380片江苏豪森药业集团有限公司1CXHL2401508K-13片上海懿峰生物科技有限公司1CXHL2401507K-13片上海懿峰生物科技有限公司1CXHL2401506K-13片上海懿峰生物科技有限公司1CXHL2401505RAG-1C眼内注射液中美瑞康核酸技术(南通)研究院有限公司1CXHL2401504RAG-1C眼内注射液中美瑞康核酸技术(南通)研究院有限公司1CXHL2401503RAG-1C眼内注射液中美瑞康核酸技术(南通)研究院有限公司1CXHL2401502IMP1734片上海瑛派药业有限公司1CXHL2401501IMP1734片上海瑛派药业有限公司1CXHL2401500XH-S003胶囊浙江星浩澎博医药有限公司1CXHL2401498XH-S003胶囊浙江星浩澎博医药有限公司1CXHL2401497PTT-936口服冻干粉北京炎明生物科技有限公司1CXHL2401499SRSD216注射液靖因药业(上海)有限公司1CXHL2401496IN10018片应世生物科技(上海)有限公司1CXHL2401495IN10018片应世生物科技(上海)有限公司1CXHL2401494EP-0186片成都苑东生物制药股份有限公司1CXHL2401493EP-0186片成都苑东生物制药股份有限公司1CXHL2401492CVL237片甫康(上海)健康科技有限责任公司1CXHL2401491JC005北京佳诚生物医药科技开发有限公司2.2CXHL2500007柔红霉素注射液清远五岳生物医药有限公司2.2CXHL2500004BN170614山东百诺医药股份有限公司2.2CXHL2500003BCM882胶囊上海云晟研新生物科技有限公司2.3CXHL2500006BCM882胶囊上海云晟研新生物科技有限公司2.3CXHL2500005冻干带状疱疹mRNA疫苗苏州艾博生物科技有限公司1.2CXSL2500003冻干带状疱疹mRNA疫苗苏州艾博生物科技有限公司1.2CXSL2500002冻干带状疱疹mRNA疫苗苏州艾博生物科技有限公司1.2CXSL2500001重组呼吸道合胞病毒疫苗(CHO细胞)北京吉诺卫生物科技有限公司1.2CXSL2400931三价流感病毒裂解疫苗(ZFA02佐剂)安徽智飞龙科马生物制药有限公司1.3CXSL2500007HLX79 注射液上海复宏汉霖生物技术股份有限公司1CXSL2500008注射用TQB2101正大天晴药业集团南京顺欣制药有限公司1CXSL2500004注射用SSS59沈阳三生制药有限责任公司1CXSL2500006VUM03注射液武汉光谷中源药业有限公司1CXSL2400934IBI363信达生物制药(苏州)有限公司1CXSL2400935DNTH103注射液元羿生物科技(上海)有限公司1CXSL2400933IBI363信达生物制药(苏州)有限公司1CXSL2400936GFS202A注射液劲方医药科技(上海)股份有限公司1CXSL2400937注射用GQ1005启德医药科技(苏州)有限公司1CXSL2400932PM8002注射液普米斯生物技术(珠海)有限公司1CXSL2400930BNT323映恩生物制药(苏州)有限公司1CXSL2400929ZMPB-NK006注射液河北美欧赛奥金生物科技有限公司1CXSL2400928GO306重组溶瘤痘苗病毒注射液上海锦斯生物技术有限公司1CXSL2400927重组人源化抗表皮生长因子受体单抗注射液上海津曼特生物科技有限公司1CXSL2400926人胎盘来源3D间充质干细胞注射液国健清科生物医药科技(北京)有限责任公司1CXSL2400925注射用DM002思道医药科技(苏州)有限公司1CXSL2400924注射用JS207上海君实生物医药科技股份有限公司1CXSL2400923注射用重组人血小板生成素沈阳三生制药有限责任公司2.1CXSL2500005ZYY-742凝胶扬子江药业集团江苏龙凤堂中药有限公司1.1CXZL2500001金桔余甘含片盈科瑞(天津)创新医药研究有限公司1.1CXZL2400101玉屏风袋泡茶广州白云山陈李济药厂有限公司2.3CXZL2400100
仿制药申请药品名称企业注册分类受理号贝那普利氢氯噻嗪片安徽佳和药业有限公司3CYHS2500058门冬氨酸钾镁注射液海南慧通生物医药科技有限公司3CYHS2500049氯化钙注射液江西亿友药业有限公司3CYHS2500046己酮可可碱缓释片江苏和晨药业有限公司3CYHS2500044骨化三醇口服溶液河南泰丰生物科技有限公司3CYHS2500040注射用吲哚菁绿天津天士力之骄药业有限公司3CYHS2500039复方聚乙二醇(3350)电解质口服溶液河北智恒医药科技股份有限公司3CYHS2500009重酒石酸间羟胺注射液浙江华海药业股份有限公司3CYHS2500007门冬氨酸钾注射液北京新美泰克医药科技有限公司3CYHS2500006硫酸阿托品滴眼液兆科(广州)眼科药物有限公司3CYHS2500031复方葡萄糖/电解质颅脑手术冲洗液华润双鹤药业股份有限公司3CYHS2500030乳酸钠林格冲洗液海南爱科制药有限公司3CYHS2500027复方聚乙二醇(3350)电解质口服溶液远大医药(中国)有限公司3CYHS2500026福多司坦口服溶液温岭市创新生物医药科技股份有限公司3CYHS2500024福多司坦口服溶液温岭市创新生物医药科技股份有限公司3CYHS2500023阿瑞匹坦注射液扬子江药业集团有限公司3CYHS2500016艾司奥美拉唑镁肠溶胶囊常州制药厂有限公司3CYHS2500037艾司奥美拉唑镁肠溶胶囊常州制药厂有限公司3CYHS2500036硫酸沙丁胺醇口服溶液江苏润恒制药有限公司3CYHS2404663甲硝唑阴道凝胶海南元盈医药科技有限公司3CYHS2404662布洛芬软胶囊人福普克药业(海南)有限公司3CYHS2404651氢溴酸加兰他敏口腔崩解片北京星昊医药股份有限公司3CYHS2404649氢溴酸加兰他敏口腔崩解片北京星昊医药股份有限公司3CYHS2404648米诺地尔搽剂重庆康刻尔制药股份有限公司3CYHS2404653米诺地尔搽剂重庆康刻尔制药股份有限公司3CYHS2404652草酸艾司西酞普兰口服溶液海南斯达制药有限公司3CYHS2404639氨甲环酸氯化钠注射液南京海鲸药业股份有限公司3CYHS2404636对乙酰氨基酚布洛芬片南京海纳制药有限公司3CYHS2404631注射用雷替曲塞吉斯美(武汉)制药有限公司3CYHS2404628琥珀酸亚铁片河北龙海药业有限公司3CYHS2404621吡格列酮二甲双胍片(15mg/500mg)安徽杰玺医药有限公司3CYHS2404618奥卡西平片杭州和康药业有限公司4CYHS2500064奥卡西平片杭州和康药业有限公司4CYHS2500063阿司匹林肠溶片山西复盛公大药厂有限公司4CYHS2500062他氟前列素滴眼液国药集团三益药业(芜湖)有限公司4CYHS2500061头孢丙烯片广东恒健制药有限公司4CYHS2500060艾拉莫德片金鸿药业股份有限公司4CYHS2500059利丙双卡因乳膏浙江普利药业有限公司4CYHS2500057利丙双卡因乳膏浙江普利药业有限公司4CYHS2500056米库氯铵注射液广州合和医药有限公司4CYHS2500055米库氯铵注射液广州合和医药有限公司4CYHS2500054丁酸氢化可的松乳膏江苏知原药业股份有限公司4CYHS2500053注射用达托霉素丽珠集团丽珠制药厂4CYHS2500052甲苯磺酸艾多沙班片浙江华海药业股份有限公司4CYHS2500051甲苯磺酸艾多沙班片浙江华海药业股份有限公司4CYHS2500050瑞舒伐他汀依折麦布片(I)常州制药厂有限公司4CYHS2500048艾普拉唑肠溶片重庆圣华曦药业股份有限公司4CYHS2500047铝碳酸镁咀嚼片重庆药友制药有限责任公司4CYHS2500045地屈孕酮片嘉亨(珠海横琴)医药科技有限公司4CYHS2500043溴芬酸钠滴眼液苏州欧康维视生物科技有限公司4CYHS2500042米库氯铵注射液江西银涛药业股份有限公司4CYHS2500041麦考酚钠肠溶片广州迈凯安生物医药研究院有限公司4CYHS2500022盐酸特比萘芬喷雾剂华东医药(西安)博华制药有限公司4CYHS2500011富马酸伏诺拉生片哈药集团制药六厂4CYHS2500010利丙双卡因乳膏苏州高迈药业有限公司4CYHS2500008他克莫司软膏上海现代制药股份有限公司4CYHS2500005他克莫司软膏上海现代制药股份有限公司4CYHS2500004戊酸雌二醇片武汉九珑人福药业有限责任公司4CYHS2500034苯磺酸左氨氯地平片河北山姆士药业有限公司4CYHS2500033苯磺酸左氨氯地平片河北山姆士药业有限公司4CYHS2500032诺西那生钠注射液齐鲁制药有限公司4CYHS2500029氧延安同辉实业有限公司4CYHS2500028夫西地酸乳膏东阳祥昇医药科技有限公司4CYHS2500025他达拉非片浙江百代医药科技有限公司4CYHS2500021他达拉非片浙江百代医药科技有限公司4CYHS2500020他达拉非片浙江百代医药科技有限公司4CYHS2500019他克莫司软膏江苏鹏鹞药业有限公司4CYHS2500018他克莫司软膏江苏鹏鹞药业有限公司4CYHS2500017富马酸伏诺拉生片浙江诺得药业有限公司4CYHS2500015富马酸伏诺拉生片浙江诺得药业有限公司4CYHS2500014硫酸氨基葡萄糖胶囊陕西新沣华生物科技有限公司4CYHS2500013盐酸特比萘芬喷雾剂华东医药(西安)博华制药有限公司4CYHS2500012乳果糖口服溶液山东辰欣佛都药业股份有限公司4CYHS2500038盐酸托莫西汀胶囊西南药业股份有限公司4CYHS2500035普拉洛芬滴眼液海南回元堂药业有限公司4CYHS2500003左乙拉西坦注射用浓溶液温岭市创新生物医药科技股份有限公司4CYHS2500002ω-3脂肪酸乙酯90软胶囊海南全星制药有限公司4CYHS2500001蒙脱石散江西泰吉立生物医药科技有限公司4CYHS2404668艾拉莫德片浙江华海药业股份有限公司4CYHS2404667氟伐他汀钠缓释片浙江华海药业股份有限公司4CYHS2404664非奈利酮片杭州康恩贝制药有限公司4CYHS2404661帕拉米韦氯化钠注射液四川健林药业有限责任公司4CYHS2404659克立硼罗软膏湖北民康药业集团有限公司4CYHS2404658克立硼罗软膏湖北民康药业集团有限公司4CYHS2404657地夸磷索钠滴眼液国源国药(广东)制药集团有限公司4CYHS2404655地夸磷索钠滴眼液国源国药(广东)制药集团有限公司4CYHS2404654枸橼酸西地那非口腔崩解片上海桓华制药有限公司4CYHS2404656富马酸伏诺拉生片地奥集团成都药业股份有限公司4CYHS2404666富马酸伏诺拉生片地奥集团成都药业股份有限公司4CYHS2404665富马酸福莫特罗吸入溶液四川美大康华康药业有限公司4CYHS2404660夫西地酸乳膏河北新张药股份有限公司4CYHS2404650盐酸达泊西汀片江西施美药业股份有限公司4CYHS2404625盐酸达泊西汀片江西施美药业股份有限公司4CYHS2404624双醋瑞因胶囊苏州中化药品工业有限公司4CYHS2404644蛋白琥珀酸铁口服溶液南京同仁堂黄山精制药业有限公司4CYHS2404619马立巴韦片江苏奥赛康药业有限公司4CYHS2404646棕榈酸帕利哌酮注射液浙江圣兆药物科技股份有限公司4CYHS2404643棕榈酸帕利哌酮注射液浙江圣兆药物科技股份有限公司4CYHS2404642棕榈酸帕利哌酮注射液浙江圣兆药物科技股份有限公司4CYHS2404641氨甲环酸片成都倍特药业股份有限公司4CYHS2404640利多卡因凝胶贴膏湖北民康药业集团有限公司4CYHS2404638伊布替尼胶囊广州科锐特药业有限公司4CYHS2404637甲磺酸沙非胺片杭州康恩贝制药有限公司4CYHS2404635甲磺酸沙非胺片杭州康恩贝制药有限公司4CYHS2404634阿瑞匹坦胶囊山东鲁抗医药股份有限公司4CYHS2404633阿瑞匹坦胶囊山东鲁抗医药股份有限公司4CYHS2404632注射用硫酸艾沙康唑海南倍特药业有限公司4CYHS2404630苹果酸奈诺沙星氯化钠注射液辽宁民康制药有限公司4CYHS2404629达格列净片辽宁鑫善源药业有限公司4CYHS2404626骨化三醇软胶囊大连美创药业有限公司4CYHS2404623达格列净片辽宁鑫善源药业有限公司4CYHS2404627阿戈美拉汀片重庆赛维药业有限公司4CYHS2404647富马酸福莫特罗吸入溶液海南葫芦娃药业集团股份有限公司4CYHS2404622多替拉韦钠片石家庄龙泽制药股份有限公司4CYHS2404620硫酸氨基葡萄糖胶囊西洲医药科技(浙江)有限公司4CYHS2404645注射用头孢他啶阿维巴坦钠海南广升誉制药有限公司4CYHS2404617注射用头孢他啶阿维巴坦钠海南广升誉制药有限公司4CYHS2404616注射用奥马珠单抗远大蜀阳生命科学(成都)有限公司3.3CXSS2400143托吡司特片河北华晨药业集团有限公司3CYHL2500005托吡司特片河北华晨药业集团有限公司3CYHL2500004托吡司特片河北华晨药业集团有限公司3CYHL2500003甘露醇山梨醇注射液海南如康生物科技有限公司3CYHL2500002达普司他片山东百诺医药股份有限公司3CYHL2400287达普司他片山东百诺医药股份有限公司3CYHL2400286注射用盐酸兰地洛尔天津红日药业股份有限公司3CYHL2400285氟比洛芬凝胶贴膏华润三九医药股份有限公司4CYHL2500001羟乙基淀粉130/0.4电解质注射液山东齐都药业有限公司4CYHL2400284羟乙基淀粉130/0.4电解质注射液山东齐都药业有限公司4CYHL2400283洛索洛芬钠贴剂前沿生物药业(南京)股份有限公司4CYHL2400282
进口申请药品名称企业注册分类受理号Rilzabrutinib片Genzyme Corporation1JXHS2400121地非法林注射液Vifor Fresenius Medical Care Renal Pharma Ltd.5.1JXHS2400124马昔腾坦他达拉非片Janssen-Cilag International NV5.1JXHS2400123马昔腾坦他达拉非片Janssen-Cilag International NV5.1JXHS2400122硫酸艾沙康唑胶囊Basilea Pharmaceutica Deutschland GmbH5.1JXHS2400120德莫奇单抗注射液GlaxoSmithKline Trading Services Limited1JXSS2500002德莫奇单抗注射液GlaxoSmithKline Trading Services Limited1JXSS2500001德莫奇单抗注射液GlaxoSmithKline Trading Services Limited1JXSS2400114德莫奇单抗注射液GlaxoSmithKline Trading Services Limited1JXSS2400113STX-241片Pierre Fabre Médicament1JXHL2500003STX-241片Pierre Fabre Médicament1JXHL2500002STX-241片Pierre Fabre Médicament1JXHL2500001放射性药物镓[68Ga]oxodotreotide注射液配制用药盒Novartis Pharma AG2.4JXHL2400308镥[177Lu]oxodotreotide注射液Novartis Pharma AG2.4JXHL2400307VG901注射液ViGeneron GmbH1JXSL2500003ABBV-400注射用粉末AbbVie Inc.1JXSL2500002注射用BudigalimabAbbVie Inc.1JXSL2500001注射用sotaterceptMerck Sharp & Dohme LLC3.1JXSL2400258注射用sotaterceptMerck Sharp & Dohme LLC3.1JXSL2400257
中药相关申请药品名称企业注册分类受理号大建中膏华润三九(雅安)药业有限公司3.1CXZS2400041
注:绿色字体部分为潜在首仿品种;
不包含原料药、医用氧、注射用水、氯化钠或葡萄糖注射液等申请,不包含再注册、一次性进口、技术转移、复审申请。
申请上市临床申请
2025-01-05
·药筛
统计每周新药申报、上市申请(12.30-1.5)
1、新药上市申请获批药品名称企业名称分类受理号甲磺酸奥希替尼片AstraZeneca AB2.4JXHS2400041甲磺酸奥希替尼片AstraZeneca AB2.4JXHS2400042司美格鲁肽注射液杭州九源基因工程股份有限公司3.3CXSS2400033司美格鲁肽注射液杭州九源基因工程股份有限公司3.3CXSS2400035己二酸他雷替尼胶囊葆元生物医药科技(杭州)有限公司;凯莱英生命科学技术(天津)有限公司1CXHS2400020美泊利珠单抗注射液GlaxoSmithKline Trading Services Limited3.1JXSS2400010美泊利珠单抗注射液GlaxoSmithKline Trading Services Limited3.1JXSS2400009奥拉帕利片AstraZeneca AB5.1JXHS2400003奥拉帕利片AstraZeneca AB5.1JXHS2400004来那帕韦注射液Gilead Sciences Ireland UC5.1JXHS2300090来那帕韦片Gilead Sciences Ireland UC5.1JXHS2300088注射用佐妥昔单抗Astellas Pharma Europe B.V1JXSS2300066塔戈利单抗注射液四川科伦博泰生物医药股份有限公司1CXSS2101052
注:灰色字体部分受理号结论为不批准。
2、新药上市申请受理药品名称企业名称分类受理号Rilzabrutinib片Genzyme Corporation;Sanofi S.r.l.1JXHS2400121醋酸地非法林注射液Vifor Fresenius Medical Care Renal Pharma Ltd5.1JXHS2400124大建中膏华润三九(雅安)药业有限公司3.1CXZS2400041德莫奇单抗注射液GlaxoSmithKline Trading Services Limited1JXSS2400114德莫奇单抗注射液GlaxoSmithKline Trading Services Limited1JXSS2400113硫酸艾沙康唑胶囊Basilea Pharmaceutica Deutschland GmbH5.1JXHS2400120马昔腾坦他达拉非片Janssen-Cilag International NV5.1JXHS2400123马昔腾坦他达拉非片Janssen-Cilag International NV5.1JXHS2400122赛沃替尼片和记黄埔医药(上海)有限公司;上海合全医药有限公司2.4CXHS2400133赛沃替尼片和记黄埔医药(上海)有限公司;上海合全医药有限公司2.4CXHS2400134注射用奥马珠单抗远大蜀阳生命科学(成都)有限公司;澳斯康生物(南通)股份有限公司3.3CXSS2400143注射用重组A型肉毒毒素重庆誉颜制药有限公司2.4CXSS2400144
数据来源:摩熵医药
用摩熵药筛小程序,随时随地查周报
申请上市
100 项与 重庆誉颜制药有限公司 相关的药物交易
登录后查看更多信息
100 项与 重庆誉颜制药有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年11月07日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
临床2期
1
1
申请上市
登录后查看更多信息
当前项目
| 药物(靶点) | 适应症 | 全球最高研发状态 |
|---|---|---|
YY003 ( SNAP25 ) | 眉间纹 更多 | 临床2期 |
重组A型肉毒毒素(因明生物) ( SNAP25 ) | 上肢痉挛 更多 | 临床2期 |
登录后查看更多信息
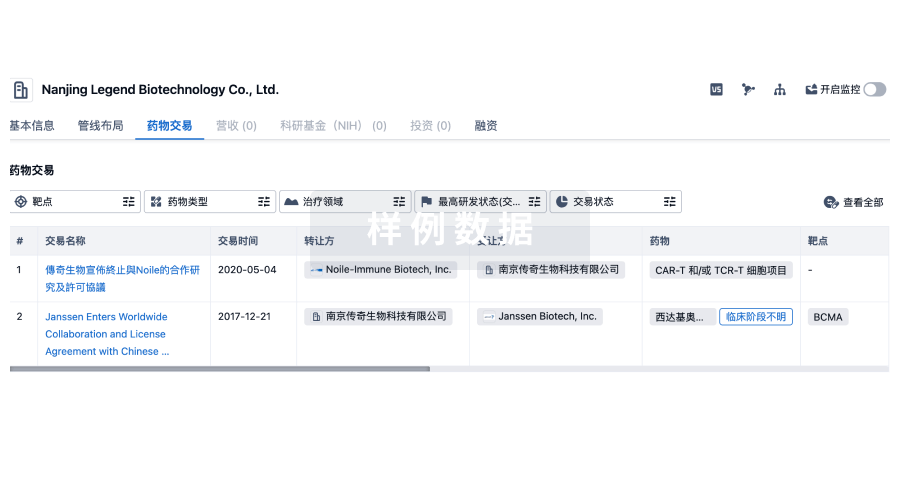
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
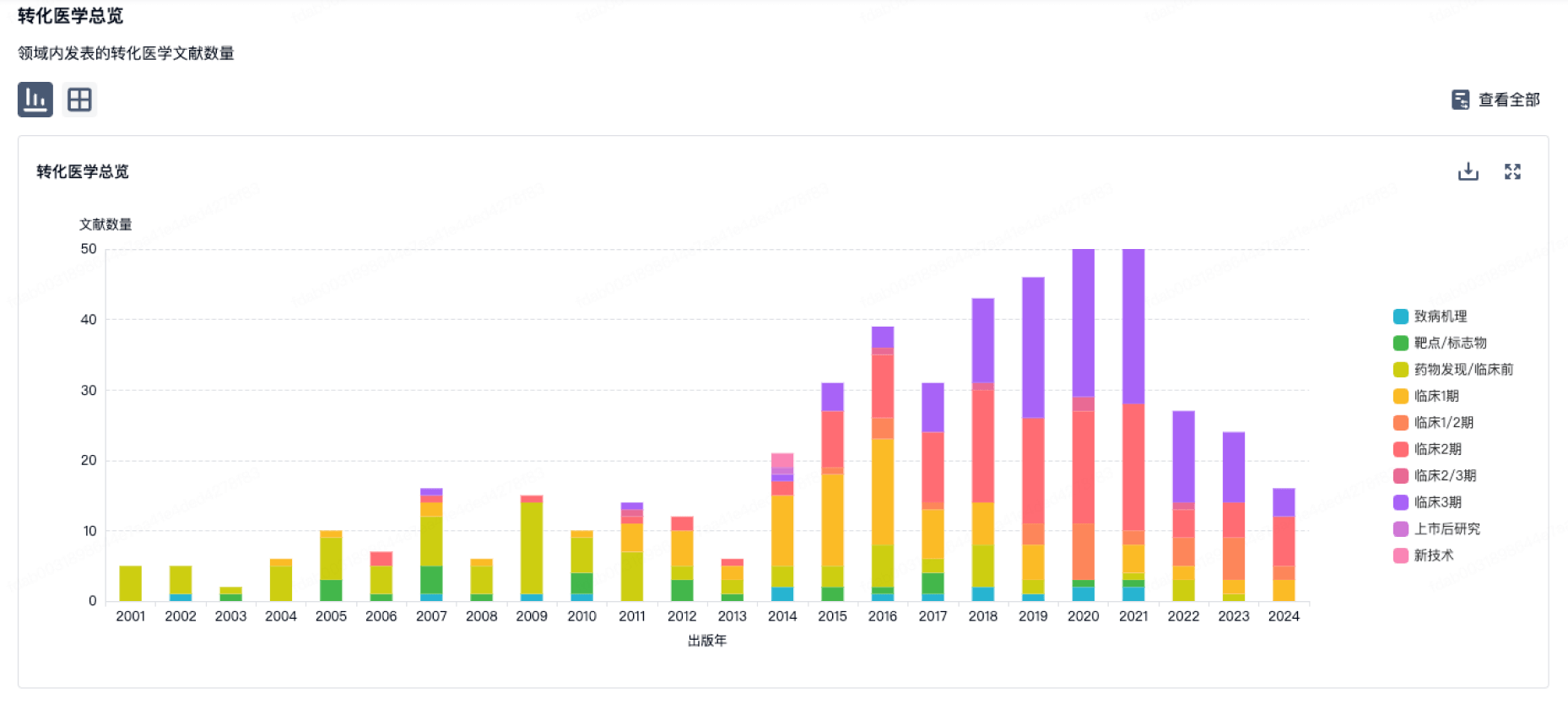
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
