预约演示
更新于:2025-04-13

Smith & Nephew Medical (Shanghai) Ltd.
更新于:2025-04-13
概览
关联
4
项与 施乐辉医用产品国际贸易(上海)有限公司 相关的临床试验NCT04865146
A Multicenter, Post Market, Clinical Follow-Up Study to Evaluate the Safety and Effectiveness of TRIGEN™ INTERTAN™ Intertrochanteric Antegrade Nails (10S Models) for the Treatment of Femoral Fracture in Chinese Subjects
This is a post-market study to evaluate the revision rate of femoral fractures, treated with INTERTAN 10S Nails at one-year post-operation. The study will enroll Approximately 180 subjects with femoral fractures, Approximately 7 sites are involved. The study duration will be Approximately 36 months (6 months start-up, 1 year enrollment, 1 year follow-up, 6 months closeout/study report).
开始日期2022-06-23 |
申办/合作机构 |
NCT04941729
A Prospective, Multi-center, Randomized, Controlled Study to Evaluate the Safety and Efficacy of the OR3O™ Dual Mobility System Versus Conventional Single Bearing Design Total Hip System in Primary Total Hip Arthroplasty (THA) Procedures.
The purpose of this study is to compare OR3O™ Dual Mobility System to a conventional, single-bearing design Total Hip System in subjects who undergo Primary THA. Data collected in this study will be used to support National Medical Products Administration (NMPA) regulatory approval of OR3O™ Dual Mobility System in China as well as to support and maintain product registration in global markets.
Primary Objective: Assess safety and efficacy of the OR3O™ Dual Mobility System in Primary THA at 1 year postoperative.
Secondary Objective(s): Assess safety and efficacy of the OR3O™ Dual Mobility System and compatible components in Primary THA up to 2 years after surgery.
Other Objective(s): Assess the hip dislocation and hospital readmission up to 2 years after device implantation.
4 study sites in China.
Primary Objective: Assess safety and efficacy of the OR3O™ Dual Mobility System in Primary THA at 1 year postoperative.
Secondary Objective(s): Assess safety and efficacy of the OR3O™ Dual Mobility System and compatible components in Primary THA up to 2 years after surgery.
Other Objective(s): Assess the hip dislocation and hospital readmission up to 2 years after device implantation.
4 study sites in China.
开始日期2021-06-23 |
申办/合作机构 |
NCT02139345
A Prospective, Randomized, Multicenter Clinical Study to Compare the Safety and Efficacy of TC-A PS Total Knee System With TC-PLUS Solution PS Total Knee System in Chinese Subjects
This is a prospective, randomized, multicenter clinical study to compare the safety and efficacy of TC-A PS total knee system with TC-PLUS Solution PS total knee system in Chinese subjects.
开始日期2014-09-23 |
申办/合作机构 |
100 项与 施乐辉医用产品国际贸易(上海)有限公司 相关的临床结果
登录后查看更多信息
0 项与 施乐辉医用产品国际贸易(上海)有限公司 相关的专利(医药)
登录后查看更多信息
17
项与 施乐辉医用产品国际贸易(上海)有限公司 相关的新闻(医药)2024-10-17
施乐辉医用产品国际贸易(上海)有限公司报告,由于产品包装问题,生产商美国施乐辉有限公司Smith & Nephew, Inc. 对其生产的全膝关节系统-锆铌合金股骨髁Total Knee System-Oxinium femoral implant(国械注进20153132542)主动召回。召回级别为二级召回。本次召回涉及的产品未进口至中国,具体型号、规格及批次等详细信息见《医疗器械召回事件报告表》。 附件:医疗器械召回事件报告表2024年10月17日施乐辉医用产品国际贸易(上海)有限公司召回报表.pdf
2023-09-13
·医药地理
随着全球“大卫生”、“大健康”产业快速发展,医学服务模式从“疾病医学服务”向“疾病+健康医学服务”转变;构建面向全人群全方位、全生命周期的创新医疗器械发展体系成为全球医疗科技热点,“创新链、产业链、服务链”快速调整变化,我国医疗器械发展面临重要机遇,迎来快速发展的时期。 在此背景下,2023年9月9日-11日,由中国医药集团有限公司、中国医学装备协会指导,国药控股股份有限公司、国药集团中国医疗器械有限公司联合主办,郑州市商务局协办,国药集团上海数智博医疗器械科技有限公司承办的“聚力同行·赋能共赢——2023中国医疗器械产业峰会暨国药器械生态大会”在河南郑州成功举办。峰会期间,主办方共设置了8场精彩纷呈的分论坛,分别是:“医疗器械设备全产业链生态建设论坛”、“体外诊断产业发展战略论坛”、“医用耗材行业生态发展论坛”、“医工服务新生态论坛”、“医疗器械数智化供应链论坛”、“医疗器械工业创新发展论坛”、“生物医药与医疗器械新基建论坛”、“医疗器械热点政策与产业创新论坛”。在各个分论坛上,与会的专家、领导、学者、企业高管等围绕最热门行业话题、最前瞻的政策趋势和最前沿的技术水平,对行业发展方向进行了卓有成效的探讨。医疗器械设备全产业链生态建设论坛“医疗器械设备全产业链生态建设论坛”由国药集团中国医疗器械有限公司南区事业部承办。论坛以“交叉融合、协同发展,集采背景下医疗设备产业生态”为主题,中国科学院院士、海南大学校长骆清铭教授,工业和信息化部产业发展促进中心领导参会。国药集团中国医疗器械有限公司党委副书记郭勇为论坛致辞。国药集团中国医疗器械有限公司总经理助理、南区事业部副总经理鲁保才,《中国医疗设备》杂志社社长金东,通用电气医疗中国区副总裁、医疗影像业务总经理陈金雷,西门子医疗系统有限公司大中华区副总裁、销售运营及渠道管理负责人余俊萍,飞利浦(中国)投资有限公司大中华区、集团客户及放射肿瘤业务总经理张赟,武汉联影智融医疗科技有限公司副总裁栾承鹏,理诺珐(中国)医疗科技有限公司中国区总裁陆挽澜,开立医疗董事长陈志强,丹纳赫中国诊断平台集团总经理、徕卡生物系统中国区总经理方国洪,北京天智航医疗科技股份有限公司董事长张送根,上海微创医疗机器人(集团)股份有限公司常务副总裁兼首席商务官刘雨等业内知名企业负责人受邀出席并作了主题演讲,围绕“如何帮助上下游企业转变传统商业模式”、“如何实现精益化、协同化、智慧化发展”等行业热点话题进行了深刻的研讨。体外诊断产业发展战略论坛“体外诊断产业发展战略论坛”由国药集团中国医疗器械有限公司北区事业部承办。论坛以“政策驱动变革,共同构建体外诊断行业新生态”为主题,来自行业协会、政府部门、业内知名企业以及国药控股、国药器械的500余名专家和来宾出席论坛。全国卫生产业企业管理协会副会长、医学检验产业分会会长宋海波,雅培核心诊断市场负责人倪新颜,迈瑞医疗IT互联业务总监代巍巍,国药基因科技副总经理王磊受邀作主题演讲。九强生物董事长邹左军、安图生物总经理杨增利、美康生物总经理邹继华、上海捷诺副总经理于士文、雅培核心诊断全国市场准入总监朱慧丽、贝克曼库尔特全国市场负责人吴俊、碧迪医疗生物科学临床销售与市场总监廖庆、西门子医疗床旁诊断系统大中华区负责人李汉、迈瑞医疗IVD渠道总经理孙同顺等嘉宾受邀参加了圆桌论坛的环节,共同围绕“价值回归主线下的 IVD 行业战略发展”这一备受关注的话题进行了深入浅出的探讨。发言代表及与会嘉宾通过论坛进一步就体外诊断行业的发展交流了信息和见解,凝聚智慧,共同构建体外诊断行业新生态。医用耗材行业生态发展论坛“医用耗材行业生态发展论坛”由国药集团中国医疗器械有限公司中区、西区、东区事业部承办,中国医药工业信息中心支持。论坛汇聚了来自政府、协会、厂家、流通和医院的全产业链顶尖人群。来自上海市卫生健康委员会、河南省医保局价采处、上海市东方医院、中国医学装备协会的专家和领导,以及国药集团河南省医疗器械有限公司、驼人控股集团有限公司、南微医学科技股份有限公司等受邀企业代表分别作了精彩的主题演讲,分别从产业政策、行业发展趋势、应对策略,国内国际、从宏观到微观,不同角度全方位探讨了“集采政策解读和制定”、“医保耗材集采形式下医院优化耗材使用的思考”、“在DRG/DIP、集采大环境下,中国(植介入)医疗器械在国内市场如何突围”等议题。美敦力(大中华区)、施乐辉医用产品国际贸易(上海)有限公司、威高集团有限公司、上海逸思医疗科技股份有限公司、北京品驰医疗设备有限公司、国药集团中国医疗器械山东有限公司等受邀企业代表参加了圆桌论坛,共同围绕“医用耗材行业生态发展趋势与转型”这一主题进行了深入的讨论和交流。医工服务新生态论坛“医工服务新生态论坛”由国药集团(上海)医学工程技术有限公司承办。本论坛贯彻“求创新,促融合,构建医工新生态”的核心主题,汇聚了来自中国医学装备协会应用评价分会会长蔡葵,中华医学会医学工程学会常委、副秘书长曹少平,中国医学装备协会采购分会秘书长田玲,青岛海信医疗设备股份有限公司总经理苏玉涛,江苏鱼跃医疗设备股份有限公司副总裁荆伟,国药集团中国医疗器械有限公司副总经理、国药集团医疗管理有限公司董事长宋飞等专家、领导与受邀企业代表们。会上,主题为“新形势下大型医疗设备采购配置与趋势”、“医疗器械质量管理区域性标准的探讨”、“大型医院医疗设备维护实践与探索”、“家用数字医疗器械和智能服务生态”的演讲报告备受与会嘉宾们的关注。随后,在由国药集团医疗管理有限公司副总经理、国药集团 ( 上海 ) 医学工程技术有限公司总经理鞠群主持的“合作共建医工新生态”圆桌论坛上,受邀嘉宾们围绕相关议题各抒己见,畅所欲言,形成了诸多有价值的行业共识。医疗器械数智化供应链论坛“医疗器械数智化供应链论坛”由国药集团中国医疗器械有限公司、中物联医疗器械供应链分会承办。来自强生、雅培、迈瑞、联影、华大、艾康、碧迪、威高、微创、梅里埃、博士伦、中元汇吉等大型医疗器械研发制造厂商共计五十余位参会嘉宾出席该分论坛。来自中物联医疗器械供应链分会常务副秘书长贾贵彬主持了本场论坛,华为云计算技术有限公司数字化转型咨询总监李志军,慕卓柯医疗器械(上海)有限公司大中华运营总监陆卫华,深圳迈瑞生物医疗电子股份有限公司工程技术总监赵野,通用电气医疗中国供应链总经理陈和强,国药集团医疗器械研究院有限公司院长助理牛道恒,国药集团中国医疗器械有限公司产品市场部总监胡畔、物流管理部部长张新梅,北京国药新创科技发展有限公司总经理助理闸海涛,杭实综合能源科技(杭州)有限公司副总经理李恺渊,中物联医疗器械供应链分会秘书长秦玉鸣受邀出席,并分别演讲了“数字化转型,构建医疗器械数智供应链”、“进口医疗器械国内一体化供应链转型分享”、“迈瑞智能制造分享”、“赢在合作·从航卫通用到国药通用”、“流通数智供应链赋能企业高质量发展”、“医院器械管理创新助力数字化供应链发展”、“医疗器械GMP、GSP低碳节能解决方案”以及“中国医疗器械产业链高质量发展之路”的主题报告。论坛期间,国药器械携手昆山医源医疗技术有限公司、顺丰医药供应链有限公司、杭州市实业投资集团有限公司完成了“生态合作伙伴”的战略签约仪式。医疗器械工业创新发展论坛“医疗器械工业创新发展论坛”由国药集团医疗器械研究院有限公司承办。国务院国有资产监督管理委员会科技创新局领导作论坛致辞,来自中国医药集团有限公司总会计师杨珊华,北京航空航天大学生物与医学工程学院院长樊瑜波,通用电气医疗中国业务拓展司库负责人、通用电气医疗金融集团总裁叶咏梅等受邀嘉宾分别为与会嘉宾们带来了主题为“2022 年中国医药企业研发指数分析与趋势”、“医工交叉融合支撑医疗器械创新”以及“赋能中国医疗器械产业创新”的精彩报告。论坛期间,一众受邀企业嘉宾参与了主题为“国内外头部企业如何通过科技创新赋能医疗器械产业发展”和“产学研密切合作,推动国产器械创新路径探讨”的两场圆桌讨论,来自国家高性能医疗器械创新中心总经理刘新,美敦力大中华区市场准入、供应链与商务运营服务部副总裁邓坚,以及中石化(北京)化工研究院有限公司副院长郭子芳等专家、领导们与受邀企业负责人从各自从业领域出发,结合业务实践,分享了卓尔有效的行业观点,两场圆桌论坛分别由生物梅里埃公司大中华区董事长、苏州长光华医生物医学工程有限公司总经理王皓峰和四川大学国家生物医学材料工程技术研究中心教授艾华主持。生物医药与医疗器械新基建论坛“生物医药与医疗器械新基建论坛”由国药集团融资租赁有限公司(简称国药租赁)承办。郑州航空港经济综合实验区管委会副主任郭鹏,武汉市人民政府决策咨询委员、原光谷生物城常务副主任闫忠宁,上海宝山高新区管委会主任刘惠斌,廊坊临空经济区党工委委员、河北临空集团有限公司党委书记、董事长韩金虎,杭州市临安区锦南新城党工委副书记、管委会主任原瑶君,丹阳市政府副市长、开发区党工委书记蒋敏、青岛高新技术产业开发区管理委员会投资促进部部长李明宽以及国寿健康产业投资有限公司金融投资部总经理李博,蓝帆医疗股份有限公司董事长刘文静等嘉宾齐聚一堂,共话生物医药与医疗器械新基建广阔未来。中国医疗器械有限公司总经理助理、国药租赁董事长鲁保才代表主办单位致辞,国药租赁总经理王国梁、(上海)张江产业工程院理事会执行主席、院长张爱平等8位嘉宾作主旨演讲。会上,与会嘉宾共同见证了“中国生物医药基础设施产业联盟战略合作组织”成立仪式,该合作组织由国药租赁发起成立,首批成员包括国寿健康产业投资有限公司、中国工业互联网研究院工联科技有限公司、北京市医疗机器人产业创新中心、清华工研院北京荷塘生华医疗科技有限公司及方升研究院。会议期间,郑州航空港经济综合实验区与国药集团融资租赁有限公司就“国药河南郑州航空港项目”签署合作协议,双方多位领导见证签约。医疗器械热点政策与产业创新论坛“医疗器械热点政策与产业创新论坛”由郑州市商务局、中国医学装备协会采购分会、中国医药教育协会儿科装备促进分会、“一带一路”医疗器械创新与应用联盟协办,中国医药工业信息中心支持,国药集团上海数智博医疗器械科技有限公司承办。来自中国药品监督管理研究会副会长王宝亭,机械工业仪器仪表综合技术经济研究所医疗装备研究室主任李春霞,上海理工大学医疗器械学院院长程云章,中国医药教育协会儿科装备促进分会主任委员、上海交通大学医学院附属儿童医院采购中心主任文志林,中国信息通信研究院医疗健康大数据与网络研究(华东)中心主任张宇鸣,兴业证券经济与金融研究院医药行业分析师嵇肖潇,中国医药工业信息中心总经理助理、国药集团上海数智博医疗器械科技有限公司高级行业研究员王奇巍等相关专家、领导和学者分别作了“我国医疗器械行业发展与现状”、“我国医疗装备产业发展现状与思考”、“立足临床需求,构建医疗器械国产化创新生态”、“医院视角的器械创新引擎与价值评估”、“AI+ 赋能医疗器械产业创新”、“医疗器械产业投资与新兴赛道”以及“集中带量采购新格局下的医疗器械行业数据洞察”等主题演讲。通过八个论坛的主题交流,与会代表们一致认为,医疗器械行业的高质量发展离不开政策扶持、高端人才以及产业基金等关键要素资源的集聚和赋能,只有实现“创新链”与“产业链”的双向融合,打造有利于国际前沿创新产品本土化的审评审批制度,以及实现上市后科学监管,才能真正形成有利于医疗器械行业良性发展的产业链和生态圈,实现大会倡导的“聚力同行·赋能共赢”的主题。年度发布2023年《全球药研新动态》《中国医院市场用药格局》(2023版)2023年《数图药讯》权威发布2021年度中国医药工业百强榜单解读中国仿制药发展报告(2022版)《2023年专利到期药品概述》医药行业专项报告中国医药中间体和原料药行业调研报告中国非甾体抗炎类原料药市场调研报告中国祛痰类原料药市场调研报告中国钙拮抗剂类原料药市场调研报告中国血管紧张素Ⅱ受体拮抗剂类原料药市场调研报告中国口服血糖调节类原料药市场调研报告中国中枢兴奋类原料药市场调研报告中国抗痛风类原料药市场调研报告中国脑血管病类原料药市场调研报告END如需获取更多数据洞察信息或公众号内容合作,请联系医药地理小助手微信号:pharmadl001点分享 点收藏 点点赞 点在看
高管变更放射疗法
2023-04-14
·药智网
据《医疗器械监督管理条例》规定,第Ⅱ、Ⅲ类医疗器械采用产品注册管理方式。境内第二类医疗器械由省、自治区、直辖市药监局审查,批准后发给医疗器械注册证;境内第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证;进口第二类、第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证。香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。2023年3月注册备案信息汇总统计:注册批准医疗器械数量1356项、备案批准医疗器械数量1773项、优先审批注册医疗器械产品4项、创新审批注册医疗器械产品13项。PS:药智网公众号后台回复【器械注册】,即可获取3月上市器械注册分析完整报告PDF版。据药智器械企业版最新统计,2023年3月NMPA共批准注册医疗器械1356项,同比增加77.9%,其中优先审批注册4项,创新审批注册13项;审批备案医疗器械数量1773项,同比增加44.6%;2023年3月医疗器械注册&备案情况详见图1。2023年3月,国家药监局共批准注册医疗器械产品1356项。其中,国产第Ⅱ类医疗器械产品1063项,国产第Ⅲ类医疗器械产品228项,进口第Ⅱ类医疗器械产品26项,进口第Ⅲ类医疗器械产品39项,国产占比95.2%。从产品类别来看,2023年3月中注册医疗器械中,体外诊断试剂(304件),注输、护理和防护器械(193件)、及口腔科器械(64件)注册数量排名前三。3月体外诊断试剂产品注册数较2月增多,超过了注输、护理和防护器械注册数量。2023年2月-3月,医用口罩等最重要的防护类医疗器械依旧是占据了医疗器械注册产品数量排名第一的位置。此外,3月口腔科器械和体外诊断试剂注册数量较前两月明显增加。从Ⅱ类医疗器械注册产品来源地分布来看,国内3月共有25个省市(包括中国港澳台)注册Ⅱ类医疗器械,其中广东省注册医疗器械数量最多,占全部Ⅱ类医疗器械数量的29.6%。从Ⅲ类医疗器械注册产品来源地分布来看,国内3月共有124省市(包括中国港澳台)注册Ⅲ类医疗器械,其中江苏省注册医疗器械数量最多,占全部Ⅲ类医疗器械数量的16.1%。据《医疗器械监督管理条例》规定,第一类医疗器械采用产品备案管理方式。2023年3月国产Ⅰ类医疗器械备案批准数量1707项,同比增加46.3%。同时,进口第一类医疗器械备案批准数量66项,同比增加10.0%。3月医疗器械创新及优先审批根据《创新医疗器械特别审批程序(试行)》,我国医疗器械创新审批是为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展的特殊审批通道。2023年3月,全国创新审批注册产品共计13项,其中,国产创新医疗器械产品12项,进口创新医疗器械产品1项。从产品类别来看:13项均为器械产品,无试剂产品。2023年3月共有四个省市注册创新审批医疗器械,其中浙江省和上海市注册数量排名并列第一。2016年10月25日,国家药监局发布《医疗器械优先审批程序》,于2017年1月1日起施行。根据《医疗器械优先审批程序》,对下列医疗器械实施优先审批:一是诊断或治疗罕见病、恶性肿瘤且具有明显临床优势的医疗器械,诊断或治疗老年人特有和多发疾病且尚无有效诊断或治疗手段的医疗器械,专用于儿童且具有明显临床优势的医疗器械;二是列入国家科技重大专项或国家重点研发计划的医疗器械。此外,将根据各方面情况和意见,组织专家审查后,确定对“其他应当优先审批的医疗器械”予以优先审批。2023年3月,全国优先审批注册产品共计4项,均为国产医疗器械产品。从产品类别来看:器械产品2项,试剂产品2项。2023年3月共有三个省市注册医疗器械进入优先审批,其中广东省注册数量最多排名第一。3月医疗器械注册企业分析2023年3月国内注册医疗器械企业达718家。排行前十的企业中,排名前三的分别是:北京贝尔生物工程股份有限公司、深圳市锦瑞生物科技股份有限公司、深圳市国赛生物技术有限公司,其中北京贝尔生物工程股份有限公司的注册数量排名第一,排行前十的企业情况如下图所示。2023年3月,北京贝尔生物工程股份有限公司在北京市药监局完成了49项医疗器械,注册产品数量排名第一,均为Ⅱ类IVD诊断试剂产品。从进口医疗器械代理人企业情况看,2023年3月进口医疗器械注册代理人企业达54家。排行前十的企业中,排名前三的分别是:西门子医学诊断产品(上海)有限公司、施乐辉医用产品国际贸易(上海)有限公司、瑞必欧(上海)诊断技术有限公司,其中西门子医学诊断产品(上海)有限公司的注册数量排名第一,排行前十的企业情况如下图所示。西门子医学诊断产品(上海)有限公司代理三项进口医疗器械,均为Ⅱ类体外诊断试剂产品。PS:药智网公众号后台回复【器械注册】,即可获取3月上市器械注册分析完整报告PDF版。来源 | 药智器械(药智网获取授权转载)撰稿 | 青田责任编辑 | 八角声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。商务合作 | 王存星 19922864877(同微信) 阅读原文,是昨天最受欢迎的文章哦
优先审批诊断试剂临床研究
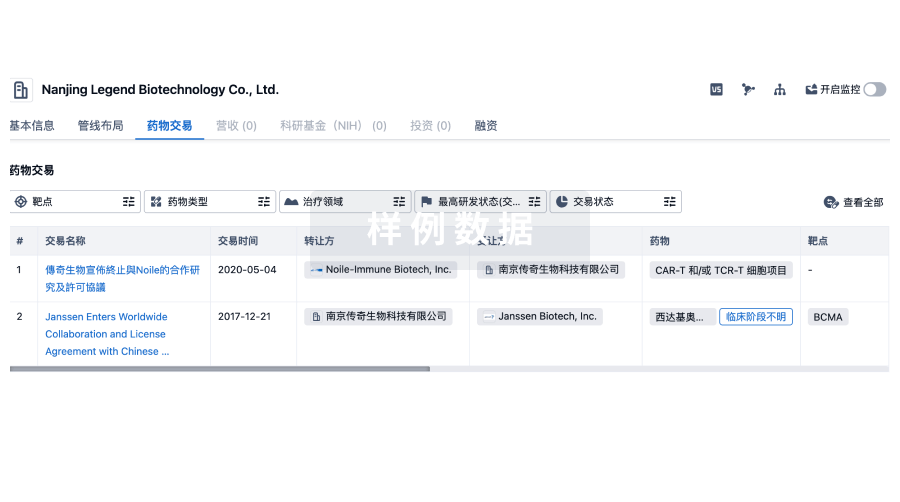
100 项与 施乐辉医用产品国际贸易(上海)有限公司 相关的药物交易
登录后查看更多信息
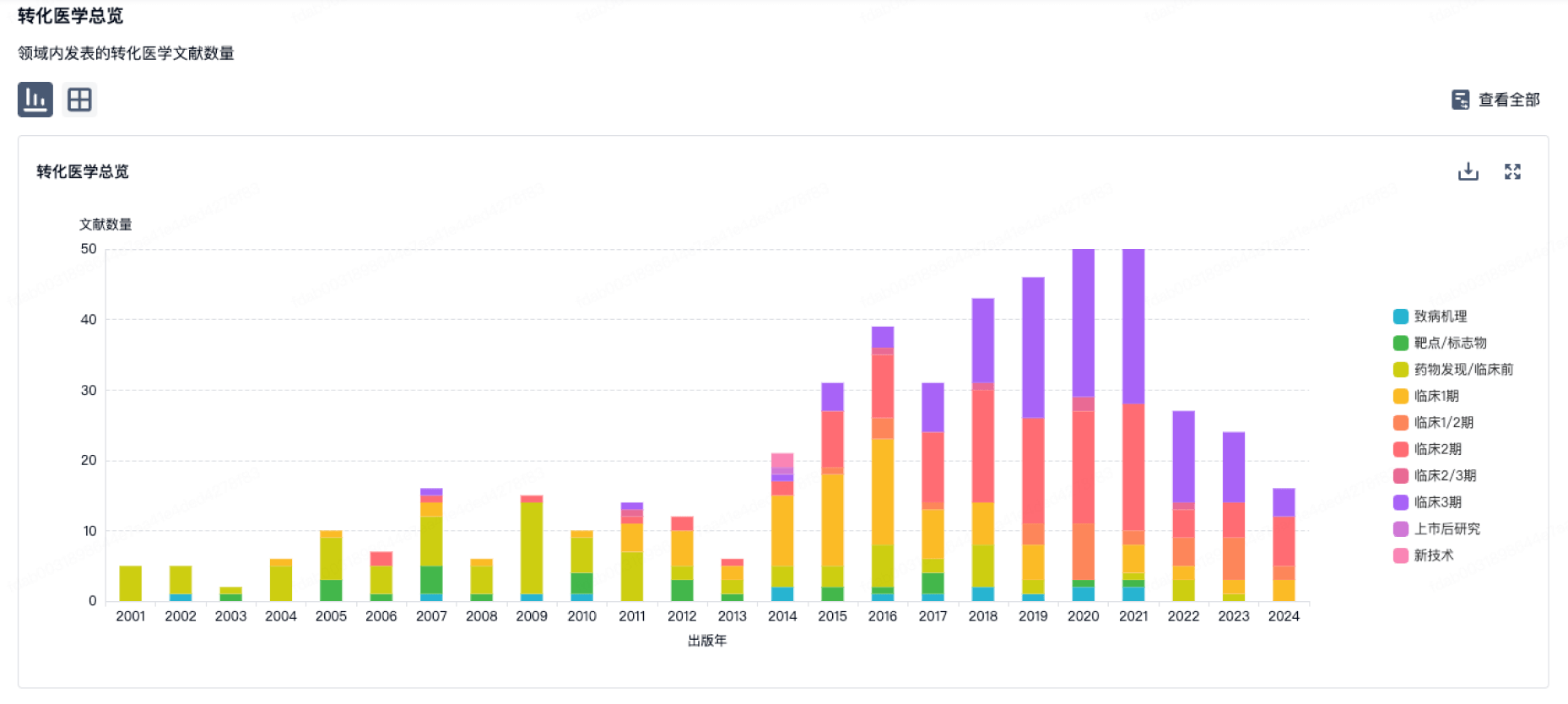
100 项与 施乐辉医用产品国际贸易(上海)有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年04月25日管线快照
无数据报导
登录后保持更新
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
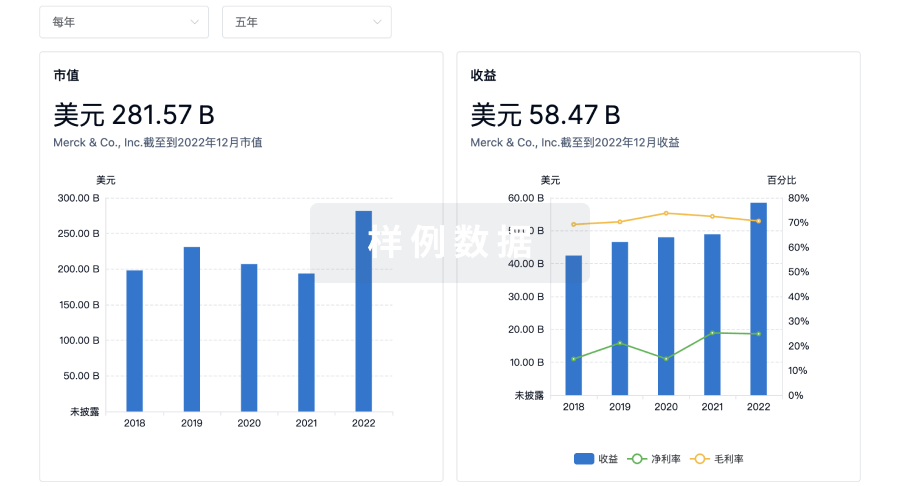
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
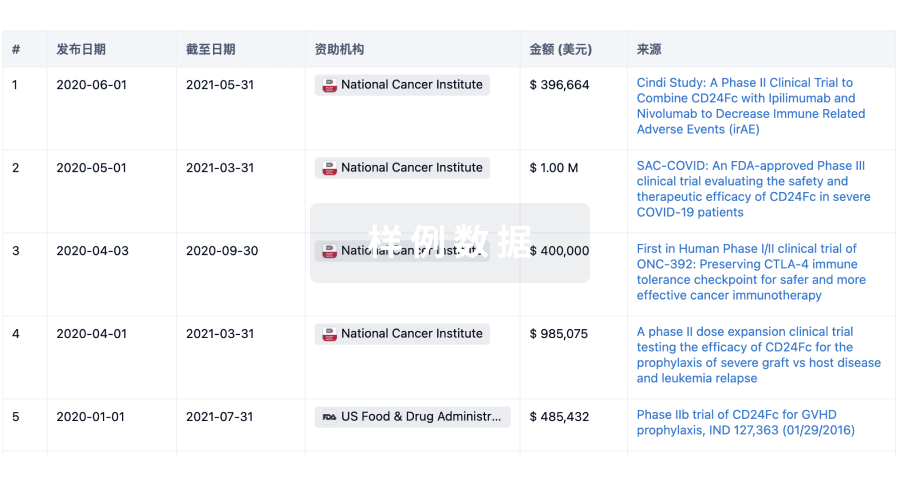
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
来和Eureka LS聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用