预约演示
更新于:2025-05-07

Wuxi Kejin Biotechnology Co., Ltd.
更新于:2025-05-07
概览
标签
遗传病与畸形
血液及淋巴系统疾病
其他疾病
基因疗法
CRISPR/Cas9
双特异性抗体
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| 基因疗法 | 4 |
| 腺相关病毒基因治疗 | 1 |
| CRISPR/Cas9 | 1 |
| 双特异性抗体 | 1 |
| 排名前五的靶点 | 数量 |
|---|---|
| PKLR(丙酮酸激酶R/L型同功酶) | 1 |
| CD20 x CD3 | 1 |
关联
6
项与 无锡科金生物科技有限公司 相关的药物靶点 |
作用机制 PKLR调节剂 |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床1期 |
首次获批国家/地区- |
首次获批日期- |
靶点- |
作用机制- |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期- |
靶点- |
作用机制- |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段临床前 |
首次获批国家/地区- |
首次获批日期- |
100 项与 无锡科金生物科技有限公司 相关的临床结果
登录后查看更多信息
0 项与 无锡科金生物科技有限公司 相关的专利(医药)
登录后查看更多信息
11
项与 无锡科金生物科技有限公司 相关的新闻(医药)2024-11-01
·药时代
作为一家聚焦新药研发的专业媒体、中国制药界雷达,药时代一直在记录、报道中国的新药研发的最新进展,“创新”、“出海”是我们全力覆盖的最新内容。
2022年4月25日,【药时代出海系列】的第一篇文章发表,当我们讨论「出海」时,我们究竟在讨论什么?| 药时代出海系列,对中国新药出海的定义、形式、类别进行了系统的分析。
2022年5月14日,系列第二篇文章发表,百济神州、传奇、恒瑞、和黄、信达、君实、和铂。中国多少家药企正在扬帆出海?| 药时代出海系列。文章汇总了过去的5个月时间里中国药企出海的消息。这51家企业中既有恒瑞、石药等正在成功转型的中国大药企,也有百济神州、传奇、信达、天境、基石、再鼎等中国创新性生物技术公司(biotech)、生物制药(biopharma)公司,还有凭借技术而出海的和铂、百奥赛图、三迭纪、晶泰科技、天演药业、慧渡医疗等技术性平台型公司。
很高兴我们的这一系列得到越来越多的药企、园区、高校和研究机构、媒体等单位的关注!
今天是2022年5月28日,距离上一篇文章又过去了两个星期。那么,在这两个星期里,作为中国制药界雷达,药时代又有哪些重大发现呢?
中国新药出海征程上又传来哪些消息?取得了哪些进展?是否遇到了新的挫折?
01传奇再现!获欧盟附条件上市许可!
2022年3月的第一天,大洋彼岸终于传来好消息,传奇/强生的CAR-T产品CARVYKTI®(西达基奥仑赛,英文通用名Ciltacabtagene Autoleucel,简称Cilta-cel)获FDA批准上市!这不仅扫去了211之后中国出海药企的阴霾,打了一个漂亮的“翻身仗”,更是意味着中国在细胞疗法这个领域,正式走到了世界一线的位置。5月27日,喜讯再次传来!当地时间2022年5月26日,传奇生物正式宣布,欧盟委员会(EC)已授予CARVYKTI®附条件上市许可,用于治疗既往接受过至少三种治疗,包括免疫调节药物、蛋白酶体抑制剂和抗CD38抗体,并且末次治疗出现疾病进展的复发或难治性多发性骨髓瘤(R/R MM)成人患者。传奇生物首席执行官黄颖博士点评道:CARVYKTI®获得欧盟委员会批准,标志着传奇生物在该地区首次获得批准,这是一个重要的里程碑,我们进一步推进了将创新的细胞疗法带给存在高度未被满足需求患者的承诺。CARTITUDE-1的研究数据显示,CARVYKTI®有潜力为那些已接受过大量预处理且需要长期无治疗间隔的多发性骨髓瘤患者提供一种有效的治疗选择。我们期待与合作伙伴杨森共同将这一新疗法带给欧洲各地的患者。
02全球新·中国创——时隔三年,本维莫德海外终获批!
5月24日,美国FDA正式批准Dermavant Sciences开发的VTAMA® (tapinarof,1%)上市,可用于治疗成人斑块状银屑病。这是近20多年来美国FDA批准的治疗银屑病的首款外用新分子实体,为数百万患有斑块状银屑病的成年人提供了一种有效的非类固醇的创新外用治疗选择。Tapinarof中文名本维莫德 (benvitimod),得益于中国药品审评审批的制度改革,在“重大新药创制”国家科技重大专项的支持下,这款创新疗法早在2019年经国家药品监督管理局优先审评审批程序已率先获批上市,名为本维莫德(benvitimod)乳膏(商品名:欣比克®),上市许可持有人为冠昊生物控股子公司广东中昊药业有限公司。
本维莫德由中国企业研发,并率先在中国大陆上市,是这一领域中国领先国际的标志性成果。它的诞生意味着我国创新驱动的生物医药产业正在经历跨越式发展。
值得一提的是,根据国家药监局CDE的要求和指导,本维莫德临床研究采用了和现有治疗银屑病外用药金标准药物“头对头”随机双盲对照试验,金标准药物PASI75应答率为38.5%。本维莫德乳膏PASI75应答率为50.4%,美国三期临床研究的PGA应答率,试验1和2分别为35.4%和40.2%。研究结果表明:无论是在2019年上市的欣比克®还是这次的VTAMA®,本维莫德乳膏均显示出优秀的临床优势。同时,本维莫德乳膏国内三期高标准的临床研究也体现了CDE对新药临床研究要求的权威性和严谨性。
本维莫德大中华区以外的开发权几经转手,2012年葛兰素史克花费2.3亿美元购得,2018年以约3.3亿美元转让给DermavantSciences。FDA 批准上市,无疑是对本维莫德乳膏优异疗效的充分肯定,进一步增强其国内市场地位。
这是目前为止我国先批准上市而后美国FDA才批准的第一个创新药,充分表明了我国药品审批审评,不管是速度、效率、还是水平,均领先国际。
03恒瑞喜讯频传!
5月12日,恒瑞医药发布公告,称其子公司苏州盛迪亚研发的注射用卡瑞利珠单抗(PD1单抗)联合甲磺酸阿帕替尼片(VEGFR2抑制剂)的国际多中心III期临床试验(SHR-1210-Ⅲ-310)由独立数据监察委员会(IDMC)判定主要研究终点结果达到方案预设的优效标准。卡瑞利珠单抗联合阿帕替尼用于既往未接受过系统治疗的不可切除或转移性肝细胞癌患者的一线治疗的上市许可申请已获得中国国家药品监督管理局受理,公司也计划近期向美国食品药品监督管理局(FDA)递交新药上市的沟通交流申请。恒瑞加快国际化进程!2022年5月18日,恒瑞宣布成立了一家新的面向中国之外的全球化公司,取名Luzsana ,来自西班牙语的"la luz"(光明)以及拉丁语的 "sana"(治愈),代表light of healing,即“治愈之光”。新公司基于恒瑞美国团队,目前管线产品全部来自恒瑞,包括250多项临床研究,覆盖肿瘤、心血管、代谢性疾病/糖尿病、疼痛管理、免疫、肝脏肾脏疾病等具有临床未被满足需求的领域。新公司在美国普林斯顿、新泽西、东京、巴塞尔、瑞士等地设有办公室,目前团队超过120人。
04火热的细胞疗法、基因疗法赛道继续高歌猛进!
近年来火热的一塌糊涂的细胞疗法和基因疗法赛道继续高歌猛进!除了上面分享的传奇生物的好消息之外,中国众多家跻身这两个赛道的药企也取得了一个又一个的喜人进展!
2022年1月11日,西比曼生物科技,一家专注于开发创新细胞疗法用于治疗癌症和退行性疾病的生物制药公司,宣布FDA授予公司细胞治疗产品C -CAR039(一种针对CD19和CD20抗原的新型自体双特异性CAR-T疗法)再生医学先进疗法 (RMAT) 资格和快速通道(FT)资格,用于治疗复发或难治性及弥漫性大 B 细胞淋巴瘤(r/r DLBCL)。
2022年1月15日,合源生物与中国医学科学院血液病医院(中国医学科学院血液学研究所)联合宣布,靶向CD19 CAR-T药物CNCT19细胞注射液获得FDA授予的孤儿药资格认定(Orphan Drug Designation, ODD),用于治疗急性淋巴细胞白血病(Acute Lymphoblastic Leukemia, ALL)。这是继2020年12月被国家药品监督管理局(NMPA)药品审评中心(CDE)纳入“突破性治疗药物”后,CNCT19细胞注射液在商业化和全球化进程中取得的又一重大进展。
2022年1月18日,中国眼科疾病的体内基因治疗领导者纽福斯生物科技有限公司宣布公司的候选药物NR082(rAAV2-ND4,核心项目NFS-01),用于治疗ND4突变引起的Leber遗传性视神经病变(ND4-LHON)获FDA授予新药临床试验(IND)许可,并将在美国开展临床试验。NR082是首个获得美国FDA临床试验许可的中国籍眼科体内基因治疗药物。1月19日,公司宣布其候选药物NFS-02(rAAV2-ND1),用于治疗ND1突变引起的Leber遗传性视神经病变(ND1-LHON)获FDA的孤儿药认定。这是纽福斯自主研发的第二款获得FDA授予孤儿药认定的基因治疗候选药物。1月24日,纽福斯宣布,公司最先进的候选药物NR082(rAAV2-ND4),用于治疗ND4突变引起的Leber遗传性视神经病变(ND4-LHON)获欧洲药品管理局(EMA)孤儿药品委员会(COMP)授予孤儿药身份(ODD)。这也是首个中国自主开发的体内基因治疗产品获得欧洲EMA孤儿药认定,此前,NR082已被美国FDA授予孤儿药身份。
2022年1月18日,开发创新型CAR-T 细胞疗法治疗实体瘤和血液瘤的临床阶段生物技术公司——博生吉医药科技(苏州)有限公司(PersonGenBioTherapeutics),与法国梅里埃集团子公司Transgene (EuronextParis: TNG)——一家全球领先的溶瘤病毒临床研发公司,宣布了一项深度战略合作协议,以评估博生吉的TAA06-CAR-T细胞注射液与Transgene公司静脉给药的Armed溶瘤病毒联合治疗胰腺癌、脑神经胶质瘤等恶性实体肿瘤的可行性和疗效。该合作的目标旨在探索CAR-T 细胞联合溶瘤病毒以达到增强治疗效果的协同机制。3月18日,博生吉宣布,其开发的靶向B7-H3的嵌合抗原受体(CAR)-T细胞注射液(研发代号:TAA06注射液)收到FDA授予的孤儿药资格认定( ODD),用于治疗神经母细胞瘤(neuroblastoma)。3月27日,公司宣布:美国FDA根据联邦食品、药品和化妆品法案(FD&C 法案)(21 U.S.C. 360ff(a)(3))第529(a)(3)条,对TAA06注射液授予罕见儿科疾病(Rare Pediatric Disease,RPD)认定,用于治疗神经母细胞瘤。
2022年2月7日,南京北恒生物科技有限公司宣布,其开发的抗claudin18.2自体CAR-T细胞治疗产品CTB001收到FDA授予的孤儿药资格认定(ODD),用于治疗胃癌(Gastric cancer)。胃癌在中国、日本等亚洲国家发病率很高,死亡率居全球恶性肿瘤死亡率的第三位,仅次于肺癌和结直肠癌。目前胃癌治疗主要采用常规化疗和手术切除等,治疗药物和方法十分有限。
2022年3月10日,无锡科金生物科技有限公司宣布其针对丙酮酸激酶缺乏症的细胞治疗管线CG001取得欧洲药品管理局(EMA)孤儿药资格认定(ODD)。CG001是一种体外编辑(ex vivo)的细胞疗法,通过CRISPR/AAV来改正变异的丙酮酸激酶基因来达到治愈的目的。
2022年5月6日,原启生物,一家致力于成为全球肿瘤免疫创新药物创制者的生物制药公司,宣布, 旗下自主创新产品OriCAR-017治疗复发/难治性多发性骨髓瘤(RRMM)的最新临床数据亮相国际顶尖学术会议,成功入选2022年第27届欧洲血液学大会(27th EHA Congress) / 年会,届时将以口头报告形式公布详细数据。OriCAR-017是原启生物基于其自主创新的Ori®Ab及Ori®CAR技术平台开发的创新靶点CAR-T产品。
2022年5月17日,北海康成制药有限公司,一家立足于中国的生物制药公司,是全球罕见疾病领域的领先公司,致力于创新疗法的研究、开发和商业化。公司于今日在华盛顿特区举行的第25届ASGCT年会上,展示与UMass Chan医学院Horae基因治疗中心开展罕见病基因治疗研究合作的初步数据。2022年5月20日,信念医药宣布,公司研发的亚洲首个单次静脉给药的血友病B基因治疗在研药物(BBM-H901注射液)的临床研究结果,已成功发表于国际血液学权威期刊《柳叶刀-血液病学》(The Lancet Haematology)。
05ADC赛道成功出海!
2022年3月31日,同宜医药(苏州)有限公司宣布,创始人、董事长兼总经理黄保华博士应邀参加3月29日在伦敦举办的第12届伦敦世界ADC大会,担任ADCS & Beyond研讨会的大会主席,并发表主题演讲,公布同宜医药首个临床产品CBP-1008的进展。同时,黄博士担任专家讨论环节主席。CBP-1008是以FRa和TRPV6为靶点,NMAE为载药的bi-XDC双特异性First-in-class全球首创新药。在正在进行的双周剂量扩组(Q2W,0.15mg/kg)Ib期队列研究中,已入组120余例受体阳性患者,在卵巢癌、三阴乳腺癌和Her2+乳腺癌患者(前序治疗线数多达9线)中初步显示出良好的安全性和卓越疗效。
2022年5月16日,科伦博泰生物大分子肿瘤项目 A 有偿许可默沙东(MSD)公司在中国外商业化开发。MSD 将根据商业化开发阶段向科伦博泰支付首付款、各类里程碑付款及相应净销售额提成。科伦博泰于许可协议生效时收到1700万美元一次性、不可退还的付款,于本协议修正案签署后收到3000万美元一次性、不可退还的付款,里程碑付款累计不超过13.63亿美元,并按双方约定的净销售额比例提成。总金额高达14亿美元。
06更多喜讯,来自中国NASH新药联盟成员企业等新药研发公司。
2022年2月18日,药捷安康宣布公司非共价可逆布鲁顿酪氨酸激酶(BTK)抑制剂TT-01488治疗B细胞淋巴瘤的临床试验申请已于2022年01月24日获得FDA批准,即将启动在美国的I期临床试验。此外,中国国家药品监督管理局已于2022年2月14日正式受理TT-01488治疗B细胞淋巴瘤的临床试验申请。3月7日,公司自主研发的AXL/FLT3双靶点抑制剂TT-00973治疗恶性血液肿瘤的临床试验申请已于2022年02月24日获得FDA批准,即将在美国启动针对急性髓细胞白血病(“AML”)和骨髓增生异常综合征(“MDS”)的1期临床试验。TT-00973是药捷安康第7款进入临床阶段的小分子创新候选药物。
2022年2月22日,君圣泰公司宣布与FDA达成共识,将推进HTD1801治疗原发性硬化性胆管炎(PSC)的国际多中心(MRCT)临床3期试验。在“临床2期结束后”会议(EOP2)上,公司与FDA成功开展了富有成效的讨论,包括临床3期试验设计的关键要素。《Nature》子刊发表君圣泰HTD1801临床二期试验数据君圣泰HTD1801 正式启动中国临床试验君圣泰用于治疗PBC的HTD1801临床二期试验首位患者用药君圣泰HTD1801获得国家药品监督管理局药品审评中心临床试验默示许可联盟动态|君圣泰宣布任命 Leigh MacConell 博士为首席开发官2022年3月1日,亿帆医药宣布,2022年2月28日,公司致力于为全球患者开发新型生物疗法的子公司亿一生物有限公司注册于新加坡的附属公司Evive Biotechnology Singapore pte.ltd.(“新加坡亿一”)与一家具有竞争性的独立专业制药公司APOGEPHA Arzneimittel GmbH签订合作协议,协议约定新加坡亿一将新型生物药F-627(艾贝格司亭α,长效G-CSF)在德国的独家经销权许可给APOGEPHA公司,并将获得不可退还的首付款40万美元、最高不超过100万美元开发里程碑付款及最高不超过3,750万美元的销售里程碑付款。
2022年5月16日,创响生物(Inmagene Biopharmaceuticals)宣布,FDA许可了其候选药物IMG-004的Ⅰ期临床试验申请(IND)。IMG-004特别为需长期治疗的炎症性或自身免疫性疾病而设计,是一种非共价、可逆的第三代BTK抑制剂,具有高效力、高选择性和能通过血脑屏障等特性。创响正将其针对免疫相关性疾病进行开发。2022年5月17日,百济神州(纳斯达克代码:BGNE;香港联交所代码:06160;上交所代码:688235)宣布,在瑞士巴塞尔正式启用新的地区办事处。目前,百济神州已在欧洲建立起商业化和临床开发团队,巴塞尔办事处也将作为公司在欧洲的区域运营中心。2022年5月18日,国际著名肿瘤学期刊《临床肿瘤学杂志》(Journal of Clinical Oncology,JCO,IF:44.544)在线发表了上海交通大学附属胸科医院陆舜教授主导的翰森制药创新药甲磺酸阿美替尼AENEAS研究论文。这是ASCO官方期刊首次发表中国原创三代EGFR-TKI临床数据。
2022年5月20日,贝达药业宣布,其美国子公司Xcovery收到美国FDA通知,Xcovery申报的BPI-442096片拟用于晚期实体瘤的药品临床试验申请已获得FDA批准。2022年5月26日,来凯医药,一家处于临床阶段的全球医药新锐宣布,其一项针对乳腺癌的Ib/III期全球多中心临床研究,已分别在中国天津医科大学肿瘤医院和美国亚特兰大州Piedmont 癌症中心完成了受试者入组及首例给药,标志着此项研究的全球同步开发进入了快速推进阶段。
免疫疗法细胞疗法基因疗法孤儿药合作
2024-11-01
·美通社
苏州2023年2月28日 /美通社/ -- 2023年2月27日,苏州博腾生物制药有限公司(简称博腾生物)宣布与无锡科金生物科技有限公司(简称科金生物)达成战略合作。双方将深度拓展在基因与细胞治疗领域的项目合作,快速推进研发管线,加快创新药物的研发进程。
博腾生物与科金生物达成战略合作
博腾生物拥有端到端的基因与细胞治疗CDMO服务平台,覆盖质粒、细胞治疗、基因治疗、溶瘤病毒、核酸治疗及活菌疗法等领域。科金生物是一家专注于用基因编辑技术与细胞疗法治疗罕见病以及抗癌新药研发及生产的创新型公司,建立了丰富的研发管线并实现全球同步开发运营。根据协议,博腾生物将为科金生物提供基因与细胞治疗研发管线的CDMO服务,包括质粒、病毒及细胞治疗产品。
博腾生物首席执行官王泱洲博士表示:"我们非常高兴与科金生物达成深度战略合作。科金生物是一家极具创新能力的研发企业,其拥有自主知识产权的CRISPR/AAV技术平台获多方认可,目前在研的7个管线也非常具有竞争力,覆盖临床前到临床I期各阶段。希望通过博腾生物端到端的基因与细胞治疗CDMO平台,帮助科金生物实现多管线的IND获批,快速推进研发管线从海内外进入临床,加快创新药物的研发与落地,让好药更早惠及大众。"
科金生物创始人及CEO王海峰博士表示: "我们对本次与博腾生物达成战略合作非常期待,这标志着双方的强强联手、互惠共赢迈上了一个新台阶。我相信科金与博腾的珠联璧合,一定能为基因细胞治疗领域的创新研发做出更大贡献。我们也将积极推进更深层次、更广领域的合作发展。"
科金生物联合创始人兼首席科学官Jose Carlos Segovia,在签约现场分享了题为"体外基因编辑治疗溶血性贫血"的报告,并介绍了科金生物的最新研究进展。对于本次战略合作,Jose Carlos Segovia教授表示:"我们一直专注于用基因编辑技术与细胞疗法治疗多种疾病,以患者为中心,以临床价值为导向进行新药开发。我们期待与博腾生物一同,更快更广泛地用创新生物药物造福患者,将创新价值高效转化成为社会价值和商业价值。"
关于科金生物
无锡科金生物科技有限公司(简称:科金生物)是一家布局全球专注于用基因编辑技术与细胞疗法治疗多种疾病的创新型公司。公司拥有自主知识产权的CRISPR\/AAV 技术平台,可实现精准基因替换来完全治愈患者,可插入cDNA片段小于10000bp的任何基因,没有脱靶以及致癌风险,编辑效率可达80%,并且还在不断提升。目前几个项目同时在临床前到临床一期的各阶段。其中丙酮酸激酶缺乏症管线CG001于2022年3月获得EMA孤儿药资格认定,预期在2023年年中完成欧美 IND 申报。
公司精准基因替换技术平台有广泛的应用场景,血液病、神经相关疾病、癌症、皮肤等都能应用。公司布局6大管线,覆盖血液病,皮肤病以及肝脏相关疾病,并有多个管线取得了欧美孤儿药资格认证。
关于博腾生物
苏州博腾生物制药有限公司成立于2018年12月,立足于苏州工业园区,以上市公司-重庆博腾制药科技股份有限公司(股票代码:300363)为依托,搭建了质粒、细胞治疗、基因治疗、溶瘤病毒、核酸治疗及活菌疗法等CDMO平台,提供从建库,工艺方法及分析方法开发,cGMP生产到制剂灌装的端到端服务,贯穿药物不同研发阶段,帮助客户加快药物研发与上市进程。
博腾生物聚焦基因与细胞治疗,在博腾股份的成功经验之上,以国际一流的专业人才为核心,秉承"客户第一"的服务宗旨,以"合规、专业、专注、开放协作"为品牌理念,延续母公司强大的IP保护和项目管理机制以及完善的质量管理体系,充分利用核心团队将基因和细胞治疗产品推向临床直至上市的成功经验,为全球客户提供优质和高效的服务,让好药更早惠及大众。

临床申请临床1期细胞疗法基因疗法
2024-11-01
·循因缉药
各位亲爱的股东,大家早上好中午好晚上好。
咱们又见面了...我们好久没有聊CGT的话题了吧。
今天,我们来蹭热点。
新闻
2024年6月5日,澎湃新闻发布一则新闻《全球首例!16岁女孩在上海接受精准大片段基因替换治疗》,以下为原文引用:
“上海交通大学医学院附属上海儿童医学中心获悉,该院血液肿瘤科移植团队近日成功为一名患有丙酮酸激酶缺乏症(PKD)的16岁女孩完成了精准大片段基因替换治疗。这也是全球首例接受基因替换治疗的PKD患儿。”
全文不长,各位感兴趣可以通过底部注1链接找到。
但是,这篇文章引起了我们的注意。
相信各位看到新闻也同样会产生如下几个疑问。
第一,这项治疗方案来自哪家公司-谁干的?
第二,这项治疗方案有什么特色-怎么治?
第三,这家公司是个什么公司-摸摸底?
接下来我们就一个一个来解答。
谁干的?
(科金Logo,侵删)
我们先说结论,这是来自无锡科金生物的细胞基因疗法DNGT-101(CG001,下同)。
2023年8月2日,由无锡科金生物科技有限公司(以下简称“科金生物”)支持,上海交通大学医学院附属上海儿童医学中心(以下简称“儿医中心”)血液中心主任陈静主任为主要研究者发起的“DNGT-101细胞注射液治疗儿童重度PKD安全性和初步疗效的单中心开放性早期临床研究”启动。
也就是说,新闻中化名“小凌”的女孩正是第一位入组的患者。
该项目在中国临床试验中心的注册号为ChiCTR2300073795,计划入组人数为2。
这是一个IIT(Investigator Initiated Trial)研究,即由医疗机构的研究者发起的、不以药品医疗器械等产品注册为目的的临床研究(但并不代表产品不另外启动单独用于申报的临床试验)。
那么,PKD是什么以及DNGT-101是怎么治疗PKD患者的呢?
怎么治?
PKD,也就是丙酮酸激酶缺乏症(Pyruvate kinase deficiency)是一种罕见的常染色体隐性遗传疾病,可导致患者出现慢性溶血性贫血,即红细胞加速破坏。
PKLR基因的突变会导致红细胞能量的缺失,其主要表现为PK酶活性降低、ATP生成减少及上游代谢产物的积聚,造成红细胞能量缺失,并加速红细胞的死亡产生溶血性贫血,甚至导致死亡。
一般高加索人群中PKD患病率估计为1:20000,据IQVIA统计,全球大概每百万人中有51个PKD患者。
DNGT-101是基于无锡科金的CRISPR 3.0平台的ex vivo体外基因疗法。
其特点是通过CRISPR做靶向双链DNA断裂,然后用AAV递送同源重组修复模板,通过同源重组修复(Homology directed repair,HDR),把缺失的基因给补上。
一般情况下AAV递送的话敲入的长度应该不超过3.5kb,但是科金可以插入10kb的任意基因。
推测,可能是指使用了双AAV递送的情况下能够达到的长度。
目前,也有ssDNA替换AAV进行递送的方式。
AAV的优点是工艺成熟,入核递送效率高所以编辑效率高;缺点是包装后AAV要纯化,但还是会有空壳率问题。
ssDNA的好处就是非病毒DNA载体,稳定,后期上临床CMC和GMP在时间和成本上都比AAV节省很多;缺点就是编辑效率偏低。
(感谢不愿意透露姓名的叶博给予的技术支持,写错了都找她,有关CGT的问题也可以在文末加我微信我帮您问她。)
DNGT-101通过分离患者自体造血干细胞,并通过基因编辑修复PKLR基因,后回输至患者体内,进而恢复PK酶的表达来达到治愈的目的。
一说到CRISPR和HDR是否会想到一位故人?
没错,那必须是Graphite Bio啊。
咱们按下不表,接下来会揭秘两者的关联。
摸摸底
无锡科金生物科技有限公司注册于2021年1月27日,创始人是王海峰博士和Jose-Carlos Segovia博士。
根据王博的相关采访,我们了解到创业机缘始于2016年和他发小患有PKD的孩子。
王海峰一直在帮这个孩子找药,从小分子药到大分子药,甚至骨髓移植找配型。
2018年,他在美国找到了正在开发中的PKD治疗药物项目,认识了在PKD治疗领域深耕了三十多年西班牙CIEMAT项目的发明人Jose Carlos Segovia教授。
Jose Carlos Segovia教授告诉他,CIEMAT和斯坦福有新一代的CRISPR/AAV精准基因替换专利技术。
根据我们的查询,应该就是US20230303990A1。
不用去找了,我都下载好了,文末有地址。
巧合的是,这里面除了联合创始人Jose Carlos Segovia教授还有另外一位熟人Matthew Porteus。
而Matthew Porteus,正是Graphite Bio的创始人之一。
当然,我们并不能据此就说Graphite Bio的技术源流与科金一样,只是有缘分而已。
科金于2022年2月28日拿到了来自幂方资本/金浦投资/无锡金投的1亿元天使轮融资,让人羡慕。
目前,科金有5条管线,目前进展最快的就是治疗PKD的DNGT-101(CG001)。
2023年3月7日,CG001获得美国食品药品监督管理局(FDA)孤儿药资格认定(orphan drug designation)。
最后
最后我们总结下,从一条新闻我们得到了哪些信息。
第一,我们知道了这个治疗PKD罕见病患者的治疗方法是来自无锡科金的DNGT-101(CG001)。
第二,我们知道了DNGT-101(CG001)是基于CRISPR+AAV的体外基因编辑细胞疗法(ex vivo),使用同源重组修复进行大片段的基因编辑。
第三,无锡科金技术与美国Graphite Bio类似。
以上信息均来自公开信息,不涉及到涉密,也欢迎各位股东提供进一步的信息。
以下是本文提到的专利和论文的下载链接:
链接:https://pan.baidu.com/s/1aAGbyjSYtphF79tupTJfSg
提取码:xyjy
基因疗法临床研究临床结果
100 项与 无锡科金生物科技有限公司 相关的药物交易
登录后查看更多信息
100 项与 无锡科金生物科技有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年09月15日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
药物发现
1
4
临床前
临床1期
1
登录后查看更多信息
当前项目
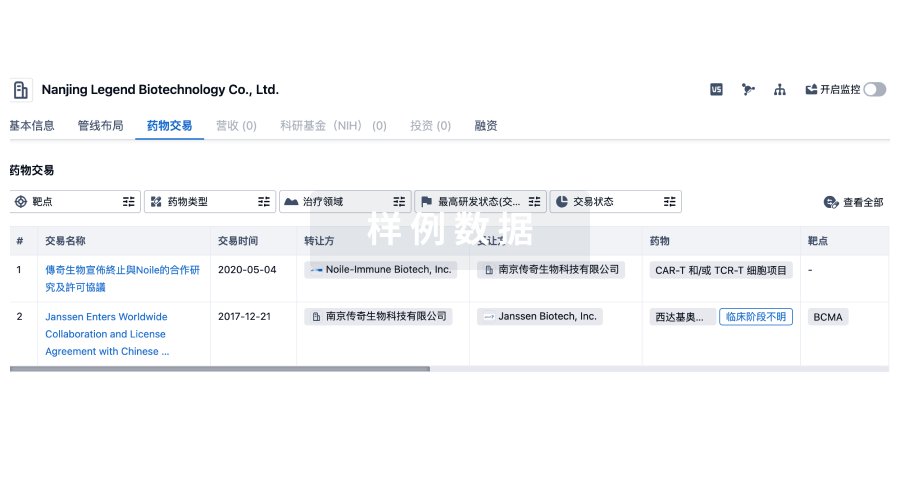
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
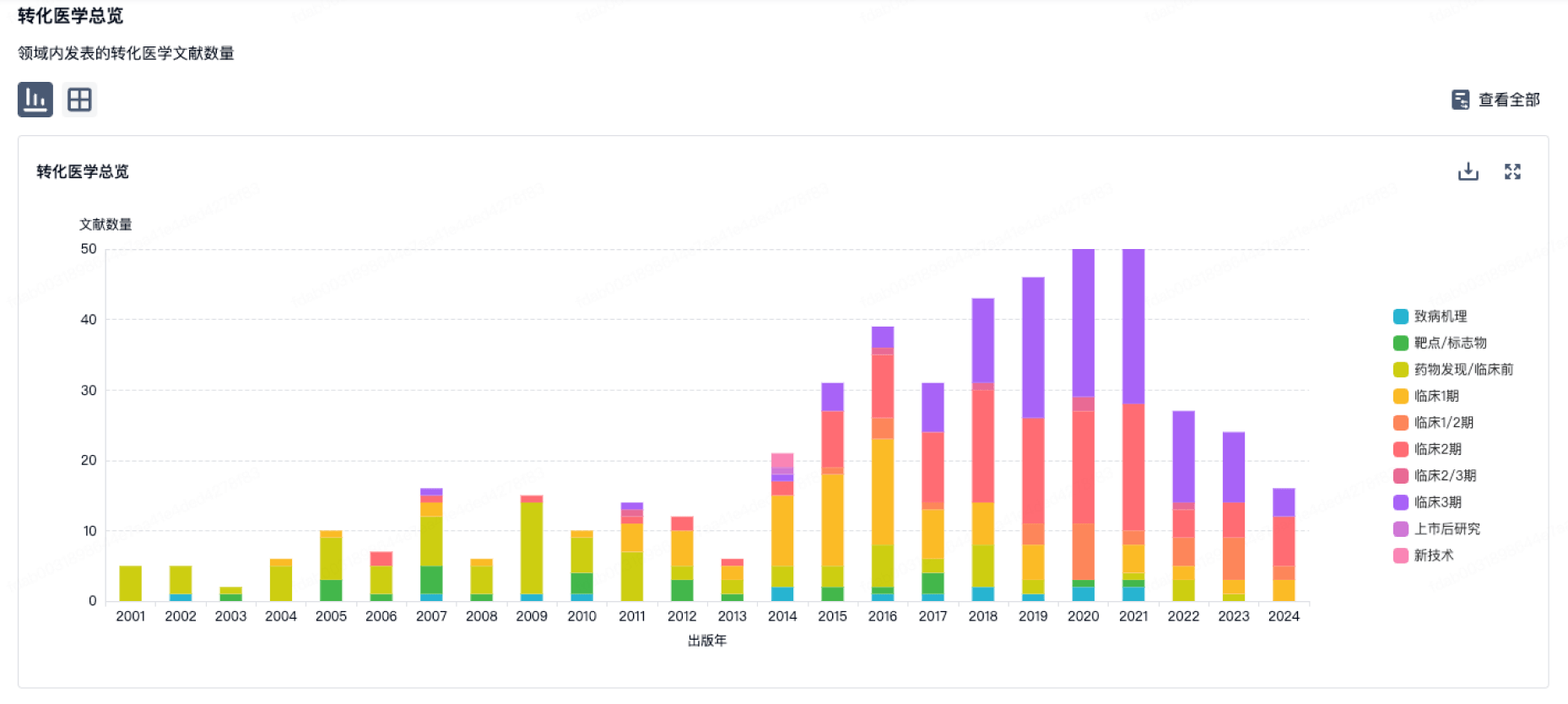
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用