预约演示
更新于:2025-06-28

Guangdong Jincheng Jinsu Pharmaceutical Co Ltd.
更新于:2025-06-28
概览
关联
4
项与 广东金城金素制药有限公司 相关的临床试验CTR20241322
中国健康受试者空腹和餐后单次口服头孢地尼干混悬剂的随机、开放、两序列、两周期、双交叉设计的生物等效性试验
主要研究目的
研究空腹和餐后状态下单次口服受试制剂头孢地尼干混悬剂(规格:250mg/5ml,广东金城金素制药有限公司提供)与参比制剂头孢地尼干混悬剂(规格:250mg/5ml,持证商:Aurobindo Pharma Limited),在健康成年受试者体内的药代动力学,评价空腹和餐后口服两种制剂的生物等效性。
次要研究目的
评价中国健康受试者空腹和餐后状态下,单次口服受试制剂头孢地尼干混悬剂和参比制剂头孢地尼干混悬剂后的安全性。
开始日期2024-05-06 |
申办/合作机构 |
CTR20232503
青霉素V钾片随机、开放、单剂量、两制剂、自身交叉对照设计在中国健康受试者中的生物等效性正式试验。
主要目的:以广东金城金素制药有限公司的青霉素V钾片为受试制剂;并以Sandoz GmbH持证的青霉素V钾片为参比制剂,进行生物等效性正式试验。
开始日期2023-09-11 |
申办/合作机构 |
CTR20232399
苯磺酸氨氯地平口崩片(规格:10mg)在健康受试者中空腹及餐后状态下的单剂量、随机、开放、两周期、两序列、自身交叉设计的生物等效性试验
主要研究目的
研究空腹和餐后状态下单次口服受试制剂苯磺酸氨氯地平口崩片(规格:10mg,深圳信立泰药业有限公司生产,广东金城金素制药有限公司持证)与参比制剂苯磺酸氨氯地平口崩片(商品名:ノルバスク®,规格:10mg,ヴィアトリス製薬株式会社生产,ヴィアトリス製薬株式会社持证)在健康成年受试者体内的药代动力学,初步评价空腹和餐后口服两种制剂的生物等效性。
次要研究目的
评价健康受试者空腹和餐后单次口服受试制剂(T)苯磺酸氨氯地平口崩片和参比制剂(R)苯磺酸氨氯地平口崩片(ノルバスク®)后的安全性。
开始日期2023-08-02 |
申办/合作机构 |
100 项与 广东金城金素制药有限公司 相关的临床结果
登录后查看更多信息
0 项与 广东金城金素制药有限公司 相关的专利(医药)
登录后查看更多信息
25
项与 广东金城金素制药有限公司 相关的新闻(医药)2025-06-11
·摩熵医药
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需要得到授权。PART 01周报概述随着全球医药行业的快速发展,新药研发与创新已成为推动行业进步的重要动力。近期,根据摩熵医药数据统计,新药申请与审批获批频繁,显示出医药创新领域的活跃态势。本文将深入分析2025年6月2日至2025年6月8日期间,国内外新药申请、临床试验批准、仿制药一致性评价等多个方面的最新进展,为用户提供全面的行业资讯。PART 02国内24款新药IND获批根据摩熵医药数据库统计,2025年6月2日至6月8日期间共有58个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号43个,进口药品受理号15个。本周共计24款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药10款,生物药12款,中药2款。本周获批临床创新药/改良型新药部分信息速览(不含补充申请)注:完整数据可识别“文末”二维码下载查看PART 03本周全球TOP10创新药研发进展在全球创新药研发领域,6月4日,中国国家药监局(NMPA)官网公示,康方生物研发的PD-1/CTLA-4双特异性抗体卡度尼利单抗注射液的一项新适应症上市申请已获得批准。该药本次获批的适应症为:卡度尼利单抗加含铂化疗联合/不联合贝伐珠单抗用于一线治疗持续、复发或转移性宫颈癌。卡度尼利是康方生物自主研发的PD-1/CTLA-4双特异性肿瘤免疫治疗药物,最早于2022年6月获NMPA批准,用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。2024年9月,该药再次获NMPA批准联合奥沙利铂和卡培他滨(XELOX)一线治疗不可手术切除的局部晚期复发或转移性胃或胃食管结合部(G/GEJ)腺癌。相关临床研究数据显示,卡度尼利与PD-1单抗联合CTLA-4单抗的联合疗法相比,毒性显著降低,具有明显的安全性和疗效优势。6月5日,和黄医药和信达生物联合宣布,呋喹替尼(fruquintinib)和信迪利单抗(sintilimab)联合疗法用于治疗既往接受过一种酪氨酸激酶抑制剂治疗失败的局部晚期或转移性的肾细胞癌患者的新药上市申请已获中国国家药品监督管理局(NMPA)受理。此次上市申请是基于FRUSICA-2研究的数据。FRUSICA-2 是一项随机、开放标签、阳性对照的注册研究,旨在评估信迪利单抗和呋喹替尼联合疗法对比阿昔替尼或依维莫司单药疗法用于二线治疗晚期肾细胞癌的疗效和安全性。呋喹替尼和信迪利单抗的联合疗法于2024年12月取得国家药监局附条件批准,用于治疗既往系统性抗肿瘤治疗后失败且不适合进行根治性手术治疗或根治性放疗的晚期错配修复完整(pMMR)子宫内膜癌患者。本周全球 TOP10 创新药研发进展截图来源:摩熵咨询周报PART 04本周全球TOP10临床试验结果本周全球TOP10临床结果中,6月3日,信达生物在2025年美国临床肿瘤学会(ASCO)年会上口头报道了IBI343(创新型抗CLDN18.2 ADC)治疗晚期胰腺癌临床1期研究数据更新。本项研究为一项1a/1b期剂量递增和剂量扩展研究(NCT05458219),本次大会公布了扩展队列的最新研究数据:截至2025年3月14日,共有83例胰腺癌患者接受了至少一次IBI343治疗,中位随访时间为11.1个月。截至数据截止日期,6mg/kg剂量组CLDN18.2 1+2+3+≥60%的44例受试者中,确认的客观缓解率(cORR)为 22.7%,疾病控制率(DCR)为 81.8%,中位PFS为5.4 个月;中位OS为9.1个月。其中既往仅接受过一线治疗受试者(N=17)的中位PFS为5.4个月,中位OS长达12.1个月;既往仅接受过两线治疗受试者(N=18)的中位PFS为5.3个月,中位OS为9.1个月。安全性方面,总体耐受性良好,消化道毒性低,未出现新的安全信号。98.8%受试者发生治疗期间不良事件 (TEAE),常见的TEAE为贫血、中性粒细胞计数减少、白细胞计数减少。≥3级恶心、呕吐发生率均为0。根据新闻稿,在经过更长时间的随访后,基于更成熟的PFS和OS数据,IBI343在治疗CLDN18.2表达阳性的晚期胰腺癌患者中展现出优秀的治疗潜力,有望在这一难治癌种中实现突破。本周全球 TOP10 积极/失败临床结果 截图来源:摩熵咨询周报PART 05110款品种过评,广东金城金素制药领跑根据摩熵医药数据库统计,2025年6月2日至6月8日期间共有85项仿制药申报上市/申报临床获CDE承办,其中新注册分类上市申请受理号70项(包括化药3类,4类),新注册分类临床申请受理号5项(包括化药3类,4类),一致性评价申请10项。本周8个品种通过一致性评价(按受理号计10项),本周102个品种视同通过一致性评价(按受理号计166项)。本周有4项生物类似物注册申报动态,是复宏汉霖的重组抗CTLA-4全人源单抗注射液,石药集团的度普利尤单抗注射液(按受理号计2项)和信立泰的SAL-023注射液。截图来源:摩熵咨询周报本周过评/视同过评品种主要为心血管系统药物;过评/视同过评产品剂型主要为注射剂;本周腺苷钴胺胶囊过评/视同过评受理号数量最多达5个,本周达可替尼片和他达拉非片过评/视同过评企业最多达6家;本周浙江高跖医药科技股份有限公司、山东齐都药业有限公司和成都苑东生物制药股份有限公司过评/视同过评品种数最多达3种,本周过评/视同过评企业共包括广东金城金素制药有限公司、浙江高跖医药科技股份有限公司和山东齐都药业有限公司等123家企业。截图来源:摩熵咨询周报本周有甲硝唑凝胶、小儿复方氨基酸注射液(19AA-Ⅰ-SF)、阿司匹林维生素C泡腾片、门冬氨酸帕瑞肽注射液、塞来昔布片、盐酸屈他维林片6个品种首次过评/视同过评。截图来源:摩熵咨询周报本周有曲伏前列素滴眼液、比索洛尔氨氯地平片、门冬氨酸钾注射液、生理氯化钠溶液4个品种过评/视同过评达7家企业。截图来源:摩熵咨询周报摩熵咨询本期完整周报识别二维码领取下载END本文为原创文章,转载请留言获取授权近期热门资源获取数据透视:中药创新药、经典验方、改良型新药、同名同方的申报、获批、销售情况-2025042023H2-2024H1中国药品分析报告-2025042024年中国1类新药靶点白皮书-202503中国AI医疗健康企业创新发展百强榜单-202502解码护肤抗衰:消费偏好洞察与市场格局分析-2025022024年FDA批准上市的新药分析报告-2025012024年NMPA批准上市的新药分析报告-2025012024年医保谈判及市场分析报告-2025.012024年中国医疗健康投融资全景洞察报告-202501小分子化药白皮书(上)-2025012024医美注射材料市场发展分析报告-202412中国放射性药物产业白皮书-202410近期更多摩熵咨询热门报告,识别下方二维码领取联系我们,体验摩熵医药更多专业服务会议合作园区服务数据库咨询定制服务媒体合作👆👆👆点击上方图片,即可开启摩熵化学数据查询点击阅读原文,申请摩熵医药企业版免费试用!
临床申请申请上市一致性评价
2025-04-23
·摩熵医药
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需要得到授权。PART 01周报概述随着全球医药行业的快速发展,新药研发与创新已成为推动行业进步的重要动力。近期,根据摩熵医药数据统计,新药申请与审批获批频繁,显示出医药创新领域的活跃态势。本文将深入分析2025年4月14日至2025年4月20日期间,国内外新药申请、临床试验批准、仿制药一致性评价等多个方面的最新进展,为用户提供全面的行业资讯。PART 02国内52款新药IND获批根据摩熵医药数据库统计,2025年4月14日至2025年4月20日期间共有62个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号44个,进口药品受理号18个。本周共计52款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药16款,生物药32款,中药4款。本周获批临床创新药/改良型新药(部分)信息速览(不含补充申请)注:完整数据可识别“文末”二维码下载查看PART 03本周全球TOP10创新药研发进展在全球创新药研发领域,4月14日,ALX Oncology公司宣布,其针对EGFR表达实体瘤的潜在“best-in-class”及“first-in-class”抗体偶联药物(ADC)ALX2004的IND申请已获FDA批准。ALX2004是通过该公司专有的拓扑异构酶I抑制剂有效载荷平台设计的,由三部分组成,分别是经优化的抗EGFR抗体骨架、稳定性增强的连接子,以及能产生强旁观者效应的专有拓扑异构酶I载荷,旨在克服早期EGFR靶向ADC因药物设计、脱靶毒性及传统载荷局限性导致的临床瓶颈。同日,默沙东宣布,佳达修9[九价人乳头瘤病毒疫苗(酿酒酵母)](后称“九价HPV疫苗”)多项新适应证已获得中国国家药品监督管理局(NMPA)的上市批准,适用于16~26岁男性接种。这一获批使佳达修9成为中国获批、可适用于适龄男性女性接种的九价HPV疫苗。佳达修9覆盖6、11、16、18、31、33、45、52 和 58 型,共九种HPV型别。此次获批的男性适应证可预防HPV16、18引起的肛门癌,HPV6和11引起的生殖器疣(尖锐湿疣),由HPV6、11、16、18引起的以下癌前病变或不典型病变:1级、2级、3级肛门上皮内瘤样病变(AIN)。本周全球 TOP10 创新药研发进展截图来源:摩熵咨询周报PART 04本周全球TOP10临床试验结果本周全球TOP10临床结果中,4月14日,Cerevance公司公布了其钾双孔结构域通道亚家族K成员13(KCNK13)抑制剂CVN293的积极1期临床试验结果。CVN293是一种高选择性口服KCNK13抑制剂,旨在通过抑制神经炎症减缓神经退行性疾病进展,KCNK13是一种潜在的NLRP3炎性小体激活的新型调节因子。1期临床试验结果显示,接受CVN293单次和14天内多次给药的健康成人对该药物的耐受性良好,100%的受试者完成了试验,未出现剂量限制性毒性、治疗相关停药或具临床意义的生命体征异常,所有不良事件均为轻度。CVN293还显示出强大的脑渗透性,支持KCNK13抑制剂对以神经炎症为特征的神经退行性疾病的效用。本周全球 TOP10 积极/失败临床结果截图来源:摩熵咨询周报PART 0552款品种过评,山东新时代领跑根据摩熵医药数据库统计,2025年4月14日至2025年4月20日期间共有93项仿制药申报上市/申报临床获CDE承办,其中新注册分类上市申请受理号81项(包括化药3类,4类),新注册分类临床申请受理号7项(包括化药3类,4类),一致性评价申请5项。本周11个品种通过一致性评价(按受理号计20项),本周41个品种视同通过一致性评价(按受理号计55项)。本周有2项生物类似物注册申报动态,分别是亿帆医药(上海)有限公司的甘精胰岛素注射液和成都康弘生物科技有限公司的KH-813注射液。截图来源:摩熵咨询周报本周过评/视同过评品种主要为系统用抗感染药物;过评/视同过评产品剂型主要为注射剂;本周注射用头孢他啶过评/视同过评受理号数量最多达6个,本周注射用头孢他啶和磷酸奥司他韦干混悬剂过评/视同过评企业最多达3家;本周山东新时代药业有限公司、广东金城金素制药有限公司、江苏知原药业股份有限公司和江苏万高药业股份有限公司过评/视同过评品种数最多达2种,其余各企业过评/视同过评品种数紧随其后,本周过评/视同过评企业共包括山东新时代药业有限公司、广东金城金素制药有限公司和江苏知原药业股份有限公司等57家企业。截图来源:摩熵咨询周报本周有蒙脱石混悬液、盐酸伐地那非口腔崩解片、盐酸拉贝洛尔氯化钠注射液、盐酸哌甲酯缓释片、注射用头孢比罗酯钠、注射用硫酸多粘菌素B 6个品种首次过评/视网过评。本周首次过评/视同过评品种截图来源:摩熵咨询周报本周有洛索洛芬钠凝胶贴膏、硝酸甘油注射液2个品种过评/视同过评达7家企业。本周过评/视同过评达7家企业品种截图来源:摩熵咨询周报摩熵咨询本期完整周报识别二维码领取下载往期周报回顾#43款新药IND获批!59款品种过评,石家庄四药过评领跑…#64款新药IND获批!12款品种过评,河北天成药业领跑…#58款新药IND获批!47款品种过评,齐鲁制药领跑…#43款新药IND获批!67款品种过评,晖致医药过评领跑…END本文为原创文章,转载请留言获取授权近期热门资源获取数据透视:中药创新药、经典验方、改良型新药、同名同方的申报、获批、销售情况-2025042023H2-2024H1中国药品分析报告-2025042024年中国1类新药靶点白皮书-202503中国AI医疗健康企业创新发展百强榜单-202502解码护肤抗衰:消费偏好洞察与市场格局分析-2025022024年FDA批准上市的新药分析报告-2025012024年NMPA批准上市的新药分析报告-2025012024年医保谈判及市场分析报告-2025.012024年中国医疗健康投融资全景洞察报告-202501小分子化药白皮书(上)-2025012024医美注射材料市场发展分析报告-202412中国放射性药物产业白皮书-202410近期更多摩熵咨询热门报告,识别下方二维码领取联系我们,体验摩熵医药更多专业服务会议合作园区服务数据库咨询定制服务媒体合作👆👆👆点击上方图片,即可开启摩熵化学数据查询点击阅读原文,申请摩熵医药企业版免费试用!
临床申请申请上市疫苗抗体药物偶联物
2025-04-23
·药智网
此前,国内只有一款注射用硫酸多黏菌素B获批上市,上市许可持有人为上药第一生化药业。药智数据显示,2017年—2024年,注射用硫酸多黏菌素B的国内公立医疗机构销售额超61亿元,并且曾在2022年单年突破15亿元,成为无数药企艳羡的黄金大单品。2023年开始,国内注射用硫酸多黏菌素B销售额开始下跌,2024年同比直降51.17%,单年销售额跌至10亿元以下(6.95亿元)。急剧萎缩的存量市场背后,却是23家药企(联合申报,计算为1家)残酷的争夺战。近期,随着雅赛利医药咨询(上海)申报的进口5.2类仿制药注射用硫酸多黏菌素B获批进口,率先成为国内首家视同过评品种、打响激烈的竞争战后,幕后还有23家药企已经在竞逐之路上。竞争格局,悄然生变。1重获“新生”的抗感染药多黏菌素类药物是一类具有重要抗感染价值的抗菌药物,其发展历程充满了起伏与转折。多黏菌素于1947年被发现,是由多粘类芽孢杆菌产生的抗菌多肽。20世纪50年代,多黏菌素类药物在临床上用于治疗革兰氏阴性菌感染,在日本、欧洲及美国等国家和地区都曾被广泛使用。然而,由于其具有明显的肾毒性和神经毒性,随着更安全有效的抗菌药物的出现,多黏菌素类药物逐渐被替代,淡出了临床。进入21世纪后,在日益严峻的耐药形势下,尤其是碳青霉烯耐药肠杆菌和鲍曼不动杆菌等“超级耐药菌”广泛流行的背景下,人们被迫重新选择多黏菌素这一老药,使其成为了治疗多重耐药革兰阴性菌感染的“最后一道防线”。在国内,注射用硫酸多黏菌素B市场曾长期由上海上药第一生化药业独占。近日,雅赛利医药咨询(上海)申报的注射用硫酸多黏菌素B获批进口,并成为国内首家视同过评的产品,打破了上药第一生化一家独大的局面。值得注意的是,随着耐药菌感染问题的日益严重,注射用硫酸多黏菌素B的临床需求曾不断增加,市场规模迅速扩大。药智数据显示,2022年注射用硫酸多黏菌素B的国内公立医疗机构销售额高达15.95亿元,达到销售峰值,但在近两年的销售额逐渐回落,2024年跌至10亿元以下。图1 2017年—2024年,注射用硫酸多黏菌素B的国内公立医疗机构销售额图片来源:药智数据可以说,注射用硫酸多黏菌素B在国内有过销售高光时刻,但随着市场需求减少,存量市场开始起伏不定。更为残酷的是,急剧萎缩的市场背后,却有23家药企(联合申报,计算为1家)的竞相追逐。223家药企「血战」随着众多药企纷纷布局注射用硫酸多黏菌素B,其国内竞争格局逐渐白热化。国内23家申报在国内市场,众多国内药企纷纷崛起,试图打破原有的市场格局。药智数据显示,健康元海滨药业有限公司、博瑞制药(苏州)有限公司、合肥亿帆生物制药有限公司、广东金城金素制药有限公司等国内23家药企(联合申报,计算为1家)在近两年时间内均提交了注射用硫酸多黏菌素B的上市申请,竞争态势愈发激烈。表1 国内注射用硫酸多黏菌素B竞争格局数据来源:药智数据桂林南药股份有限公司作为国内抗疟药领域的知名企业,在注射用硫酸多黏菌素B的研发上也投入巨大,其丰富的制药经验使其在产品质量和生产工艺优化方面具有一定优势。齐鲁制药(海南)有限公司等大型综合性制药企业也凭借强大的研发和生产能力,在该产品的研发和生产上展现出了强大的实力,尤其是拥有广泛的销售渠道和完善的市场推广体系,也将成为其在市场竞争中的重要优势,后续有望推动其在注射用硫酸多黏菌素B市场中快速站稳脚跟并不断扩大市场份额。进口产品“虎视眈眈”近期,雅赛利医药咨询(上海)申报的注射用硫酸多黏菌素B获批进口,并成为国内首家视同过评的产品,为国内市场的竞争增添了许多不确定性。一方面,进口的注射用硫酸多黏菌素B具有较高的品质和国际认可度,在品牌影响力、研发实力和产品质量控制等方面具有一定的先天优势,这使得其在市场推广过程中更容易获得部分医疗机构和患者的信任,从而占据一定的市场份额。另一方面,进口产品在国际市场上的价格相对较高,但其在进入国内市场后,可能会凭借其品牌和质量优势,采取相对灵活的定价策略,对国内企业的定价和利润空间产生一定的挤压效应。不过,进口产品也面临一些问题,如进口产品在本地化服务方面相对不足,对于国内医疗机构的个性化需求响应速度可能较慢,这在一定程度上也会影响其市场份额的进一步扩大。3争夺战背后年销仅7亿品种,却引来23家药企激烈竞争,国内药企在注射用硫酸多黏菌素B品种上的申报热潮,成为医药行业“跟风效应”的缩影,也折射出国内药企在研发过程中的一些深层问题。首先,注射用硫酸多黏菌素B销售额并不算特别突出,但众多药企却竞相投入研发和申报,一方面,国内医药市场环境复杂多变,集采常态化使得药品价格下降,压缩了企业的利润空间。药企为了寻找新的增长点,往往会将目光投向一些具有潜在市场需求的品种,但在研发速度或是品种前期立项上,出现了一些问题,导致产品还未上市,产品的市场已经缩小。另一方面,国内药企在创新研发上整体投入和能力相对薄弱。与开拓全新领域或研发具有差异化的产品相比,对已有品种进行仿制或改进,技术门槛较低,研发周期相对较短,能够更快地推向市场以获取收益。在这样的背景下,众多药企便一拥而上,扎堆申报这一品种。跟风效应下,大量的人力、物力、财力等资源被集中投入这一品种的研发和申报中,而一些更具创新性和临床价值的项目却可能因资源的匮乏而被搁置。这不仅导致了资源的浪费,也使得整个行业的研发效率和发展潜力受到限制。要破解这种内卷局面,药企需要从战略层面进行深度思考和调整。首先,药企应提升自主创新能力,加大对新技术、新靶点等方面的研发投入,着力开发具有独特优势和差异化的产品管线。其次,药企应积极拓展国际市场,提升产品的国际竞争力。通过技术转移、合作开发等方式,使产品符合国际标准,不仅可以减轻国内市场的竞争压力,还能为企业带来更广阔的发展空间和更高的利润回报。最后,监管部门和行业协会应加强对药企研发申报的引导。合理规划产业布局,避免资源过度集中于少数品种,推动行业有序发展。同时,优化审评审批流程,鼓励真正的创新和差异化产品,为有潜力的创新药企提供更多的政策支持和发展空间。药企的跟风效应并非不可改变的命运。通过提升创新能力、拓展国际市场以及加强政策引导等多方面的努力,完全有可能摆脱这种内卷的困境,实现从“跟风者”到“引领者”的转变。参考来源:1.药智数据2.https://mp.weixin.qq.com/s/WLqD754y4YxkUNPpxekObw3.https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20250414152959179.html4.https://www.gov.cn/zhengce/2022-02/01/content_5671569.htm声明:本内容仅用作医药行业信息传播,为作者独立观点,不代表药智网立场。如需转载,请务必注明文章作者和来源。对本文有异议或投诉,请联系maxuelian@yaozh.com。责任编辑 | 史蒂文合作、投稿、转载开白 | 马老师 18323856316(同微信) 阅读原文,是受欢迎的文章哦
上市批准申请上市
100 项与 广东金城金素制药有限公司 相关的药物交易
登录后查看更多信息
100 项与 广东金城金素制药有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年07月19日管线快照
无数据报导
登录后保持更新
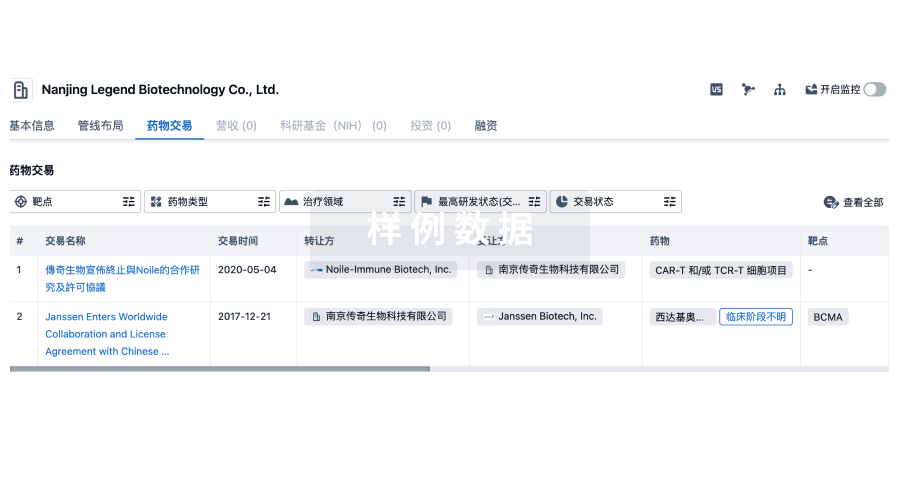
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
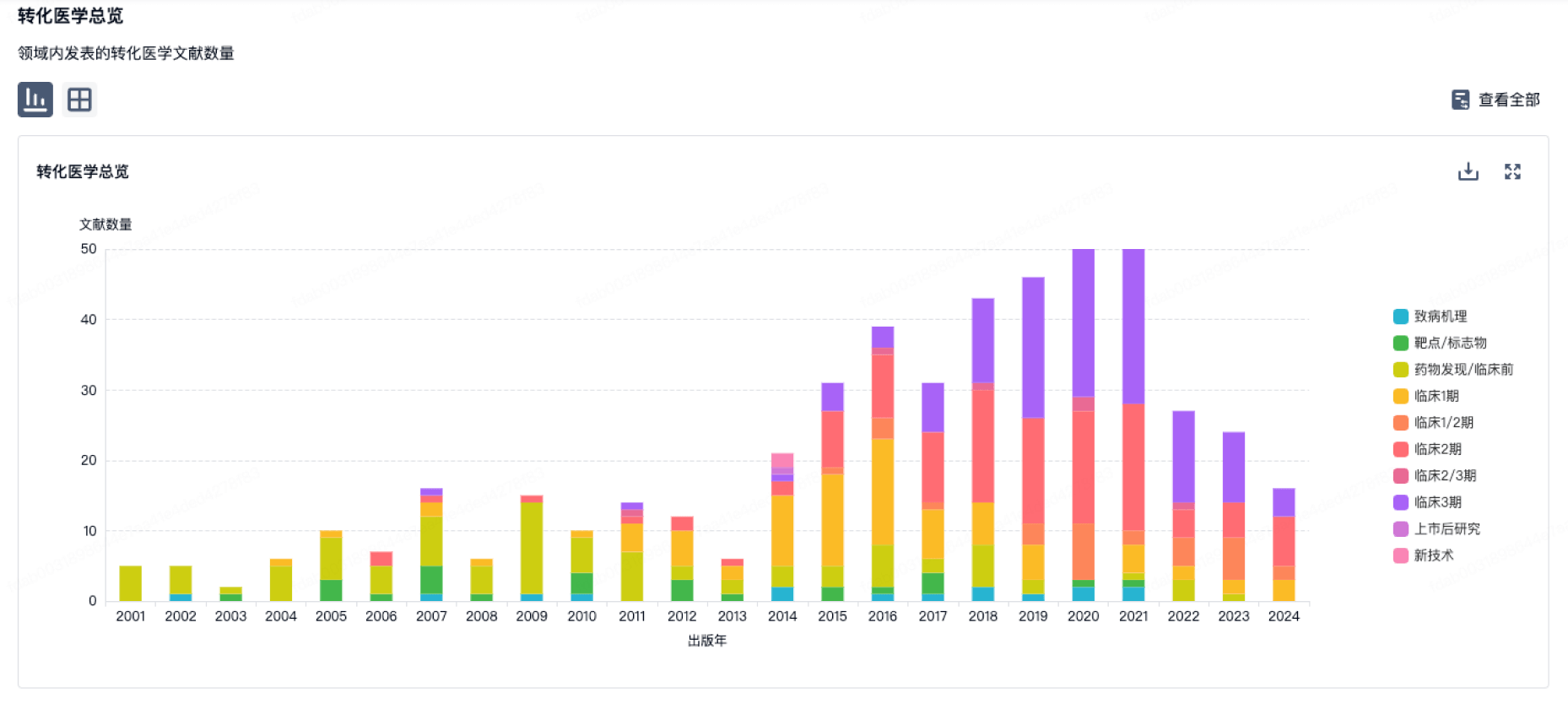
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
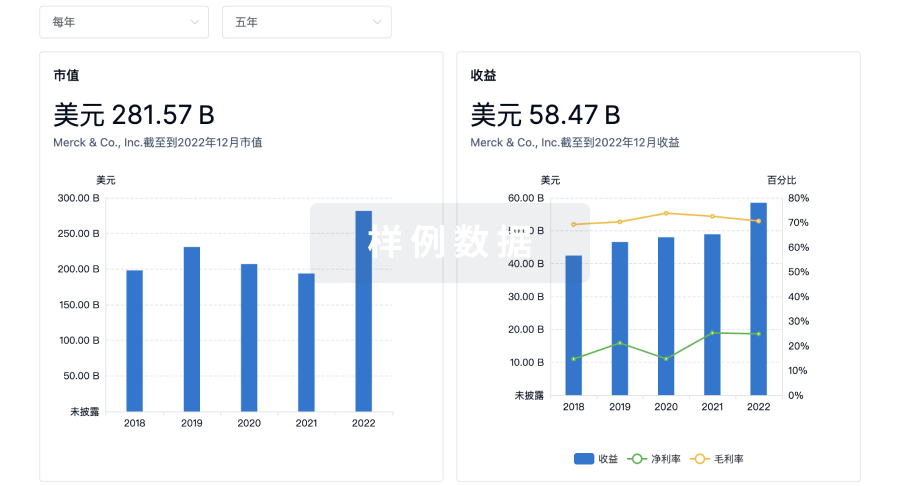
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
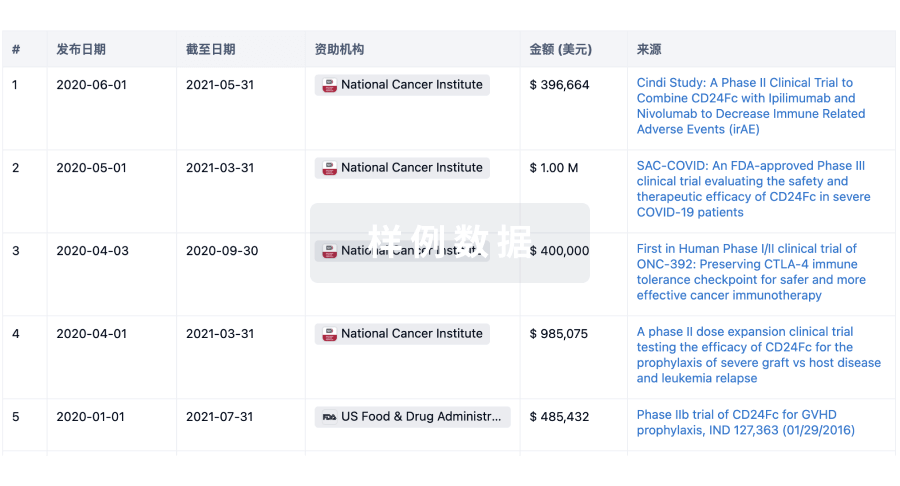
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用