|
|
|
|
|
|
最高研发阶段批准上市 |
|
首次获批日期2023-03-22 |
Multicentre, Randomised, Double-blind Study Assessing the Efficacy and Safety of Penthrox® Combined With a Standard Analgesia (SoC) in Comparison to a Placebo Combined With a Standard Analgesia (SoC) in Adult Patients Admitted to the Emergency Department With Moderate to Severe Pain Associated With Trauma
A phase 4 randomised, double-blind study to assess the efficacy and safety of Penthrox® used from the outset in multimodal analgesia, in combination with the standard analgesic protocol used in the department, for conscious adult patients presenting in an emergency department with moderate to severe pain associated with a trauma
Study of Efficacy of OXN PR, Compared to Oxy PR, for Reduction of Intensity of Opioid-induced Constipation Symptoms in Pts Treated for Cancer or Non-cancer Pain: A Randomised, Double-blind, Controlled, Multicentre Study
The primary objective of this trial is to study the efficacy of oxycodone/naloxone prolonged release tablets (OXN PR), compared to oxycodone prolonged release tablets (Oxy PR), for the reduction of the intensity of opioid-induced constipation symptoms in patients treated for cancer or non-cancer pain.
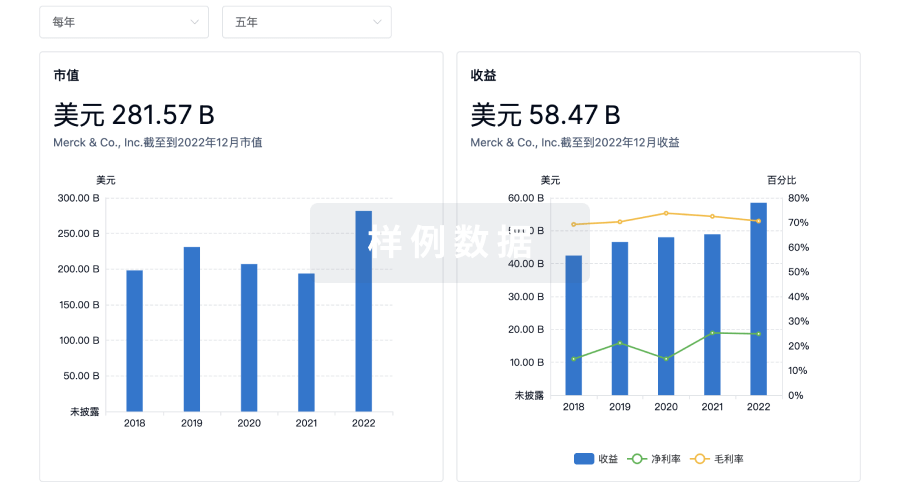
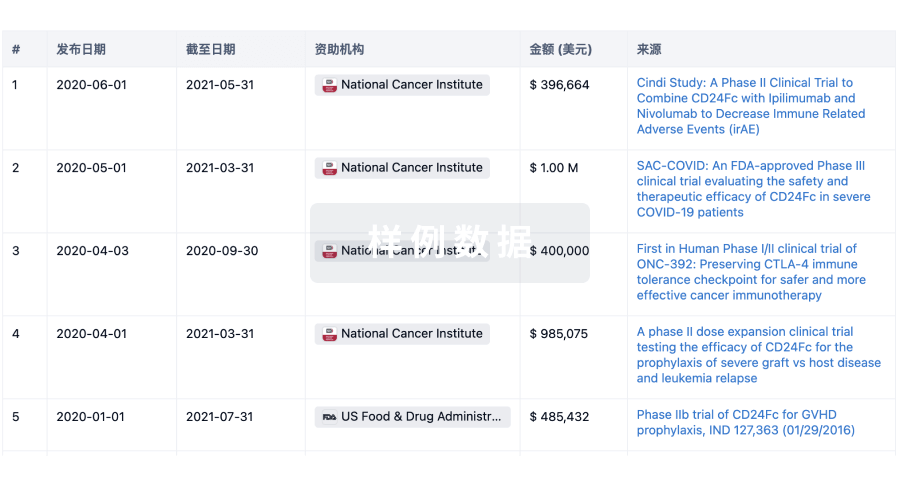
100 项与 Mundipharma, Inc. 相关的临床结果
0 项与 Mundipharma, Inc. 相关的专利(医药)
2月26日,中国国家药监局药品审评中心(CDE)官网最新公示,由萌蒂制药(Mundipharma)申报的5.1类新药注射用醋酸瑞扎芬净的新药上市申请已获得受理。公开资料显示,瑞扎芬净(rezafungin)是一种环肽药物,是一种创新、一周一次的棘球白素(echinocandin),其已经于2023年3月获得美国FDA批准,用于治疗没有替代治疗选择或选择有限的念珠菌血症与侵袭性念珠菌病患者。
念珠菌是一种酵母菌,经常寄生于皮肤、口腔、消化道与阴道中,通常并不致病,但在某些情况下可能造成这些部位浅表的感染,尤其在孕妇,罹患糖尿病、癌症、艾滋病等疾病的病患,以及服用抗生素的患者中更为常见。念珠菌感染很少有生命危险,但侵袭性念珠菌病除外。侵袭性念珠菌病主要发生于免疫功能低下与住院患者间,是最常见的医院获得性感染之一。而念珠菌血症则是侵袭性念珠菌最常见的形式,是一种严重的血流感染,经常发生在进行大手术或使用静脉导管与某些抗生素的患者中,若不经及时治疗,可能会造成生命危险。
瑞扎芬净是一种创新、一周一次的棘球白素(echinocandin),用以治疗与避免严重性的真菌感染,例如念珠菌血症与侵袭性念珠菌病。公开资料显示,该产品通过抑制β-1,3-D-葡聚糖合成酶,进而抑制真菌细胞壁的合成从而发挥抗真菌作用。从结构上来看,该产品是由阿尼芬净衍生而来的一种带有亲脂性尾巴的环状六肽,与其它棘白菌素相比,在C5鸟氨酸位置的胆碱结构增加了其在体外和体内的稳定性,从而可能增加治疗的疗效与安全性。
根据公开资料,瑞扎芬净最初由Cidara Therapeutics开发,萌蒂制药此前通过合作拥有rezafungin在美国和日本以外的商业权利。2024年4月,Cidara Therapeutics宣布将rezafungin的所有权利剥离给萌蒂制药。
瑞扎芬净此前已经获得美国FDA授予快速通道资格与合格传染病产品资格(QIDP),并于美国与欧洲获得孤儿药资格用以治疗侵袭性念珠菌病。2023年3月,FDA批准该产品上市,用于治疗没有替代治疗选择或选择有限的念珠菌血症与侵袭性念珠菌病。这一批准是根据全球性ReSTORE临床3期试验与STRIVE临床2期试验结果。数据分析显示,与现有必须每天进行注射的标准疗法药物相较,一周一次给药的瑞扎芬净达到非劣效性。此结果达成美国FDA与欧洲药品管理局(EMA)的主要终点标准。2023年12月,该产品于欧盟获批上市。
根据中国药物临床试验登记与信息公示平台官网,研究人员在中国也已经完成一项瑞扎芬净的国际多中心(含中国)3期临床研究,针对适应症为念珠菌血症和/或侵袭性念珠菌病。
本次这款创新产品在中国申报上市,意味着其在中国的注册进程迎来重要进展。
参考资料:
[1]中国国家药监局药品审评中心官网.Retrieved Feb 25, 2025, from https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
[2]CIDARA THERAPEUTICS ANNOUNCES DIVESTITURE OF REZAFUNGIN TO MUNDIPHARMA* TO FOCUS ON ADVANCING THE CLINICAL DEVELOPMENT OF CLOUDBREAK DFC PIPELINE. Retrieved Apr 24, 2024, from https://www.cidara.com/news/cidara-therapeutics-announces-divestiture-of-rezafungin-to-mundipharma-to-focus-on-advancing-the-clinical-development-of-cloudbreak-dfc-pipeline/
[3]Cidara Therapeutics and Melinta Therapeutics Announce FDA Approval of REZZAYO™ (rezafungin for injection) for the Treatment of Candidemia and Invasive Candidiasis. Retrieved March 22, 2023, from https://www.globenewswire.com/news-release/2023/03/22/2632765/0/en/Cidara-Therapeutics-and-Melinta-Therapeutics-Announce-FDA-Approval-of-REZZAYO-rezafungin-for-injection-for-the-Treatment-of-Candidemia-and-Invasive-Candidiasis.html
内容来源于网络,如有侵权,请联系删除。

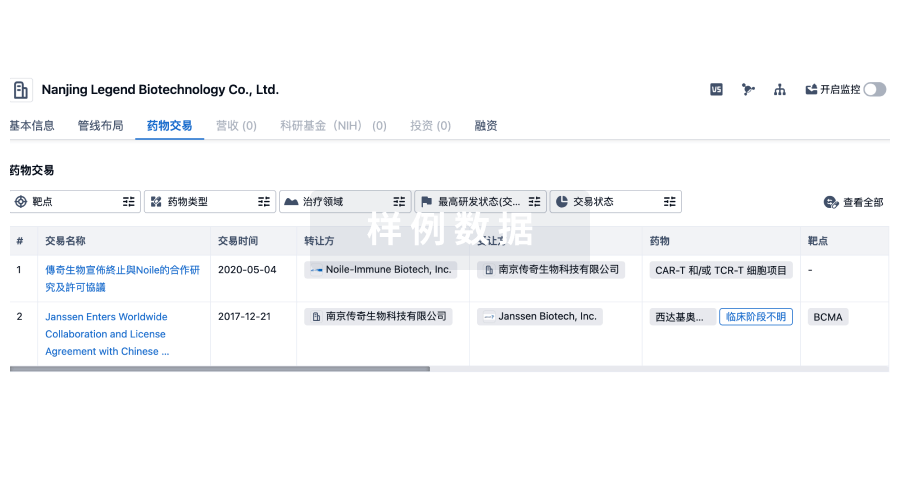
100 项与 Mundipharma, Inc. 相关的药物交易
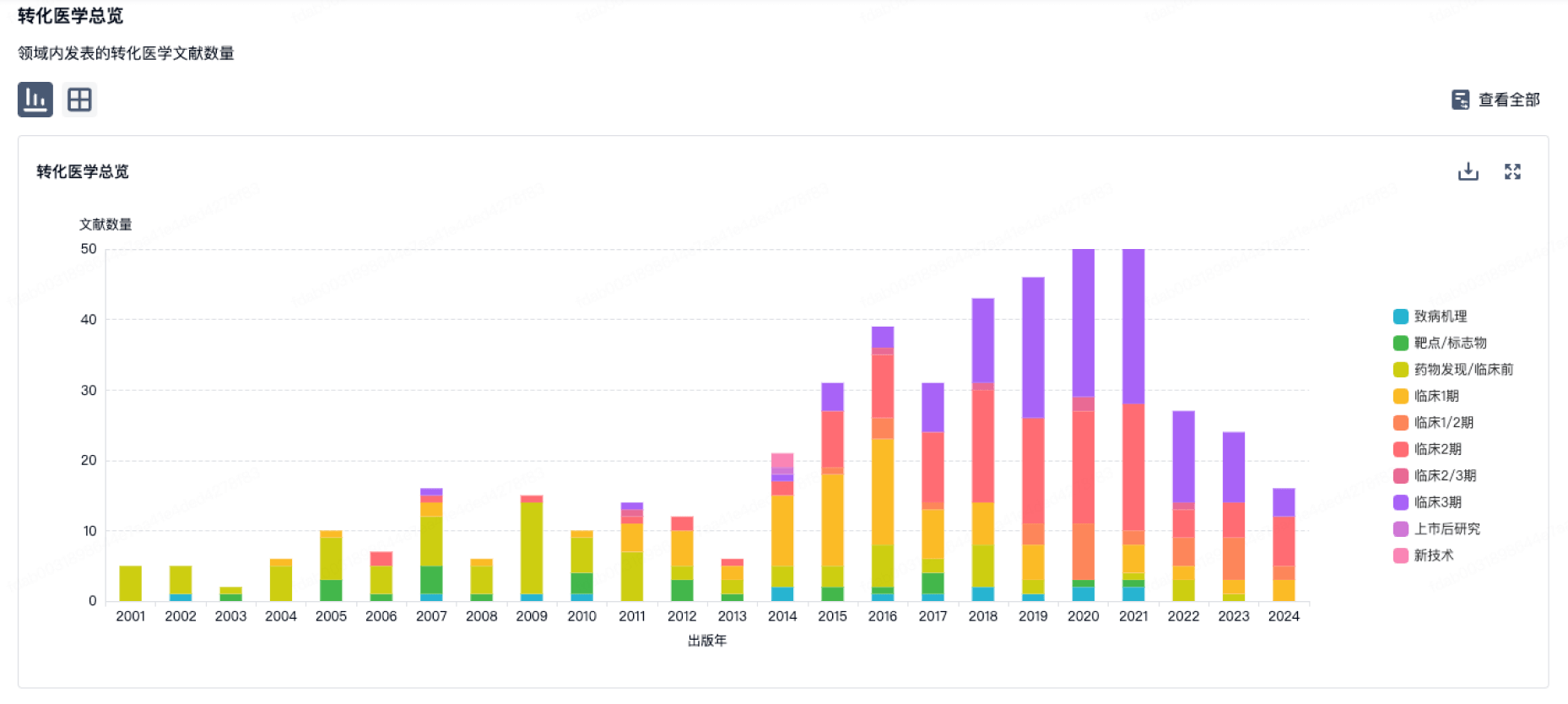
100 项与 Mundipharma, Inc. 相关的转化医学