预约演示
更新于:2025-06-24

Northwestern Polytechnical University
更新于:2025-06-24
概览
标签
肿瘤
皮肤和肌肉骨骼疾病
其他疾病
蛋白水解靶向嵌合体(PROTAC)
小分子化药
化学药
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| 蛋白水解靶向嵌合体(PROTAC) | 23 |
| 小分子化药 | 4 |
| 化学药 | 2 |
| 排名前五的靶点 | 数量 |
|---|---|
| HK2(己糖激酶II型) | 23 |
| BRD4(溴结构域蛋白-4) | 1 |
| PDE3 x STAT3 | 1 |
| DHODH(双氢乳清酸酯脱氢酶) | 1 |
关联
29
项与 西北工业大学 相关的药物2
项与 西北工业大学 相关的临床试验ChiCTR2000041473
Study on the effect of Daoyin on the prevention and treatment of ametropia
开始日期2020-12-31 |
申办/合作机构 |
ChiCTR2000040613
Study on The Effects of Tai Chi and Daoyin on the Prevention and Treatment of Chronic Diseases
开始日期2020-12-05 |
申办/合作机构 |
100 项与 西北工业大学 相关的临床结果
登录后查看更多信息
0 项与 西北工业大学 相关的专利(医药)
登录后查看更多信息
37,014
项与 西北工业大学 相关的文献(医药)2026-02-01·Neural Regeneration Research
Is age-related myelinodegenerative change an initial risk factor of neurodegenerative diseases?
Article
作者: Wu, Shuangchan ; Chen, Jun
Myelination, the continuous ensheathment of neuronal axons, is a lifelong process in the nervous system that is essential for the precise, temporospatial conduction of action potentials between neurons. Myelin also provides intercellular metabolic support to axons. Even minor disruptions in the integrity of myelin can impair neural performance and increase susceptibility to neurological diseases. In fact, myelin degeneration is a well-known neuropathological condition that is associated with normal aging and several neurodegenerative diseases, including multiple sclerosis and Alzheimer’s disease. In the central nervous system, compact myelin sheaths are formed by fully mature oligodendrocytes. However, the entire oligodendrocyte lineage is susceptible to changes in the biological microenvironment and other risk factors that arise as the brain ages. In addition to their well-known role in action potential propagation, oligodendrocytes also provide intercellular metabolic support to axons by transferring energy metabolites and delivering exosomes. Therefore, myelin degeneration in the aging central nervous system is a significant contributor to the development of neurodegenerative diseases. Interventions that mitigate age-related myelin degeneration can improve neurological function in aging individuals. In this review, we investigate the changes in myelin that are associated with aging and their underlying mechanisms. We also discuss recent advances in understanding how myelin degeneration in the aging brain contributes to neurodegenerative diseases and explore the factors that can prevent, slow down, or even reverse age-related myelin degeneration. Future research will enhance our understanding of how reducing age-related myelin degeneration can be used as a therapeutic target for delaying or preventing neurodegenerative diseases.
2025-12-31·International Journal of Pavement Engineering
Impacts of ultraviolet irradiation on asphalt binder: a comprehensive review
作者: He, Yinzhang ; Lyu, Lei ; Fini, Elham H. ; Hu, Qinshi ; Li, Yan ; Aldagari, Sand ; Zhao, Xiaokang ; Zhang, Jiupeng
This paper presents a comprehensive review of UV aging in asphalt binders, a critical but relatively underexplored factor contributing to the premature failure of asphalt pavements.Asphalt binders, which function as the adhesive binding stone aggregates, are susceptible to aging processes that degrade their performance over time.While the impacts of thermal and oxidative aging are well documented, the effects of UV exposure remain less understood, and no standardised test currently exists to evaluate the UV resistance of different binders.UV aging primarily begins at the air-binder interface, where the surface is directly exposed to UV radiation.Intermediates and aging products formed at the surface diffuse inward, affecting the binder′s morphol., chem. structure, and micromechanics.Traditional bulk measurements, such as rheol. assessments of bitumen layers thicker than 1 mm, often underestimate the impact of UV aging, leading to inconsistent findings.This review synthesizes research from 2010 to 2024, identifying key indicators of UV aging, such as the loss of colloidal stability and the formation of carbonyl compounds, and provides evidence-based recommendations for accurately assessing UV susceptibility.It underscores the importance of using wavelengths (320-400 nm), which represent UV-A and constitute most of the solar radiation reaching the Earth′s surface, to effectively simulate real-world conditions.The review also highlights critical research gaps: understanding the chem. reaction pathways involved in UV aging, exploring the moderating effects of aggregate mineralogy and packing, and examining the interplay between UV exposure and other environmental stressors like moisture, temperature, and mech. loads.Addressing these gaps is vital for developing more durable asphalt and protective coating with enhanced resistance to UV-induced degradation
2025-12-31·Virulence
Distinctive function of Tetraspanins: Implication in viral infections
Review
作者: Peng, Ruining ; Yang, Hui ; Zhou, Yidan ; Pan, Chengwei ; Chen, Jiawei ; Zhang, Nu ; Yu, Xiaoyu ; Zhang, Yuzhi ; Wang, Sijie
Harboring four transmembrane domains in their structural hallmark, Tetraspanins (Tspans) are a family of glycoproteins with pivotal functions in a variety of biological and cellular processes. Through interacting laterally with each other or specific membrane proteins, Tspans organize tetraspanin-enriched microdomains (TEMs), modulating cellular signaling, adhesion, fusion, and proliferation. An abundance of evidence has identified the multiple functions in the progression of cancer as well as the underlying molecular mechanisms. Recently, plenty of studies have focused on the utilities of Tspans by pathogens for infection, especially the infection of viruses. The expression of Tspans correlates with the phase of viral infection, the type of virus, and targeted therapies. In particular, perturbations of Tspans in host cells can affect viral attachment, intracellular trafficking, translation, virus assembly, and release. In this review, we summarize and provide a historical overview of the discovery and characterization of various kinds of virus infection and highlight their diversity and complexity, along with the virus life cycle. Furthermore, we examined the current understanding of how various Tspans are involved in the regulatory mechanisms underlying viral infection. This review aims to offer a comprehensive understanding of the targeting of Tspans for therapeutic intervention in infections caused by diverse pathogens.
50
项与 西北工业大学 相关的新闻(医药)2025-05-22
·动脉网
动脉网最新消息,利德健康科技(广州)有限公司(以下简称“利德健康”)已成功完成近亿元天使轮融资。根据动脉网数据库统计,此次融资为近三年内生命科学仪器与生物智造装备领域融资规模最大的一笔天使轮融资!此轮融资由嘉道资本领投,齐济投资、中科创星、聚科新兴产业创投、见识资本、九州鑫诺跟投,融资资金将用于加速技术研发、产品产业化以及市场拓展等工作。01多学科交叉融合整建制产业化团队,构建覆盖全产品线的知识产权壁垒利德健康成立于 2023年10月,位于广州国际生物岛,为广州实验室科技成果产业化的标杆性硬科技创业公司。公司专注于自主研发AI+高端生命科学仪器和生物智造装备,并搭建配套的人工智能AI算法系统、生物芯片、试剂耗材等生态体系,致力于为生命科学仪器、生物制药、合成生物学等领域打造微流控、自动化、智能化、系统级解决方案,旨在助力肿瘤/癌症/抗衰老等生物制药(抗体药、细胞基因治疗等)、生命科学研究、合成生物学、生物安全等领域增效降本。公司的创始核心团队由原华为公司研发总监、联影医疗公司医疗器械技术专家、连续创业者张峰担任CEO,由国家重大人才项目(青年)学者、广州实验室研究员、苏黎世联邦理工大学Senior Scientist曹小宝担任CTO,苏黎世联邦理工大学Andrew deMello教授等世界著名专家学者担任科学顾问。团队成员由毕业于瑞士苏黎世联邦理工大学、美国哈佛大学、英国剑桥大学、新加坡国立大学等海内外知名院校优秀博士、硕士组成,同时集结了一批生命科学仪器和生物制药领域的行业精英。团队在微流控芯片、生命科学、生物制药、医疗器械、机器人自动化、人工智能等领域深耕多年,拥有深厚的积累和丰富的经验,涵盖技术研究、创新孵化、产品研发、临床转化、市场推广等产业链各个环节。公司于2024年3月18日正式开业运营,2024年9月入库广东省2024年第一批科技型中小企业,跑出了令人瞩目的“加速度”:利德健康作为唯一入选粤港澳大湾区知识产权创造运用合作成果案例的硬科技创业公司,2024年3月与广州实验室签署知识产权转化运用合作协议,从广州实验室科研成果转化22项专利,其中包括多项PCT国际专利及发明专利。此外,公司还自主申请了57项专利及10项计算机软件著作权,其中包含19项发明专利及3项 PCT 国际专利。通过近百项专利、软件著作权、商标等布局,公司构建起覆盖全产品线的知识产权壁垒,并成功入选国家知识产权局2025年首批专利转化运用优秀案例(全国仅20家单位入选),作为广东省唯一入选案例,为全国科研机构专利产业化提供了创新样本。利德健康与广州实验室签署知识产权转化运用合作协议利德健康快速组建了整建制多学科交叉融合产业化团队,研发领域涵盖“光、机、电、算、软、芯、生、化、环、材”多学科交叉融合,运营领域涵盖“市场、研发、生产、质量、销售、服务、运营”完整产业链环节。目前团队规模已超100人,其中产品研发人员占比约70%。02围绕细胞产业链核心打造生命科学仪器矩阵,驱动千万元订单转化围绕细胞产业链全面布局核心技术、部件和系统级解决方案,公司开发了单细胞多组学系统(单细胞转录组/空间转录组等)、高通量微流控液滴分选系统(抗体药筛、合成生物学菌株分选/酶定向进化等)、高通量AI成像流式细胞仪(细胞形态学/力学等智能分析)、全自动细胞培养制备系统(干细胞/免疫细胞等)、全自动蛋白纯化系统、微流控系统设备等10 款产品及服务,其中约80%核心技术、部件、模组共用,形成 “AI + 生命科学仪器+ 精准诊断医疗器械 + 生物制药装备 + 合成生物学装备”产品组合布局。在现有产品解决方案以外,持续布局研发下一代新技术,量产 N 代产品、开发 N+1 代样机、预研 N+2 代新技术,结合市场需求可快速研发推出新产品,从而更好地实现系列化产品解决方案和平台化规模效应。目前,利德健康已与四川大学华西医院、江苏省人民医院、广州市第一人民医院、深圳市儿童医院、中山大学附属医院、广州医科大学附属医院、广东省中医院等三甲医院签署技术服务合同,并与西北工业大学、复旦大学、上海交通大学、武汉大学、浙江大学、南方科技大学、中科院纳米所等一流大学/研究所和金斯瑞生物科技公司等头部生物药企上市公司签署仪器设备合同。2024年,公司已与头部客户签署超过1000万元的商业订单,快速完成科技成果产业化,与头部客户达成深度合作,并参与行业标准制定。公司自主研发的主动式单细胞测序系统,是业界首创主动式单细胞测序系统产品,于2024年在瑞士达沃斯科学峰会首次亮相国际舞台。该系统凭借领先的主动式编码分选技术、卓越的样本兼容性和高效去除背景噪音等优势,为单细胞测序领域树立新标杆。特别是其为单细胞测序技术从科学研究领域进入真实临床样本研究等方面带来突破性进展,将推动提升真实临床样本研究的效率和准确性,同时进一步降低单细胞测序临床应用的门槛,为生命科学领域快速发展注入了新活力。瑞士达沃斯科学峰会,诺贝尔化学奖得主Jean-Marie Lehn教授参观利德健康展台交流业界首创主动式单细胞测序系统利德健康的高通量 AI 成像流式细胞仪为基于细胞高速成像与微流控芯片技术结合的高通量细胞形态学/力学智能分析系统,具备亚微米分辨率、约2万帧率的高速图像采集与智能分析能力,结合粘弹性流体聚焦、高速频闪、微流控芯片、微纳光学、高速图像处理等技术,能够实现对细胞的高通量图像采集、智能分析。此外,该产品搭载自研的AI大模型智能算法,可高效分析细胞形态学等特征,为研究提供精准的高通量细胞图像智能分析工具。其优势在于高分辨率与高通量的结合、AI算法的智能化分析,以及对细胞形态学、力学分析、蛋白空间定位等特征的深度挖掘能力,适用于药物研发、药物递送、细胞治疗和细胞生物医学研究等领域。高通量 AI 成像流式细胞仪既可以作为高端生命科学仪器服务科研市场和生物药物研发市场,也可用于疾病诊断医疗器械服务医院临床诊断市场。当前公司正在与三甲医院合作开展基于高通量 AI 成像流式细胞仪的脓毒血症快速诊断临床研究。高通量AI成像流式细胞仪在合成生物学与生物制药装备领域,利德健康自主研发了系列化产品解决方案。高通量微流控液滴分选系统能够大幅缩短单克隆抗体筛选时间,分选速度快、通量高,大幅提升抗体筛选效率。该系统可用于优化细胞治疗靶点、搭建药物递送和释放全新平台、酶工程与酶进化、合成生物学、重组蛋白、抗生素等微生物筛选、菌株筛选等,为生物制药、合成生物学等领域提供了高效、可靠的细胞分选解决方案。高通量微流控液滴分选仪全自动细胞培养制备及药筛平台是为实现高效、自动化细胞培养制备生产流程而研制,集成了细胞复苏、智能检测、自动化换液、稳定传代及高效收获等核心工艺环节,形成了一套流程完整且高度自动化的细胞培养制备解决方案。该产品为细胞治疗、细胞制备中心、细胞库、科研院所/高校生物实验室、P3/P4生物安全实验室、海关检验检疫、疾控中心等应用场景打造,广泛适用于各类贴壁细胞、悬浮细胞静置培养制备、类器官药物筛选平台等。该产品融合了用户自定义细胞培养制备工艺程序与先进的人工智能技术,能够智能分析细胞状态,实现培养环境的实时监控与工艺优化,使得细胞在最佳条件下生长培养。同时,该产品构建了安全可靠的细胞培养制备环境,显著提升细胞培养制备与药物筛选的自动化程度、一致性、质量控制、安全性和生产效率,解决传统人工操作实验的局限性,同时大幅降低生产成本,为细胞治疗领域增效降本提质,提升细胞药物可及性。全自动细胞培养制备及药筛平台全自动蛋白纯化仪采用8通道并行层析纯化处理技术,可实现全自动、高效纯化多种蛋白。设备内置气泡检测器,自动控制样品流向,有效避免层析柱进气、样品损失及污染。实时压力监测与高压预警功能确保操作安全。支持多梯度洗脱浓度设置,适配不同蛋白特性纯化需求。自动收集洗脱蛋白,减少人工干预,显著提升纯化效率。该仪器配备自主研发的8通道独立UV280紫外检测传感器,支持按阈值、斜率等收集方式。通过全自动操作流程,大幅提升多品种蛋白纯化效率。全自动蛋白纯化仪03突破进口垄断困局,打造增效降本的新质生产力解决方案全球科学仪器和生物制药装备市场规模庞大,但中国在高端科学仪器和生物制药装备领域面临着国产化率不足20%的困境,长期被国外巨头厂商垄断,全球排名前20的科学仪器和生物制药装备公司全部为国外厂商,无一中国企业上榜。这使得中国在科学仪器和生物制药装备领域供应链抗风险能力极弱,面临严重的卡脖子风险,亟需国产突破。国家对科学仪器国产化给予高度重视。“十四五”规划明确提出加强高端科学仪器设备研发制造,推动自主可控。随着国内科研和工业的快速发展,科学仪器和生物制药装备更新换代需求强烈,提供了广阔的市场空间,为国产企业带来了黄金发展历史机遇。近几年国内一批优秀的生命科学仪器企业正在崛起,在技术研究和产品开发方面取得了一定成果,掌握了部分生命科学仪器的核心关键技术,正朝着国产替代和自主创新快速发展。对于此轮融资,利德健康创始人、CEO张峰表示:非常感谢各位投资人的信任与支持!在资本寒冬时期完成此次天使轮融资对利德健康意义重大,不仅为利德健康技术研发和产品产业化注入了充足资金,更代表了资本市场对利德健康在生命科学仪器与生物智造装备领域发展方向的高度认可。利德健康秉承并践行以“助力人类健康长寿”为愿景、以“侠之大者、利国利民、利德健康、福寿康宁”为使命、以“相互成就、合作共赢、事成人爽、海纳百川”为价值观。利德健康将牢记使命、不忘初心、全力以赴做好科技成果产业化、反哺科研,与产业链上下游合作共赢,致力于攻克生命科学仪器和生物制药装备领域卡脖子难题,助力人类健康长寿! 展望未来,利德健康已擘画清晰且宏伟的发展蓝图。在技术研发方面,公司将持续加大研发投入,深化“AI + 生命科学 + 生物医药 + 生物智造 + 高端装备” 领域融合创新应用,为生命科学、生物制药、合成生物学、生物安全等领域领域提供增效降本的新质生产力解决方案。在市场拓展方面,公司将践行“扎根中国,面向全球” 的策略,深耕国内市场,同时积极开拓国际市场,致力于成为生命科学仪器与生物智造装备领域的科技创新领军企业。嘉道资本创始人、海康威视联合创始人、中源协和董事长龚虹嘉表示:“利德健康在生命科学仪器与生物智造装备领域展现出的技术实力与创新潜力令人瞩目。我们相信,通过此次投资,利德健康将在行业内持续深耕,创造更大价值,我们也期待利德健康与嘉道资本在生物医药生态链企业深度合作,共同推动生物制药领域的技术进步与产业发展。”齐济投资创始管理合伙人张莉表示:“利德健康在生命科学仪器与生物智造装备领域的技术创新成果显著,展现出了巨大的发展潜力。其技术研发实力、团队专业能力以及对行业趋势的精准把握,与我们在医疗健康领域的投资理念高度契合。我们相信,通过此次投资,利德健康将进一步提升研发与产业化能力,快速拓展市场,推动生命科学产业的发展。”中科创星创始合伙人米磊表示:“利德健康作为生命科学仪器与生物智造装备领域的硬科技企业,与我们在硬科技领域的理念和布局高度契合,其优秀团队和拥有的关键硬核技术具备强大的发展潜力。我们希望投资利德健康助力其技术成果加速转化,为生命科学领域的硬科技发展添砖加瓦,一起助推并见证中国高端生命科学仪器领域的突破与技术创新。”关于嘉道资本嘉道资本由知名天使投资人龚虹嘉先生创立。龚虹嘉先生,毕业于华中科技大学,著名的科技企业家、天使投资人。作为上市公司海康威视(002415)的早期投资人,他创造了投资245万获得500亿回报的投资奇迹,以20000倍的投资回报被誉为中国最成功的天使投资人。龚虹嘉及家族投资版图中已有7家企业成功上市,2022年以132亿美元财富位列《2022年福布斯全球亿万富豪榜》第138位,2022年中国内地富豪榜32位。龚虹嘉先生先后投资(创办)德生科技、握奇数据、富年科技、亚信、联合光电、富瀚微电子、中源协和等高科技企业,投资高科技企业过百家,是中国最富行业洞察力和远见的投资家之一。嘉道资本重点布局生命科技、教育科技、中医药大健康、绿色生态农业等领域。关于齐济投资齐济投资诞生于2020年底,是一家专注于医疗健康领域早期和成长期投资的专业投资机构。在医疗及生物科技领域深耕多年,具有多年国内一线基金的医疗投资背景以及逾十年全球领先跨国药企的全产业链经验。主要关注前沿技术驱动的生物制药、医疗器械和体外诊断等领域的优质投资机会,聚焦其具备显著优势的细分赛道,重点关注目前全球医疗市场以及病患“未满足的需求”,坚持为被投企业赋能和创造协同价值,共同推进医疗创新,为社会创造价值。关于中科创星中科创星成立于 2013 年,是一家专注于 “硬科技” 领域的早期投资机构,是 “硬科技” 理念的缔造者和先行者。致力于打造以 “研究机构 + 早期投资 + 创业平台 + 投后服务” 为一体的硬科技创业生态,围绕光电芯片、人工智能、航空航天、生物技术、信息技术、新材料、新能源、智能制造等重点领域,投资具有成长潜力的初创期、早期科技型中小企业。如果您想对接文章中提到的项目,或您的项目想被动脉网报道,或者发布融资新闻,请与我们联系;也可加入动脉网行业社群,结交更多志同道合的好友。近期推荐声明:动脉网所刊载内容之知识产权为动脉网及相关权利人专属所有或持有。未经许可,禁止进行转载、摘编、复制及建立镜像等任何使用。文中如果涉及企业信息和数据,均由受访者向分析师提供并确认。动脉网,未来医疗服务平台
高管变更基因疗法细胞疗法
2025-01-25
·智药邦
小分子的化学合成,一直是科学研究中的一项挑战。近年来,深度学习模型在逆合成领域展现出了独特的优势,这些技术能够很好的解决化学家在逆合成设计中的遇到的一些问题。然而,大多数基于AI的逆合成模型都缺乏可解释性,无法阐明逆合成设计中的内在逻辑。
2025年1月18日,西北工业大学生命学院施建宇教授团队在《Nature Communications》上发表文章Single-step retrosynthesis prediction via multitask graph representation learning。
这项研究介绍了一种革命性的方法--Retro-MTGR,该方法能够深度挖掘逆合成反应中的化学逻辑,让药物合成的逆向推理变得更加智能和精准。
逆合成推理
逆合成推理是从目标药物的分子结构出发,逆向推理出合成该药物的化学反应物。与传统的正向合成不同,逆合成推理让科学家们能够更高效地设计药物合成路线,极大地提高药物研发的效率。
Retro-MTGR:AI如何精准预测药物合成路径
施建宇教授团队提出的Retro-MTGR框架(如图1所示),是基于先进的“多任务图表示学习”的AI模型。通过深入学习分子结构中的图信息,Retro-MTGR框架能够同时完成多个任务,具体包括两个主要任务和一个辅助任务:
识别反应中心:判断分子中最容易发生化学反应的部分(主要任务);
识别离去基:确定在反应中会“离开”分子的部分(主要任务);
优化原子嵌入:为化学反应提供更加精准的原子表示(辅助任务)。
通过完成这三个任务,Retro-MTGR不仅帮助科学家们更好地理解化学反应机制,还能精准预测药物合成路径,为药物研发提供强大支持。
图1. Retro-MTGR的工作流程图
研究亮点:从键能到分子电性,AI揭示药物合成的深层规律
这项研究的最大亮点之一,在于通过学习分子化学键的结构,键能等属性,揭示了哪些化学键可能成为反应中心,哪些则可能只是普通的化学键(图2)。具体来说:
高键能(>=360 kJ/mol)的化学键,如双键和三键,通常是普通键;
低键能的单键(如C-N、C-O等)可能是反应中心,也可能是普通键,这取决于周围分子的结构;
反应中心的原子通常具有相反的电性,而普通键的原子则具有相似的电性。
不仅如此,Retro-MTGR还通过联合嵌入空间分析了合成子和离去基的电性分布,揭示了反应过程中的关键规律(如图3所示),这包括:反应中的两个合成子总是具有相反的电性并且彼此相距甚远;属于同一个反应物的合成子和离去基通常具有相反的电性并且彼此靠近;反应中同时出现的两个离去基经常具有相反的电性并且彼此相距甚远。
图2.化学键嵌入空间的展示
图3.合成子和离去基的联合嵌入空间展示
实验验证:准确预测药物合成路径
为了验证这一创新框架的有效性,研究团队通过预测两种药物Sonidegib和Acotiamide的逆合成路线,并与实际合成路线进行了对比。
图4. 对于两种药物的预测逆合成路线和真实化学合成路线展示
结果表明,Retro-MTGR推断出的合成路线与实际结果高度一致(如图4所示),这无疑证明了其在药物研发中的巨大潜力。
总结和展望
为了开发一个高度可解释的判别模型来揭示化学合成机制,本文提出了一个Retro-MTGR框架。基于分子图,在Retro-MTGR中同时考虑了三个相关任务,其中两个主要的监督判别任务负责识别反应中心和识别LGs,而一个辅助的自监督任务负责生成更好的原子嵌入。
与16种最先进的方法进行比较的结果,证明了Retro-MTGR的优越性。此外,在RTU和RTK场景中,不同的训练测试策略和不同大小的数据集验证了它的稳健性和可扩展性。涉及两种新药的实验验证结果表明,Retro-MTGR推断的逆合成路线与化学合成测定获得的逆合成路线一致。
Retro-MTGR是一个优秀的单步逆合成推断模型。未来,研究团队将在Retro-MTGR的基础上整合其他化学合成因子(例如反应产率,反应条件等)来开发一个可靠的多步逆合成模型以解决复杂分子逆合成路线规划的任务。
参考资料:
Zhao, PC., Wei, XX., Wang, Q. et al. Single-step retrosynthesis prediction via multitask graph representation learning. Nat Commun 16, 814 (2025). https://doi-org.libproxy1.nus.edu.sg/10.1038/s41467-025-56062-y.
--------- End ---------
感兴趣的读者,可以添加小邦微信加入读者实名讨论微信群。添加时请主动注明姓名-企业-职位/岗位或姓名-学校-职务/研究方向。
2024-12-10
·美通社
巅峰对
决 成绩出炉
南京
2024年12月10日
/美通社/ -- 2024年12月6日-7日,由国家医疗器械产业技术创新联盟、南京生物医药谷建设发展有限公司联合主办,医疗器械创新网、医疗器械创新服务中心及北京大学分子医学南京转化研究院共同承办的第七届(2024)中国医疗器械创新创业大赛(南京)总决赛在南京生物医药谷顺利开赛,共有6场类别赛、专场赛、总决赛在这里展开激烈角逐,来自全国的120个医疗器械创新项目汇聚,共同探索医疗器械产业发展的新路径、新模式。大赛开幕式现场来自业内近200位专家、投资机构代表及企业家代表齐聚一堂。
筑梦金陵,展望未来
江苏省药品监督管理局副局长姜伟
开幕式上,
江苏省药品监督管理局副局长姜伟
在致辞中充分肯定了中国医疗器械创新创业大赛对行业创新发展的积极作用,并表示,长期以来,江苏省委、省政府高度重视医疗器械产业发展,出台了一系列重大的政策措施,大力推动全产业链开放创新发展,医疗器械产业增长的韧性和发展的活力持续彰显。近年来,江苏省药监部门在优化审评审批程序、提升审评审批效率方面,做了多项工作并取得明显成效。2024年截至目前,江苏全省新获批二类医疗器械1606件,三类医疗器械416件,数量居全国第一,获批创新医疗器械7个。去年8月,江苏省药监局与江北新区共同揭牌成立了省药监局审评核查江北新区分部,为创新产品尽快获批上市,抢占发展先机提供了强有力的支撑。
江北新区生命健康产业发展党工委书记、管办主任许双华
随后,
江北新区生命健康产业发展党工委书记、管办主任许双华
发表了致辞,他提到,南京生物医药谷是市委、市政府在产业布局上重点打造的生物医药产业基地和高端生物医药研发区,也是江北新区"基因之城"建设的主阵地,生物医药产业展现出强劲的创新能力和发展后劲。他还表示,期望以此次大赛为契机,实现以赛助创、以赛促引、以赛聚才,汇聚更多优质的创新项目和创新人才。江北新区也将营造诚信可靠、高效响应的营商环境,提供便捷响应、细致周到的服务体系,努力让每一位创业者在这里找到成长的土壤、收获成功的喜悦。
国家医疗器械产业技术创新联盟理事长、中国医疗器械行业协会常务副会长姜峰
国家医疗器械产业技术创新联盟理事长、中国医疗器械行业协会常务副会长姜峰
在致辞中表示,大赛长期以来得到了江苏省药监局的大力支持,此次大赛能在江北新区成功举办,源于南京高效的创新政策和优越的营商环境,这些也成为吸引创新项目落户的关键。随着国务院783号令的实施,大赛通过"以赛促招"模式,配套提供30项软性创新合规服务,成为当前招商环境下的最佳招商方式。未来,大赛将深化与相关部委的合作,并开展国际科技交流,以推动医疗器械产业的国际化发展。
江北新区生命健康办副主任杨涛
江北新区生命健康办副主任杨涛
,从产业布局、创新成果、人才建设等方面详细介绍了江北新区在医疗器械领域的发展规划和政策支持,展现了南京在医疗器械产业中的雄心和潜力。他提到,今年9月,江苏省与教育部启动共建
首家全国高校区域技术转移转化中心
,其中生物医药分中心就落址南京生物医药谷,分中心将坚持"科教产才"一体化推进,实施空间打造、资金保障、政策支持、平台建设和生态创新"五大行动",聚焦高校源头创新成果,全力推动高校原创新药及高端医学装备科技成果转化。
江苏省药监局审评中心主任张宜川
随后,
江苏省药监局审评中心主任张宜川
展开了对江苏省医疗器械注册审评服务的全面解析,他详细介绍了审评流程和政策指导,为创新企业在了解注册审评各环节提供了宝贵的信息。他提到,江苏省医疗器械审评服务体系正逐步落实深化医疗器械审评审批制度改革要求,技术审评机构指导服务功能和范围将不断延伸,可以在审评、注册、创新评估等维度发挥更大的作用。
6场赛事结果如下:
高值医用耗材类别赛
奖项
项目名称
单位
/团队名称
一等奖
颈动脉支架系统
苏州中天医疗器械科技有限公司
天生我材——新型医用胶原蛋白植入物
广州市朴道联信生物科技有限公司
二等奖
可调控型主动脉内双气囊驱动反搏导管装置(IADBP)的研发与临床转化
中国医学科学院阜外医院
新型牙科氧化锆陶瓷种植体项目
北京瑞瓷医疗科技有限公司
糖尿病膝下动脉病变系统解决方案
北京海盛医疗器械有限公司
三等奖
生物组装高分子牙本质脱敏材料
美釉(西安)生物技术有限公司
一种新型血栓清除导管系统的设计开发
归创通桥医疗科技股份有限公司、重庆医科大学附属第一医院
口腔个性化钛网的研发及产业化
广东健齿生物科技有限公司
华夏生物人源性组织材料产业化项目
华夏(青岛)生物科技有限公司
植入式心血管监测胶囊——无源无线肱动脉传感器
上海小感智能科技有限公司
优胜奖
肺动脉血栓取出系统
晨兴(南通)医疗器械有限公司
可降解镁合金支架的临床应用及产业化
东南大学泰州生物医药与医疗器械研究院
分段解脱弹簧圈技术的设计和应用
首都医科大学附属北京天坛医院
预置单开窗胸主动脉覆膜支架系统的临床应用研究
中国医学科学院北京协和医院
医美级外泌体及其生产系统
苏州生动细胞生物科技有限公司
新型脑动脉瘤根治性治疗器械——蜂巢状形状记忆聚合物
成都微斯泰珂医疗器械科技有限公司
悬挂式自适应前列腺支架
南京工业大学
康养类别赛
奖项
项目名称
单位
/团队名称
一等奖
AI失能护理机器人
中科民生耐鼎机器人(珠海)有限公司
面部健康守护者-全方位面部康复治疗仪
上海市第七人民医院
二等奖
助步如飞——个性化辅助智能助老外骨骼机器人
天津理工大学
妇科康复诊疗系统
武汉半边天医疗技术发展有限公司
高精准皮肤治疗激光器以及高稳定皮肤治疗仪研发
佰福激光技术有限公司
三等奖
膝关节智能矫形技术与装备
西北工业大学智能康复技术与装备团队
高密度阵列式单指智能脉诊仪
北京生甡科技有限责任公司
下肢深静脉血栓的预防装置
空军军医大学第三附属医院
AI+桌面氢气机
上海小感智能科技有限公司
康复运动-氧疗系统
菏泽医学专科学校附属医院、宁津县人民医院
优胜奖
岐黄工匠—中医诊疗装备的设计研发与转化
岐黄工匠医药科技研发团队
"着手成春"——手功能障碍智能康复领导者
着手成春
雾护康——中药组方雾化疗法先行者
河南中医药大学护理学院
AVECMU心理音乐减压助眠系统
Avecmu心理健康项目团队
一种膝关节康复仪的设计研究
宁波大学附属第一医院
罐灸治疗仪
西安交通大学第一附属医院
结节智囊--甲状腺结节一体化智慧解决方案
结节智囊团队
AI气味香方
杭州甜成科技有限公司
颐消化—引领功能性消化不良一体化新时代
成都中医药大学科技园颐消化团队
医生专场赛
奖项
项目名称
单位
/团队名称
一等奖
一种可调式弧形电动喉镜
北京大学第三医院
一种壳状牙科器械(数字化隐形矫治咬合导板)的研发应用
空军军医大学第三附属医院/王阿娴正畸正颌"数智化"团队
二等奖
输尿管软镜碎石术(RIRS)中智能监测肾内压及温度的无线柔性传感器设备的研发
清华大学附属北京清华长庚医院
骨病灶清除植骨机器人的研发与应用
上海市第六人民医院
脊柱内镜操纵辅助限深装置研发
新疆医科大学第一附属医院
三等奖
基于质谱技术的哮喘急性发作预警的体外诊断试剂盒
中日友好医院
牙片机可视化束光装置
复旦大学附属口腔医院
预置单开窗胸主动脉覆膜支架系统的临床应用研究
中国医学科学院北京协和医院
隐球菌快速检测新技术
首都医科大学附属北京世纪坛医院
采用空间磁定位技术的系列医用器材、耗材项目
首都医科大学附属北京天坛医院
一种用于盆底功能障碍性疾病智慧诊断的多维精准测压设备
中国医学科学院肿瘤医院
恒流式低无效腔简易呼吸机
坪山区中心医院
优胜奖
全体位、自由切换体位手术台系统
山东第一医科大学附属山东省立医院
新型心肌活检装置的研发与推广应用
国家心血管病中心,中国医学科学院阜外医院
基于机器学习技术适用于冠心病的CABG手术风险评估模型
中国医学科学院阜外医院
减重手术精准导航系统的商品化、产业化探索
首都医科大学附属北京世纪坛医院减重中心
磁耦合口面部精细肌肉刺激治疗仪
西安交通大学第一附属医院
氢氧吸入与营养睡眠诊疗工具:赋能慢病管理信息化新纪元
山东大学齐鲁医院德州医院
悬挂式自适应前列腺支架
江苏省人民医院
基于液相色谱串联质谱技术的可替宁靶向检测研发及产业化
首都医科大学附属北京朝阳医院
用于脓毒症和大型手术感染早期发现的微循环高速血流测算系统和测算方法
安徽医科大学第一附属医院
一种基于虚拟现实技术的老年辅助情感交流系统
西安交通大学第一附属医院
医生专场总决赛
奖项
项目名称
单位团队名称
一等奖
自动化牙髓治疗机器人的优化和应用
中国医学科学院北京协和医院
乳腺癌保乳整形手术瘤腔个体化重建新策略:全新硅胶假体珠与抽绳式自动收口网兜套装综合解决方案
中国医学科学院肿瘤医院
终板力学匹配3D打印椎间融合器
天津市天津医院
脊柱内镜操纵辅助限深装置研发
新疆医科大学第一附属医院
二等奖
骨病灶清除植骨机器人的研发与应用
上海市第六人民医院
一种可调式弧形电动喉镜
北京大学第三医院
"一步法"反应体系 HBV DNA POCT 检测(CRISPR 法)试剂盒研发及产业化
首都医科大学附属北京佑安医院/北京肝病研究所
膝前交叉韧带重建术用可降解锌合金界面螺钉和带袢锌板的研发与临床验证
首都医科大学附属北京积水潭医院
输尿管软镜碎石术(RIRS)中智能监测肾内压及温度的无线柔性传感器设备的研发
清华大学附属北京清华长庚医院
智能舌神经刺激器——口干症治疗新方案
空军军医大学口腔医院
三等奖
一种壳状牙科器械(数字化隐形矫治咬合导板)的研发应用
空军军医大学第三附属医院/王阿娴正畸正颌"数智化"团队
非呼吸暂停盐水造影床旁肺灌注阻抗成像设备研发及技术转化
中国医学科学院北京协和医院
一种新型颈动脉支架系统的研发
北京大学第一医院
基于毫米波雷达技术的儿童睡眠呼吸障碍非接触智能诊断设备研发
首都医科大学附属北京儿童医院
全自动生殖道多靶标快速核酸检测试剂及不孕预警模型的研发
北京大学第三医院
乳腺病变的超声实时检出与智能诊断系统
北京协和医院
基于激光雷达定位与机器学习的持镜协作手术机器人
北京大学第三医院
基于反向演化计算的高精准无创深部脑刺激系统与精神科临床应用
北京回龙观医院
泪液收集检测一体化平台
北京大学第一医院
基于多模态队列数据的肥胖生物标志物研究
北京大学第三医院
无源医疗器械总决赛
奖项
项目名称
单位团队名称
一等奖
分支型介入覆膜支架系统
杭州创心医学科技有限公司
介入式心室辅助系统
上海焕擎医疗科技有限公司
胶原蛋白再生眼角膜产业化项目
广州市朴道联信生物科技有限公司
颈动脉支架系统
苏州中天医疗器械科技有限公司
自然血管支架
杭州矩正医疗科技有限公司
二等奖
外周刻痕球囊扩张导管
鼎科医疗技术(苏州)有限公司
放疗防护水凝胶技术
上海瑞凝生物科技有限公司
椎体-椎弓"一体化"强化的新型骨水泥锚定器及配套材料
天津市天津医院
可降解镁合金植入器械研发及产业化
苏州英诺科医疗科技有限公司
L-Clip经导管二尖瓣环成形系统
上海汇禾医疗科技股份有限公司
眼部长效缓释给药平台
深圳瑞瞳生物医药有限公司
新型牙科氧化锆陶瓷种植体项目
北京瑞瓷医疗科技有限公司
经皮介入脑脊液分流系统
轻舟医学科技(苏州)有限公司
三等奖
低温汽化过氧化氢灭菌袋用当盛®Dawnsens® 闪蒸法超细纤维屏障材料
厦门当盛新材料有限公司
3D打印多孔钽骨科植入产品设计、开发与临床转化
大连大学附属中山医院、伟坦(大连)生物材料有限公司
应用于系统抗肿瘤治疗的新一代可载靶免药物微球
至微(深圳)医学科技有限公司
新型可降解镁合金颅颌面内固定系统的研发与转化
中国医学科学院整形外科医院、苏州卓洽医疗科技有限公司
可调控型主动脉内双气囊驱动反搏导管装置(IADBP)的研发与临床转化
中国医学科学院阜外医院
"精准化-活性化-生命化"赋能的PEEK骨植入体系列产品研发及其临床治疗方案
空军军医大学第三附属医院、军事口腔医学国家重点实验室、西安交通大学精密微纳制造技术全国重点实验室
革新手术缝合线技术
太原理工大学
胶原蛋白抗菌敷料
苏州微创再生医学科技有限公司
一种阻断宫颈上皮内瘤变进展的药物器械组合装置
河北工业大学
糖尿病膝下动脉病变系统解决方案
北京海盛医疗器械有限公司
杏林创涂—新一代纳米抗菌涂层领跑者
西安交通大学未来技术学院
产业转化专场赛
奖项
项目名称
单位团队名称
一等奖
乳腺光声/超声断层成像系统
武汉和视光声科技有限公司
氧化型低密度脂蛋白酶免疫检测试剂盒研制及在脑卒中疾病中的应用示范
首都医科大学附属北京天坛医院
二等奖
十二导联智能心电衣(可穿戴动态心电监测仪)
深圳心康医疗科技有限公司
闭合大血管高频超声刀头
武汉半边天微创医疗技术有限公司
眼科光相干断层扫描仪
深圳市维普医疗科技有限公司
三等奖
全型飞秒激光设备
欣飞秒医疗
低频脉冲磁治疗仪
苏州大芈科技有限公司
柏锘BNUFT 快速胞嘧啶转化试剂盒
柏锘(上海)医疗科技有限公司
一种促进口腔软硬组织修复再生力的智能新材料
苏州易岭生物科技有限公司
神经系统疾病无创脑机调控解决方案
北京集思鸣智科技有限公司
优胜奖
冲击波驱动的纳米深度递送系统
北京波辉生物科技有限公司
消化道精准筛查系统
紫东信息科技(苏州)有限公司
加压骨针
江西省人民医院(南昌医学院第一附属医院)
基于CT或CBCT引导下的激光定位导航系统
奥瑞得医疗科技(上海)有限公司
"核喷医疗系统"—创新核素敷贴制备方案
原子高科股份有限公司
口腔修复体自动化智能制造
上海蓝积达科技有限公司
智能中医装备助力中医远程会诊
中科芯创医疗科技(成都)有限公司
高仿真手术模型
杭州瞻天科技有限公司
便携式(折叠)x线辐射防护装置
北京科亚伟业医疗设备有限公司
5G多模VR+AI医疗巡视机器人
深圳市桓健科技有限公司
此次大赛的圆满举办,不仅充分展示了参赛者们卓越的创新能力和精湛的技术水平,而且成功地发掘出了一批具有巨大潜力和市场前景的创新项目。这些项目涵盖了医疗器械行业的多个关键领域,如高值医用耗材、无源医疗器械、康养、医生专场等,充分体现了大赛对于推动行业发展的深远影响。
通过这次大赛,众多优秀的创新人才脱颖而出,他们带来的项目不仅具有高度的前瞻性和实用性,而且有望打破现有技术的局限,引领医疗器械行业进入一个全新的发展阶段。这些创新项目的成功转化和应用,将进一步丰富医疗器械的产品线,提高医疗服务的质量和效率,从而为广大患者带来更为优质、便捷的医疗服务体验。
此外,大赛还促进了产学研用各方的紧密合作与交流,为医疗器械行业的持续发展和进步注入了强大动力,为整个行业的繁荣与发展奠定了坚实基础。
医药出海
100 项与 西北工业大学 相关的药物交易
登录后查看更多信息
100 项与 西北工业大学 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年07月06日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
药物发现
2
27
临床前
登录后查看更多信息
当前项目
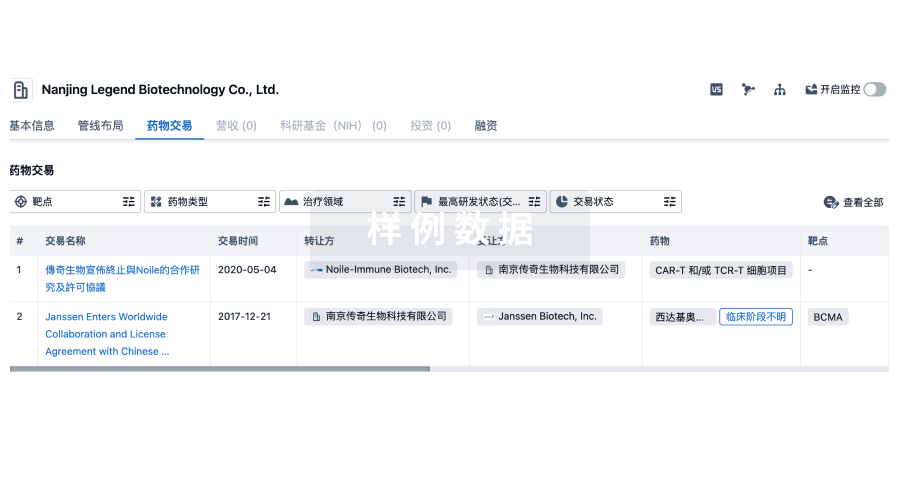
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
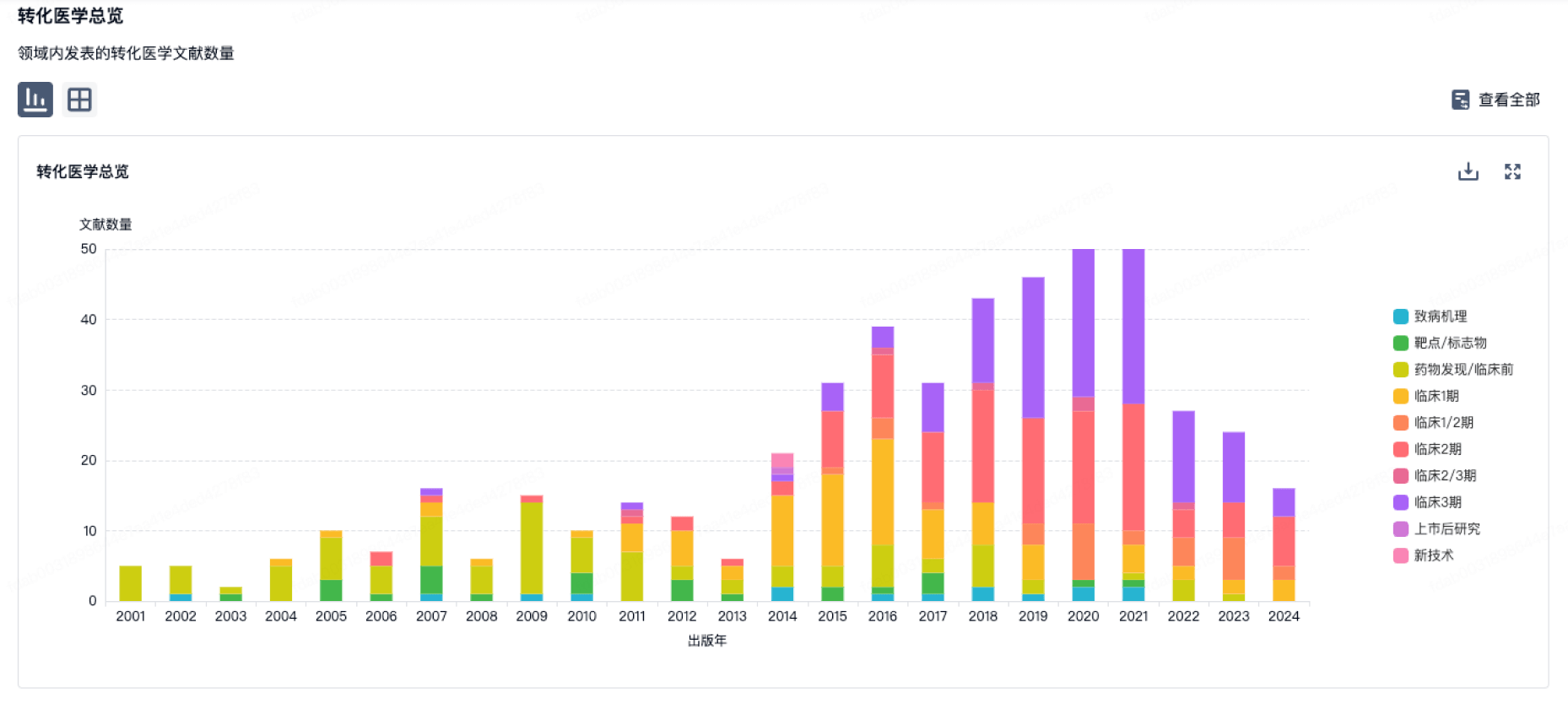
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
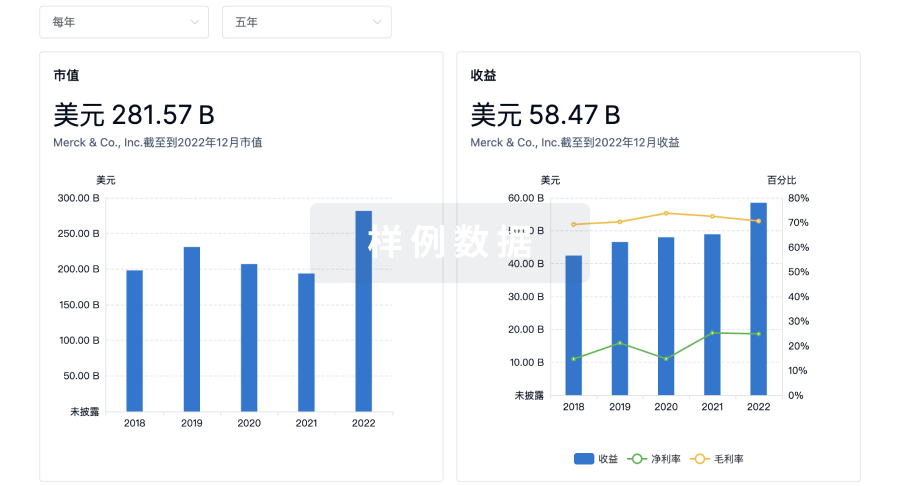
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
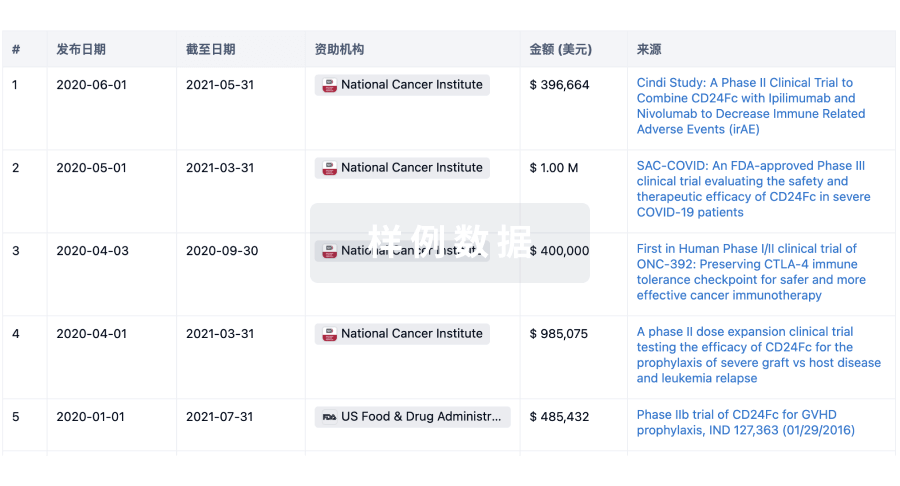
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用