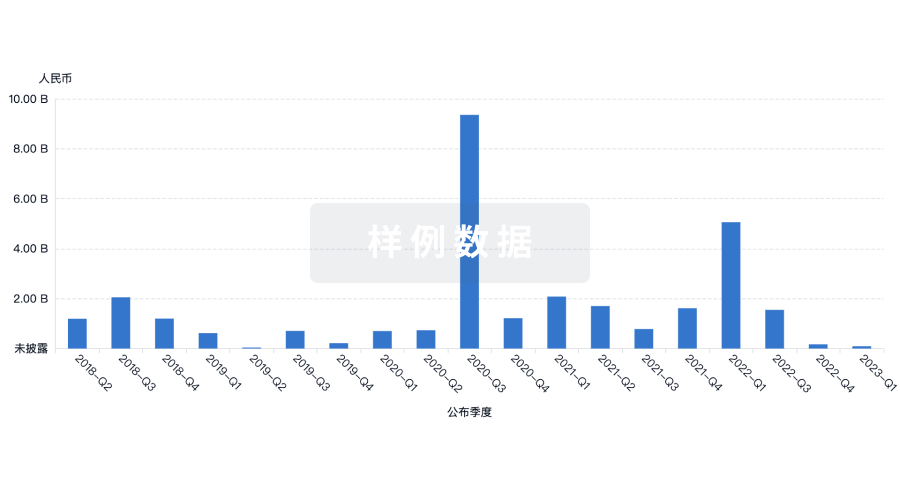
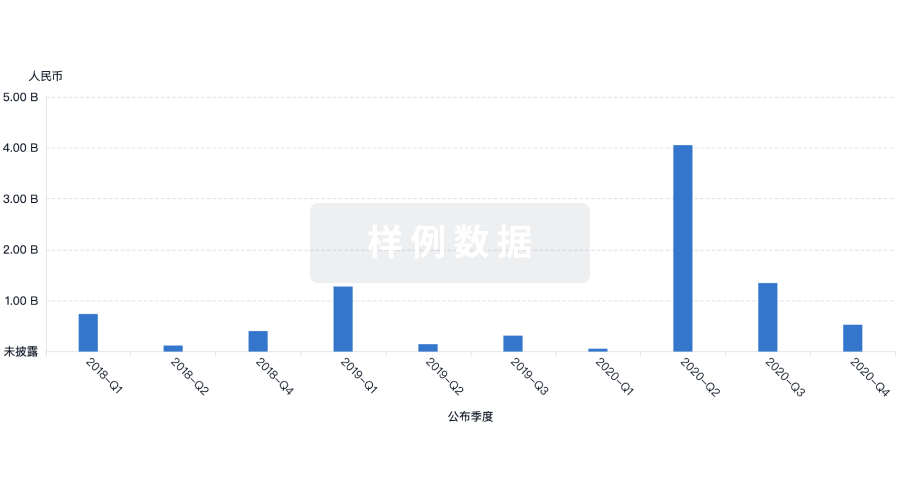
|
|
|
|
|
非在研适应症- |
最高研发阶段批准上市 |
|
首次获批日期2000-01-01 |
/ Active, not recruiting临床1/2期 在对至少一种蛋白酶体抑制剂、一种免疫调节类药物和一种抗 CD38 抗体难治的中国多发性骨髓瘤(三重难治性 MM)受试者中评价 Elranatamab (PF 06863135) 的安全性、药代动力学、药效学和疗效的 IB/II 期开放性研究
主要目的:
Ib 期:确定 Elranatamab 在中国受试者中的安全性特征,以确认RP2D
II 期:确定 Elranatamab 在中国 RRMM 受试者中的疗效
次要目的:
1.进一步评价 Elranatamab 在中国 RRMM 受试者中的疗效
2.确定 Elranatamab 的安全性和耐受性
3.评价 Elranatamab 的 PK
4.评价 Elranatamab 的免疫原性
5.评估 Elranatamab 对患者报告症状和功能的影响
探索性目的:
1.探索 Elranatamab 暴露量与生物标志物、安全性和 PD/生物标志物终点之间的关联
2.探索 Elranatamab 和受试者 MM 生物学之间的关系
一项在中国健康成人中评估VUPANORSEN单剂量皮下注射给药的药代动力学、药效学、安全性和耐受性的 随机、开放、I 期临床研究
主要目的:
在中国健康成人中评估Vupanorsen 80 mg和160 mg单剂量皮下注射给药后的药代动力学特征
次要目的:
在中国健康成人中评估Vupanorsen 80 mg和160 mg单剂量皮下注射给药后的安全性和耐受性。
在中国健康成人中评估Vupanorsen 80 mg和160 mg单剂量皮下注射给药后的药效学。
/ Active, not recruiting临床1期 一项在晚期恶性肿瘤受试者中评估 PF-06801591(PD-1 抑制剂)的药代动力学、安全性、疗效和药效学的 Ib/II 期开放性研究
主要目的:
Ib 期:评估 PF-06801591 的 DLT 发生率
II 期:根据给药间隔 (τ) 内的浓度-时间曲线下面积 (AUCτ) 和稳态 Ctrough 比较 600 mg SC Q6W 与 300 mg SC Q4W 的 PF-06801591 暴露量
次要目的:
评估总体安全性和耐受性
描述 PK 特征(Ib 期和 II 期)
描述免疫原性
评估抗肿瘤活性
评估临床药效与基线肿瘤组织中 PD-L1 表达之间的相关性
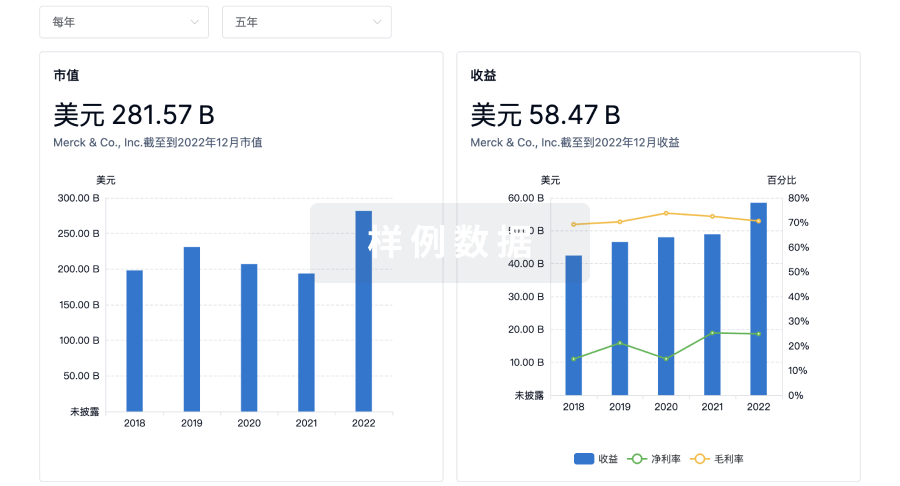
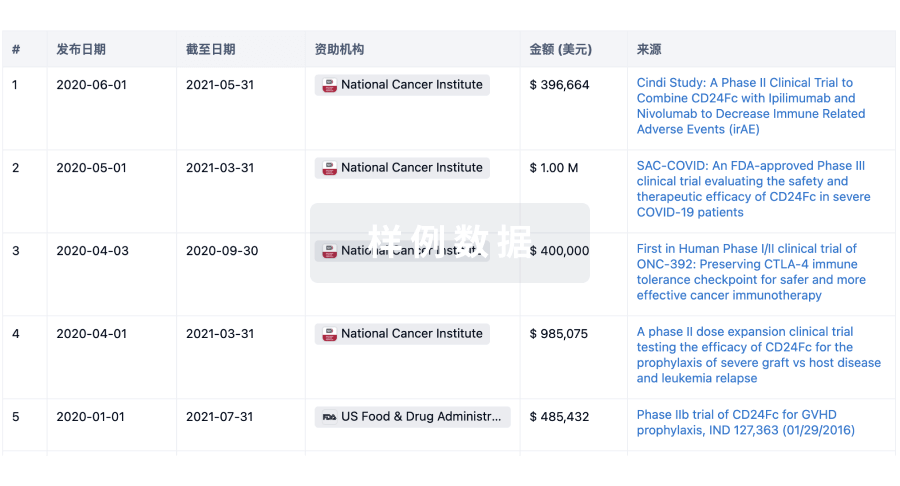
100 项与 Pfizer Manufacturing Belgium NV 相关的临床结果
0 项与 Pfizer Manufacturing Belgium NV 相关的专利(医药)
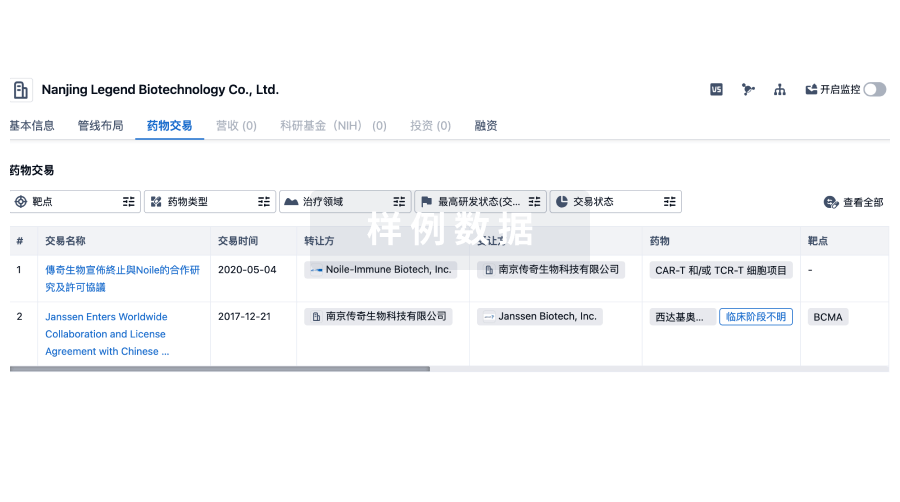
100 项与 Pfizer Manufacturing Belgium NV 相关的药物交易
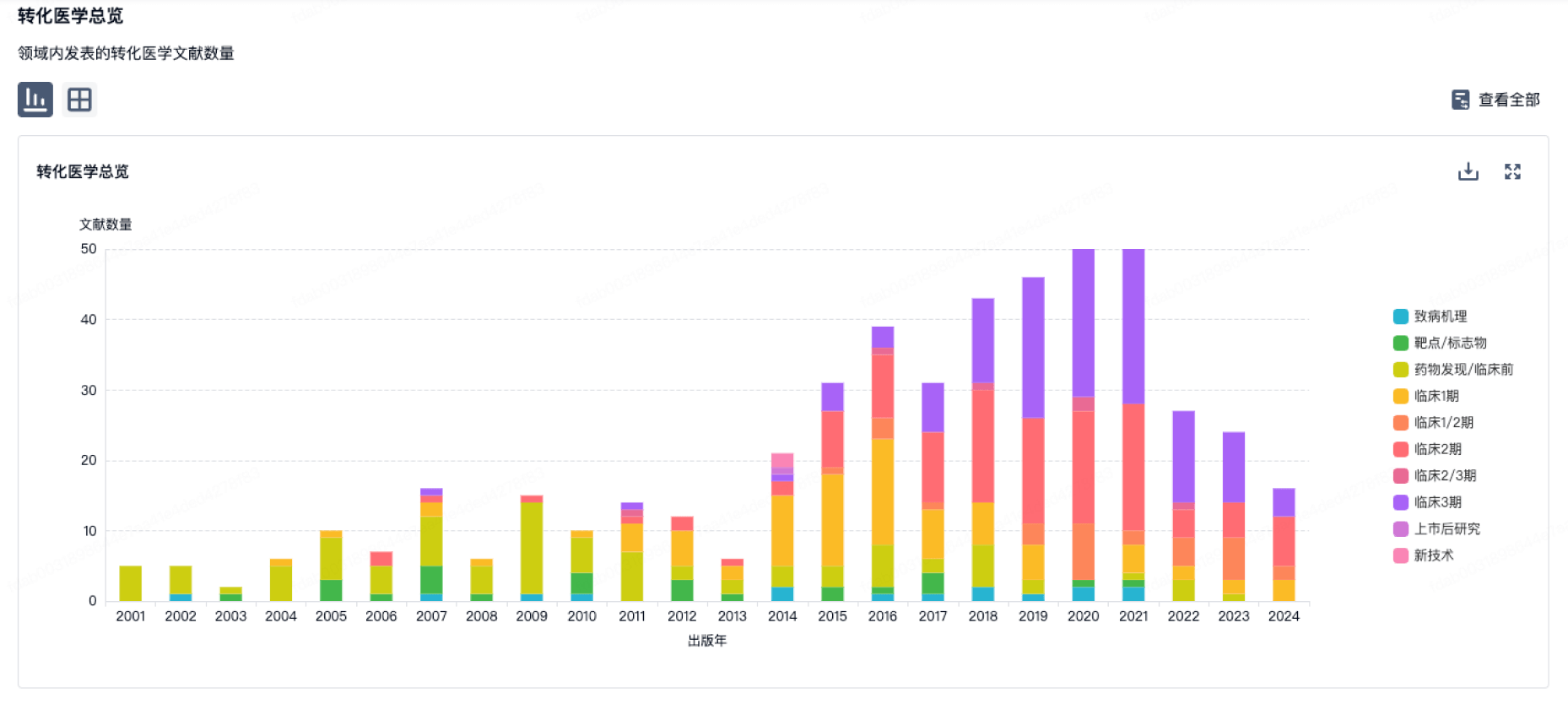
100 项与 Pfizer Manufacturing Belgium NV 相关的转化医学