预约演示
更新于:2025-08-29
Hervor Therapeutics
更新于:2025-08-29
概览
标签
肿瘤
肿瘤浸润淋巴细胞
关联
1
项与 杭州厚无生物医药科技有限公司 相关的药物靶点- |
作用机制- |
在研机构 |
原研机构 |
非在研适应症- |
最高研发阶段临床1期 |
首次获批国家/地区- |
首次获批日期- |
2
项与 杭州厚无生物医药科技有限公司 相关的临床试验NCT05868915
A Phase I/II Clinical Study on the Safety, Tolerability, and Preliminary Efficacy of HV-101 Injection for the Patients With Recurrent or Metastatic Solid Tumors
Background:
Tumor-infiltrating lymphocyte (TIL) therapy is a type of adoptive cellular therapy by harvesting infiltrated lymphocytes from tumors, culturing and amplifying them in vitro and then infusing back to treat patients. TIL therapy has shown strong efficacy for the treatment of solid tumors, and has achieved high objective response rates in multiple cancers.
Objective:
To evaluate the safety and efficacy of HV-101 for the treatment of advanced solid tumors.
Eligibility:
Adults aging 18-75 with advanced solid tumors
Design:
1. Patients will undergo screening tests, including imaging procedures, heart and lung tests, and lab tests.
2. Freshly resected patient tumors were dissected by the surgeon.
3. TIL cells were isolated from the patient's tumor tissue in the laboratory, then cultured in vitro, activated and expanded.
4. HV-101 will be re-infused into the patient.
Tumor-infiltrating lymphocyte (TIL) therapy is a type of adoptive cellular therapy by harvesting infiltrated lymphocytes from tumors, culturing and amplifying them in vitro and then infusing back to treat patients. TIL therapy has shown strong efficacy for the treatment of solid tumors, and has achieved high objective response rates in multiple cancers.
Objective:
To evaluate the safety and efficacy of HV-101 for the treatment of advanced solid tumors.
Eligibility:
Adults aging 18-75 with advanced solid tumors
Design:
1. Patients will undergo screening tests, including imaging procedures, heart and lung tests, and lab tests.
2. Freshly resected patient tumors were dissected by the surgeon.
3. TIL cells were isolated from the patient's tumor tissue in the laboratory, then cultured in vitro, activated and expanded.
4. HV-101 will be re-infused into the patient.
开始日期2023-08-04 |
申办/合作机构 杭州厚无生物医药科技有限公司 [+1] |
NCT06334783
Tumor Infiltrating Lymphocyte (TIL) Therapy for the Treatment of Advanced Solid Tumors
Background:
Tumor-infiltrating lymphocyte (TIL) therapy is a type of adoptive cellular therapy by harvesting infiltrated lymphocytes from tumors, culturing and amplifying them in vitro and then infusing back to patients.
TIL therapy has shown strong efficacy for the treatment of solid tumors and has achieved high objective response rates in multiple cancers, such as melanoma, NSCLC, and cervical cancer.
Objective:
To evaluate the safety and efficacy of TIL for the patients with advanced solid tumor.
Eligibility:
Adults aging 18-75 with advanced solid tumor.
Design:
1. Patients will undergo screening tests, including imaging procedures, heart and lung tests, and lab tests.
2. Freshly resected patient tumors were dissected by the surgeon.
3. TIL cells were isolated from the patient's tumor tissue, then cultured in vitro, activated and expanded.
4. At last TIL cells will be re-infused into the patients.
Tumor-infiltrating lymphocyte (TIL) therapy is a type of adoptive cellular therapy by harvesting infiltrated lymphocytes from tumors, culturing and amplifying them in vitro and then infusing back to patients.
TIL therapy has shown strong efficacy for the treatment of solid tumors and has achieved high objective response rates in multiple cancers, such as melanoma, NSCLC, and cervical cancer.
Objective:
To evaluate the safety and efficacy of TIL for the patients with advanced solid tumor.
Eligibility:
Adults aging 18-75 with advanced solid tumor.
Design:
1. Patients will undergo screening tests, including imaging procedures, heart and lung tests, and lab tests.
2. Freshly resected patient tumors were dissected by the surgeon.
3. TIL cells were isolated from the patient's tumor tissue, then cultured in vitro, activated and expanded.
4. At last TIL cells will be re-infused into the patients.
开始日期2023-05-30 |
申办/合作机构 杭州厚无生物医药科技有限公司 [+2] |
100 项与 杭州厚无生物医药科技有限公司 相关的临床结果
登录后查看更多信息
0 项与 杭州厚无生物医药科技有限公司 相关的专利(医药)
登录后查看更多信息
14
项与 杭州厚无生物医药科技有限公司 相关的新闻(医药)2025-04-29
·今日头条
黑色素瘤是一种免疫原性高、突变负荷大且存在肿瘤间与肿瘤内异质性的癌症。尽管靶向治疗与检查点抑制剂的问世,一度为晚期黑色素瘤的治疗带来曙光,但居高不下的复发率,仍然让无数患者深陷困境。病情一旦进展,患者不仅要面对预后不佳的残酷现实,更陷入治疗手段匮乏的绝境。然而,正是黑色素瘤这种复杂而独特的免疫特性,成为了打破困局的关键突破口!基于 T 细胞的前沿疗法,如免疫检查点抑制剂、肿瘤浸润淋巴细胞疗法(TIL),在这片 “免疫战场” 上找到了治疗的可能和制胜的契机。
《美国癌症研究杂志》公布的重磅数据,无疑为抗癌征程注入一剂“强心针”!在针对 PD-1 抑制剂治疗后进展的晚期皮肤黑色素瘤患者中,非选择性自体 TIL 疗法创造了令人惊叹的战绩:疾病控制率高达 86%!这一数字不仅刷新了人们对黑色素瘤治疗的认知,更昭示着抗癌医学的重大突破 —— 曾经棘手的黑色素瘤难题,正被 TIL 疗法撕开一道希望的裂口,照亮无数患者重获新生的道路!
一、非选择性TIL疗法让晚期黑色素瘤患者持续缓解超7年,疾病控制率达86%
在黑色素瘤治疗领域,非选择性自体肿瘤浸润淋巴细胞(TIL)疗法以高度个性化优势成为创新典范。该疗法通过提取患者自身肿瘤反应性T细胞群,利用其中多样化的T细胞受体(TCR),精准锁定并攻击患者特异性肿瘤相关抗原及新抗原,为晚期皮肤黑色素瘤患者带来新希望。一项发表于《美国癌症研究杂志》的回顾性同情用药临床研究证实,非选择性TIL产品不仅可从消化处理后的肿瘤组织高效制备,更能为经检查点抑制剂或靶向治疗后病情进展的患者,开辟显著临床获益的新路径。
该研究纳入21例晚期皮肤黑色素瘤患者,中位年龄为45岁,均处于M1c或M1d期,超90%曾接受检查点抑制剂治疗,12例为PD-1抑制剂治疗后进展患者。所有患者顺利完成淋巴细胞清除化疗,其中4例使用冷冻保存的肿瘤消化液制备TIL。截至2019年12月31日,中位随访时间长达52.2个月(4.6-98.8个月),治疗数据堪称惊艳。
结果显示:所有患者的
客观缓解率(ORR)达67%,完全缓解率(CR)为19%,疾病控制率(DCR)高达86%
。所有接受治疗患者的
中位总生存期(OS)为21.3个月
(95%CI,6.8-无法估计),KM估计的
24个月总生存期(OS)率为48%
(95%CI,24-68)。
24%的患者实现TIL输注后超30个月的持续缓解,所有CR患者均维持无病生存。
▼所有接受治疗的患者(N=21)以及先前接受PD-1抑制剂治疗的患者亚组(n=12)的总生存率
▲图源“Am J Cancer Res”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,既往接受PD-1抑制剂治疗的患者亚组中,
ORR为58%
(95%CI,28-85),其中
CR率为8%
(95%CI,0-38),
DCR为75%
(95%CI,43-95)。基线存在脑转移的7例患者,
ORR达71%
(29%CR);使用冻存肿瘤制备TIL的4例患者,
ORR达75%
(25%CR),展现出疗法强大的适应性。
值得关注的是,其中1例16岁的BRAF突变患者堪称奇迹:面对巨大病灶(病灶直径总和为103mm)、纵隔转移及脑转移,且对三种疗法耐药的绝境下,经TIL联合IL-2治疗后,
仅6周便显著减轻疾病负担,3个月实现部分缓解,60个月达成影像学完全缓解
(CR,详见下图)。截至数据截止,该
患者已持续CR超7年
(85个月),无需任何后续抗癌治疗,用生命的奇迹诠释了TIL疗法的无限潜力!
▲图源“Am J Cancer Res”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
二、中国TILs产品百家争鸣
除了上文提到的非选择性TIL细胞疗法外,我国紧随美国其后,多家生物公司相继布局TIL产品的研发,并在前期的临床研究中初见成效,目前多款产品已获批正式开展临床研究,这款救命的疗法对中国患者而言,终于不再是遥不可及的梦。下面全球肿瘤医生网小编汇总了其中的几款佼佼者,以供癌友们参考。
1、GC101:君赛生物
GC101是全球首个无需淋巴清除及IL-2输注的天然TIL细胞治疗产品,由君赛生物研发。2022年4月24日,获国家药品监督管理局(NMPA)的临床试验默示许可(受理号:CXSL2200070)。
GC101 TIL已展现出良好的疗效及安全性,入组患者中,有3例达到部分缓解(PR),2例获得完全缓解(CR),且CR持续时间分别>6个月、>8个月。
2、GC203:君赛生物
GC203 TIL细胞注射液是由君赛生物研发的另一款TIL细胞产品,它是全球首款基于非病毒载体而研发的TIL新药品种!2024年2月6日,国家药品监督管理局(NMPA)批准受理了该产品的临床新药试验(IND)申请。GC203延续了GC101的优势,即无需清淋治疗及IL-2治疗,患者可在普通病房完成治疗,预计将节省10万余元的配套临床费用。
GC203在治疗妇科肿瘤(如宫颈癌、子宫内膜癌、卵巢癌)方面,展现出了良好的疗效。GC203治疗后,19例可评估疗效的晚期癌症患者,肿瘤均出现明显缩小,客观缓解率(ORR)达到42.1%,疾病控制率(DCR)更是高达84.2%!
3、GT101:沙砾生物
2022年4月22日,由沙砾生物研发的GT101注射液,获国家药品监督管理局(NMPA)的临床试验默示许可(受理号:CXSL2200061),它是我国首个获批临床的TIL细胞产品!
GT101注射液在治疗黑色素瘤、非小细胞肺癌、宫颈癌等多款实体瘤领域,展现出了良好的效果。
4、GT201:沙砾生物
沙砾生物研发的第二款TIL产品-GT201,于2023年7月11日,获国家药品监督管理局(NMPA)的临床试验默示许可,这也是我国首款进入注册临床试验的基因编辑型TIL产品,适用于复发或转移性实体瘤。
5、C-TIL051:西比曼生物
西比曼生物研发的一款新型TIL产品——“C-TIL051”,新药IND申请于2022年10月,获美国FDA批准,用于PD-1抗体难治或复发性晚期非小细胞肺癌(NSCLC)的治疗。除了NSCLC外,该产品还适用于泛癌种实体瘤(如黑色素瘤、宫颈癌、头颈部鳞状细胞癌等)。
6、BST02:百吉生物
百吉生物研发的一款重磅TILs产品-BST02,Ⅰ/Ⅱ期临床试验申请于2023年10月26日,获美国食品药品监督管理局(FDA)批准,用于治疗各类肝癌。值得一提的是,BST02是全球首个进入临床阶段的治疗肝癌的TIL细胞产品。
7、ZLT-001:智瓴生物
智瓴生物自主研发的ZLT-001注射液,于2023年1月28日获NMPA的临床试验默示许可(受理号:CXSL2200552),它是华南地区首个获批临床的TIL产品,适用于晚期复发或转移性宫颈癌。
8、HV-101:天科雅生物
天科雅生物医药和杭州厚无生物医药公司联合研发的一款新型TIL产品,即“HV-101注射液”,于2023年1月29日获国家药品监督管理局(NMPA)的临床试验默示许可(受理号为:CXSL2200574),用于治疗晚期复发或转移性实体瘤。
9、HS-IT101:华赛伯曼
华赛伯曼公司研发的一款自体天然加强TIL产品——“HS-IT101注射液”,新药IND申请于2023年11月29日,获国家药品监督管理局(NMPA)批准(受理号:CXSL2300599),用于治疗晚期实体瘤。
10、LM103:蓝马医疗
“LM103注射液”是由苏州蓝马医疗技术有限公司研发的一款TIL产品,也是国内首个获临床许可,使用滋养细胞(Feeder)工艺的TIL产品。2023年7月13日,获NMPA临床试验默示许可,用于晚期实体瘤的治疗。
三、小编寄语
肿瘤浸润淋巴细胞(TIL)疗法自1988年首次应用于临床以来,已走过30余载的发展历程。相较于其他免疫细胞疗法,TIL疗法独具将患者自身肿瘤组织“变废为宝”的神奇功效,堪称实体瘤治疗领域当之无愧的抗癌黑科技。它既适用于早期癌症患者,可有效预防肿瘤的复发与转移;又能作为晚期患者的挽救性治疗手段,为癌症患者带来一线生机。
四、参考资料
[1]Pillai M,et.al.Clinical feasibility and treatment outcomes with nonselected autologous tumor-infiltrating lymphocyte therapy in patients with advanced cutaneous melanoma. Am J Cancer Res. 2022 Aug 15;12(8):3967-3984.
https://pmc-ncbi-nlm-nih-gov.libproxy1.nus.edu.sg/articles/PMC9441996/
本文为全球肿瘤医生网原创,未经授权严禁转载
细胞疗法免疫疗法临床结果
2024-11-22
·今日头条
经过35年的不懈探索,号称“一针清除癌细胞”的肿瘤免疫治疗领域的王牌军团TIL疗法,终于在2024年2月16日,获美国FDA批准。这款刚刚获批的“Lifileucel(Amtagvi)”的TIL细胞产品,也在同年4月,完成了世界上第一位患者的顺利回输。至此开启了肿瘤免疫治疗,尤其是实体瘤治疗的新时代,在细胞和基因治疗领域具有里程碑式的重要意义!然而,对于大多癌症患者来说,接受这种治疗的机会仍然很有限,51.5万美金(约370万人民币)的“天价”,让很多患者望而却步。
值得欣慰的是,近年来,特别是在《2024产业结构调整指导目录》实施后,中国在TIL治疗发展方面取得了令人瞩目的进步,多款国产TIL产品纷纷涌现,并表现出了出色的临床疗效。根据中国国家药品监督管理局药品审评中心(NMPA)官网公示,近期多款我国自研的TIL疗法的新药上市申请(IND),获得中国NMPA的临床试验默示许可。这也意味着中国癌症患者,终于也有机会接受这款全球领先的免疫疗法了!
▲截图源自“NMPA”
一、TIL细胞:蛰伏在癌细胞周围的最强抗癌战队
“TIL疗法”即“肿瘤浸润淋巴细胞疗法”(tumor-infiltrating lymphocytes,TIL),与CAR-T、TCR-T疗法不同,TIL疗法并非从外周血,而是从患者自身的肿瘤活检组织中,分离出肿瘤细胞周围浸润的淋巴细胞,这些细胞号称埋伏在癌细胞周围、识别杀伤能力最强的一支“抗癌敢死队”,这些数量不多但极其珍贵的免疫细胞经过体外扩增、培养后,就能得到数十亿个数量暴增、战斗力升级的TIL大军。一旦回输到患者体内,就可持续寻找并有效地摧毁癌细胞,而且还减少对正常细胞的损害,具有更大的治疗潜力和更少的副作用。值得一提的是,这种“活的”细胞可持续发挥作用,当体内再次出现癌细胞时,这些免疫细胞可快速识别并及时发动攻击。
TIL疗法是治疗实体瘤的“大杀器”,既可作为早期癌症患者术后的辅助治疗手段,消灭放化疗或手术后残留的癌细胞,从而预防肿瘤的复发及转移;又可作为晚期癌症患者的末线补救治疗措施,尽可能延长患者的生存时间。目前可用于黑色素瘤、结直肠癌、非小细胞肺癌、卵巢癌、乳腺癌、宫颈癌、头颈癌等多款实体瘤的治疗(详见下图)。
▼TIL疗法研究中的癌症类型分布
▲图源“PMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
二、TIL疗法助转移性乳腺癌患者,皮下病变完全消退
肿瘤浸润淋巴细胞(TIL)疗法已被证明可以介导持久的癌症消退,不仅在转移性黑色素瘤中,产生了持久的客观反应;而且在转移性上皮癌(包括乳腺癌)的治疗方面,也取得了不俗的疗效。
《临床肿瘤学杂志》近期报道了一个“转移性乳腺癌患者经TIL细胞治疗后,皮下病变完全消退”的案例。本例患者(4355号患者)确诊为转移性乳腺癌(mBrCa),医生从该患者切除的病变组织中,分离并培养TIL细胞,在接受了针对10种已确定的自体新抗原的7.2e10 TIL细胞回输,同时联合派姆单抗(≤4次剂量)治疗后,结果显示如下:
1、
CT扫描显示
:TIL治疗后
转移性沉积物消退,左锁骨上病变(红色圆圈)消退,这种部分反应(减少69%)持续了10个月
。
2、
连续摄影显示
:该患者
左乳和左锁骨上及右腋窝淋巴结病变的广泛皮下病变完全消退
(详见下图)。
▲图源“JCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
三、我国自研TIL产品群雄逐鹿,重拳出击多款实体瘤
(一)GT101暴击肺癌、黑色素瘤、宫颈癌,已有患者获完全缓解
GT101注射液是由砂砾生物研发的一款TIL细胞疗法,2022年4月22日,获中国NMPA的临床试验默示许可(受理号:CXSL2200061),它也是我国首个获批临床的TIL细胞产品!
GT101在2024年美国临床肿瘤学会(ASCO)大会上,公布了1期临床研究(NCT05430373)的惊艳数据。本次共入组14例中位年龄为46.9岁的实体瘤(包括小细胞肺癌、黑色素瘤、宫颈癌)患者,给予淋巴细胞清除+GT101回输治疗。
结果显示:总体(n=14)
客观缓解率(ORR)达到35.7%
,其中,
7.1%(1例)患者幸运地获得完全缓解(CR)
,部分缓解(PR)率达部分缓解(4例),57.1%(8例)的患者达到病情稳定(SD)。值得一提的是,在宫颈癌患者中(11/14),
客观缓解率(ORR)高达45.5%,其中1例患者获得完全缓解(CR)
,4例患者获得部分缓解(PR)。
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
除了ASCO大会上公布的数据外,《莫尔生物医学》还报道过“一位晚期复发及转移性宫颈癌患者,经GT101治疗28天,即达部分缓解,且淋巴结转移灶明显消退”的案例。
该患者确诊为复发/多发性转移性宫颈癌,计算机断层扫描显示,该患者左下腹部(详见图a,红色箭头)、左锁骨上淋巴结(详见图c,绿色箭头),均存在皮下转移。此时临床已无适合她的治疗方法了。
但好在天无绝人之路,医生顺利从她的腹股沟淋巴结转移灶中,扩增到了TIL细胞,这也使得她能够成功入组,接受IL-2(白细胞介素-2)+ICI(免疫检查点抑制剂)+GT101 TILs细胞回输治疗。并个最终在TILs回输后仅28天,幸运地达到了部分缓解(PR)。复查计算机断层扫描提示,锁骨上淋巴结萎缩(详见图b,黄色箭头)。
▼该患者在TILs回输前后,计算机断层扫描对比
▲截图源自“BMC官网”
注:
①图a红色箭头:代表左下腹部淋巴结;
②图c绿色箭头:代表左锁骨上淋巴结;
③图b黄色箭头:代表锁骨上淋巴结,TIL回输后可见明显萎缩;
④图d蓝色箭头:代表左下腹部皮下转移,与左侧一致。
(二)我国自研首款无需清淋的GC203,卵巢癌疾病控制率超83%
GC203是由上海君赛生物研发的全球首款非病毒载体基因修饰的TIL细胞疗法,并于2024年4月28日,获中国NMPA的批准进入临床研究阶段。与美国上市的Lifileucel不同,这款我国自研的TIL产品,在回输TIL细胞前,无需接受高强度非清髓性清淋预处理;TIL细胞回输后也无需输注任何剂量的IL-2。这极大避免了美国Lifileucel产品黑框警告的相关不良反应(如严重感染、持续性严重细胞减少症、心肺肾功能损伤等),所有患者仅需入住普通病房即可接受治疗,大幅提高了TIL疗法的安全性、可及性、便捷性。
在2024年ASCO大会上,公布了GC203一期临床研究(NCT05468307)的最新数据。本次共入组18例可评估疗效的复发性卵巢癌患者,既往接受过中位2.5线化疗方案(包括免疫检查点抑制剂、多聚ADP核糖聚合酶抑制剂)。入组接受GC203 TIL细胞治疗后,结果显示:
1、
疾病控制率(DCR)
:
DCR高达83.3%
(95%CI:60.8%~94.2%),其中
2例患者幸运地获得完全缓解(CR)
,4例达到部分缓解(PR),9例达到病情稳定(SD)。
2、
客观缓解率(ORR)
:
ORR达到33.3%
(95%CI:16.3%~56.3%)(详见下图)。
▲图源“JUN CELL官网”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、
总生存(OS)率
:
6个月的OS率高达75.6%
(范围:57.4%~99.6%);
12个月的OS率达到68.8%
(范围:49.3%~95.9%)。
▲图源“JUN CELL官网”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
其中一位卵巢子宫内膜样癌患者在GC203治疗后,幸运地达到部分缓解。该患者既往曾接受过5种全身治疗(包括化疗、PARP抑制剂),但病情仍持续进展。最终入组接受GC203 TIL细胞回输治疗,治疗后(2022年6月)复查影像学显示,肝脏及肺部的转移病灶明显缩小;2022年7月再次复查显示,肿瘤靶病灶显著缩小了66%,该患者达到部分缓解(PR)!
(三)我国其他在研的TIL产品
除了上面提到的两款TIL产品外,我国还有多款在研的TIL疗法正在开展临床研究,下面全球肿瘤医生网小编针对其中的几款代表性产品,进行简单介绍,以供癌友们参考。
1、
GT201:沙砾生物
GT201是沙砾生物自主研发的第二款TIL细胞产品,2023年7月11日,获国家药品监督管理局(NMPA)的临床试验默示许可,用于
复发或转移性实体瘤
的治疗,这也是
我国首款进入注册临床试验的基因编辑型TIL产品
。
2、
HS-IT101注射液:华赛伯曼
“HS-IT101注射液”是华赛伯曼公司研发的一款自体天然加强TIL产品,2023年11月29日,其新药IND申请,获中国国家药品监督管理局(NMPA)批准(受理号:CXSL2300599),用于
晚期实体瘤
的治疗。
3、
GC101:君赛生物
GC101是由君赛生物研发的
全球首个无需清淋及IL-2输注的天然TIL细胞治疗产品
。其临床新药IND申请,于2022年4月24日,获中国NMPA批准(受理号:CXSL2200070)。
GC101已在临床研究中,展现出良好的疗效,且安全性可控。全部入组患者中,有3例患者达到部分缓解(PR),另有2例患者幸运地获得完全缓解(CR),且CR持续时间分别>8个月、>6个月。
4、
ZLT-001注射液:智瓴生物
ZLT-001注射液是由智瓴生物自主研发的一款TIL细胞产品,2023年1月28日,获中国NMPA的临床试验默示许可(受理号:CXSL2200552),用于
晚期复发或转移性宫颈癌
的治疗,它也是
华南地区首个获批临床的TIL产品
。
5、
BST02:百吉生物
BST02是由百吉生物自主研发的一款重磅TILs细胞产品,2023年10月26日,美国食品药品监督管理局(FDA)批准了BST02的Ⅰ/Ⅱ期临床试验申请,用于
各类肝癌
的治疗,它也是
全球首个进入临床阶段的用于肝癌治疗的TIL细胞产品
。
6、
C-TIL051:西比曼生物
“C-TIL051”是西比曼生物研发的一款新型TIL产品,2022年10月,美国FDA批准了其临床新药IND申请,用于治疗
PD-1抗体难治或复发性晚期非小细胞肺癌(NSCLC)
。此外,C-TIL051还可用于
宫颈癌、黑色素瘤、头颈部鳞状细胞癌
等泛癌种实体瘤的治疗。
7、
HV-101注射液:天科雅生物
“HV-101注射液”是由天科雅生物及杭州厚无生物医药共同研发的一款新型TIL产品,2023年1月29日,获中国NMPA的临床试验默示许可(受理号为:CXSL2200574),用于晚期复发或转移性实体瘤的治疗。
8、
LM103注射液:蓝马医疗
“LM103注射液”是由苏州蓝马医疗公司研发的一款TIL产品,2023年7月13日,获中国NMPA的临床试验默示许可,用于治疗
晚期实体瘤
。值得一提的是,它是
国内首个获临床许可,使用滋养细胞(Feeder)工艺的TIL产品
。
四、小编寄语
TIL细胞疗法具有将癌症自身肿瘤组织“变废为宝”的神奇魔力,是隐藏在患者体内的最强抗癌军团。如今这款抗癌黑科技经过30多年的发展,终于从基础研究阶段,走向了临床!值得欣慰的是,近年来我国紧随美国的脚步,多家生物公司纷纷加入TIL产品的研发大军中,并有多款产品正式获批开展临床研究,主要针对非小细胞肺癌、乳腺癌、胆管癌、宫颈癌、食道癌、卵巢癌等多款实体瘤。想了解TIL疗法更多讯息的患者,可将近期病理及基因检测结果、治疗经历等资料,提交至
全球肿瘤医生网医学部
,进行初步评估。
五、参考资料
[1]Hong H,et al.Clinical trial landscape for TIL therapy: emerging insights and future directions in oncology. J Transl Med. 2024 Nov 8;22(1):1008.
https://pmc-ncbi-nlm-nih-gov.libproxy1.nus.edu.sg/articles/PMC11545542/
[2]Zacharakis N,et al.Breast cancers are immunogenic: immunologic analyses and a phase II pilot clinical trial using mutation-reactive autologous lymphocytes[J]. Journal of Clinical Oncology, 2022, 40(16): 1741-1754.
https://ascopubs-org.libproxy1.nus.edu.sg/doi/full/10.1200/JCO.21.02170
[3]Qin H,et al.Phase 1 study of GT101 as an autologous tumor infiltrating lymphocyte (TIL) therapy in advanced solid tumors[J]. 2024.
https://meetings.asco.org/abstracts-presentations/233955
[4]Zhao X,et al.T cell receptor repertoire characteristics and therapeutic potential of tumor infiltrating lymphocytes (TILs) derived from metastatic lymph node in cervical cancer. Mol Biomed. 2024 Nov 4;5(1):51.
https://pmc-ncbi-nlm-nih-gov.libproxy1.nus.edu.sg/articles/PMC11532323/
本文为全球肿瘤医生网原创,未经授权严禁转载
免疫疗法细胞疗法临床申请基因疗法
2024-02-19
·医药观澜
▎药明康德内容团队报道近日,细胞疗法领域迎来又一里程碑进展:美国FDA加速批准肿瘤浸润淋巴细胞(TIL)疗法lifileucel用于治疗晚期黑色素瘤,这不仅是首款获批的TIL疗法,也是首款获批治疗实体瘤的T细胞疗法。这一突破性进展再次引起了行业对TIL疗法的高度关注。在细胞和基因疗法(CGT)的治疗领域,实体瘤是一座难以逾越的高峰,肿瘤浸润淋巴细胞(TIL)以其肿瘤特异性强、浸润性好、安全性高等优势,已成为实体瘤治疗领域的新生力量。在中国,当前也有不少公司正在开发TIL疗法,以期早日将这种前沿疗法带给患者。本文根据公开资料分享了10余款中国公司开发的并已进入注册临床试验阶段(不含研究者发起的临床研究)的TIL产品信息,仅供读者参阅。(按企业公布的获批临床时间先后排序。本文为不完全统计,如有遗漏,欢迎补充)图片来源:药明康德内容团队制作公司:劲风生物产品:未披露劲风生物成立于2020年,专注于研发生物创新技术,特别聚焦在针对实体肿瘤的免疫细胞治疗产品开发和临床试验以及临床转化。根据劲风生物新闻稿,该公司研发的TIL细胞具有高杀伤性,对部分晚期肿瘤患者有明显的疗效。2022年2月,该公司宣布其开发的一款TIL药物已获美国FDA批准开展临床试验。公司:沙砾生物产品:GT101、GT201沙砾生物成立于2019年,专注于肿瘤免疫细胞治疗,已开发以TIL药物为代表的研发管线。2023年9月,沙砾生物完成了4亿元人民币的B轮融资。根据沙砾生物官网资料,该公司已开发了多款TIL疗法,其中:GT101于2022年4月在中国获得临床试验默示许可,即将在中国进入关键2期临床试验;GT201是一款基因编辑型TIL药物,已在中国获得临床试验默示许可;此外,沙砾生物还依托其技术平台开发了一系列下一代基因编辑型TIL药物。公司:君赛生物产品:GC101君赛生物成立于2019年,致力于TIL创新疗法与新药开发。目前,该公司已开发一系列天然TIL细胞新药及非病毒载体基因修饰TIL细胞新药。其中,君赛生物开发的天然TIL在研产品GC101于2022年4月在中国获得临床试验默示许可,正在开展针对晚期实体瘤的临床试验。2023年12月,研究人员在2023年欧洲肿瘤内科学会免疫肿瘤学大会上公布了GC101的临床试验进展,该研究的所有受试者均为标准治疗失败的晚期实体瘤患者(抗PD-1抗体耐药)。安全性数据表明,GC101安全性良好,未发生剂量限制性毒性(DLT),未观察到与GC101 TIL细胞直接相关的严重不良事件(SAE),受试者也无需转入无菌病房特护。有效性方面的数据显示,已有多例患者肿瘤明显缩小,客观缓解率超过35%,涵盖黑色素瘤、宫颈癌、非小细胞肺癌等不同癌种。公司:西比曼产品:C-TIL051西比曼生物科技专注于开发创新型细胞治疗产品,用于治疗恶性血液肿瘤、实体肿瘤以及炎症和免疫疾病。2022年10月,该公司开发的TIL产品C-TIL051获得FDA批准开展1期临床试验,用于治疗实体瘤患者。公司:智瓴生物产品:ZLT-001智瓴生物(BT Gillion Biotherapeutics)成立于2016年,专注免疫细胞治疗领域。该公司已通过与高校、科研院所团队合作,开发基于TIL智能化平台TILBO的新一代TIL产品。2023年1月,智瓴生物宣布其自主研发的创新TIL细胞药物ZLT-001注射液在中国获得临床试验默示许可,拟开发用于治疗晚期复发或转移性宫颈癌。公司:厚无生物/天科雅产品:HV-101厚无生物成立于2021年,专注于开发基于TIL的实体瘤创新疗法,现有多款TIL候选药物。天科雅成立于2016年,专注于肿瘤免疫细胞治疗技术的创新性研发和产业化。2023年1月,厚无生物和天科雅联合提交的实体瘤TIL疗法HV-101注射液在中国获得临床试验默示许可,拟开发用于治疗晚期复发或者转移性实体瘤。公司:蓝马医疗产品:LM103蓝马医疗(LMBIO)成立于2020年12月,专注于开发以TIL疗法为核心的细胞免疫治疗产品。目前该公司的主要在研产品覆盖包括宫颈癌、非小细胞肺癌、恶性黑色素瘤、头颈肿瘤等在内的多种实体瘤。其中,蓝马医疗开发的LM103注射液已于2023年7月在中国获得临床试验默示许可,拟开发用于治疗晚期实体瘤。公司:百吉生物产品:BST02百吉生物专注免疫细胞治疗,在新加坡成立,并在中国广州设有分公司 。2023年10月,该公司开发的TIL产品BST02获得FDA批准开展临床试验。2024年1月,由广州百吉生物制药有限公司申报的BST02注射液也在中国获得临床试验默示许可,拟用于治疗肝癌。2024年2月,百吉生物宣布BST02注射液还获得FDA授予快速通道资格,用于治疗所有类型的肝癌,包括肝细胞癌和胆管癌。公司:华赛伯曼产品:HS-IT101华赛伯曼成立于2019年3月,致力于开发具有创新性的细胞药物,重点开发针对实体肿瘤的TIL细胞药物。2023年11月,该公司研发的自体天然TIL细胞药物HS-IT101注射液已获得NMPA临床试验默示许可,拟开发用于治疗晚期实体瘤。此外,该公司还开发了基因改造的TIL产品HS-IT201、HS-IT301。2024年1月,华赛伯曼刚完成了数千万元A轮融资,以推进该公司的TIL管线研发进度。公司:翊寿科技产品:自体肿瘤浸润淋巴细胞注射液根据CDE官网,武汉翊寿科技和海南翊寿科技联合申报的1类新药“自体肿瘤浸润淋巴细胞注射液”已于2023年获批临床,拟开发用于肝癌等实体瘤的治疗。除了上述产品,还有一些其它中国公司也在开发TIL产品,限于篇幅,本文不再一一介绍。希望这些在研的TIL产品后续临床开发顺利进行,早日惠及广大病患。参考资料:(可上下滑动查看)[1]中国国家药监局药品审评中心(CDE)官网.From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c][2]沙砾生物官方微信.Retrieved Feb 17 , 2024, from https://mp.weixin.qq.com/s/U0vb8DpHvvBo2BR8tC543Q[3]蓝马医疗LM-103注射液正式获得国家药品监督管理局临床试验默示许可. Retrieved July 14 , 2024, from https://mp.weixin.qq.com/s/cZ4C2gzjtXmZf3hRvO275w[4] 厚无生物-天科雅实体瘤TIL疗法IND获批Retrieved Jan 30 , 2023,from http://www.hervortherapeutics.com/News/index_6.html[5]劲风生物官方微信. Retrieved Feb 11 , 2023, from https://mp.weixin.qq.com/s/4xoKK030eA8codVZ-OOAYA[6]智瓴生物ZLT-001注射液正式获得国家药品监督管理局临床试验默示许可. Retrieved Jan 28 , 2023, from https://mp.weixin.qq.com/s/XqYueT1GlQO5zPh99v6cKg[7]君赛生物官方网站. From https://www.juncell.com/pipeline本文由药明康德内容团队根据公开资料整理编辑,欢迎个人转发至朋友圈。转发授权请在「医药观澜」微信公众号留言联系我们。其他合作需求,请联系wuxi_media@wuxiapptec.com。免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
细胞疗法免疫疗法基因疗法临床2期上市批准
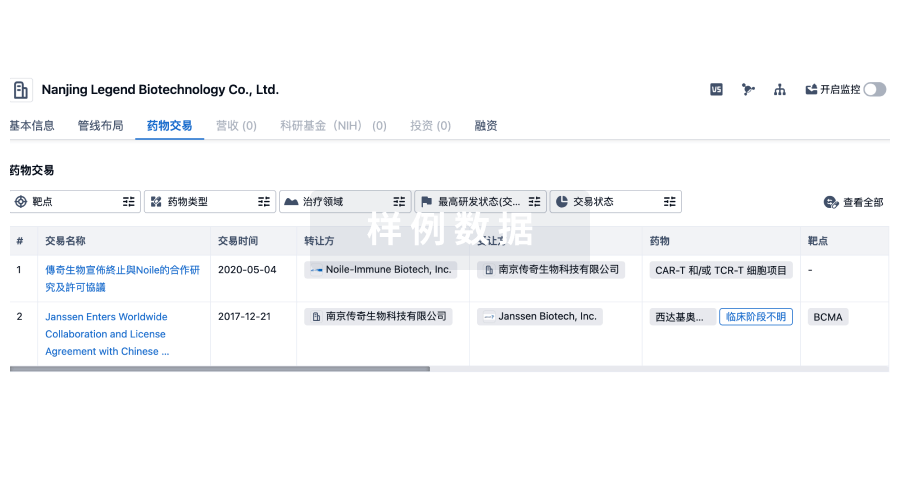
100 项与 杭州厚无生物医药科技有限公司 相关的药物交易
登录后查看更多信息
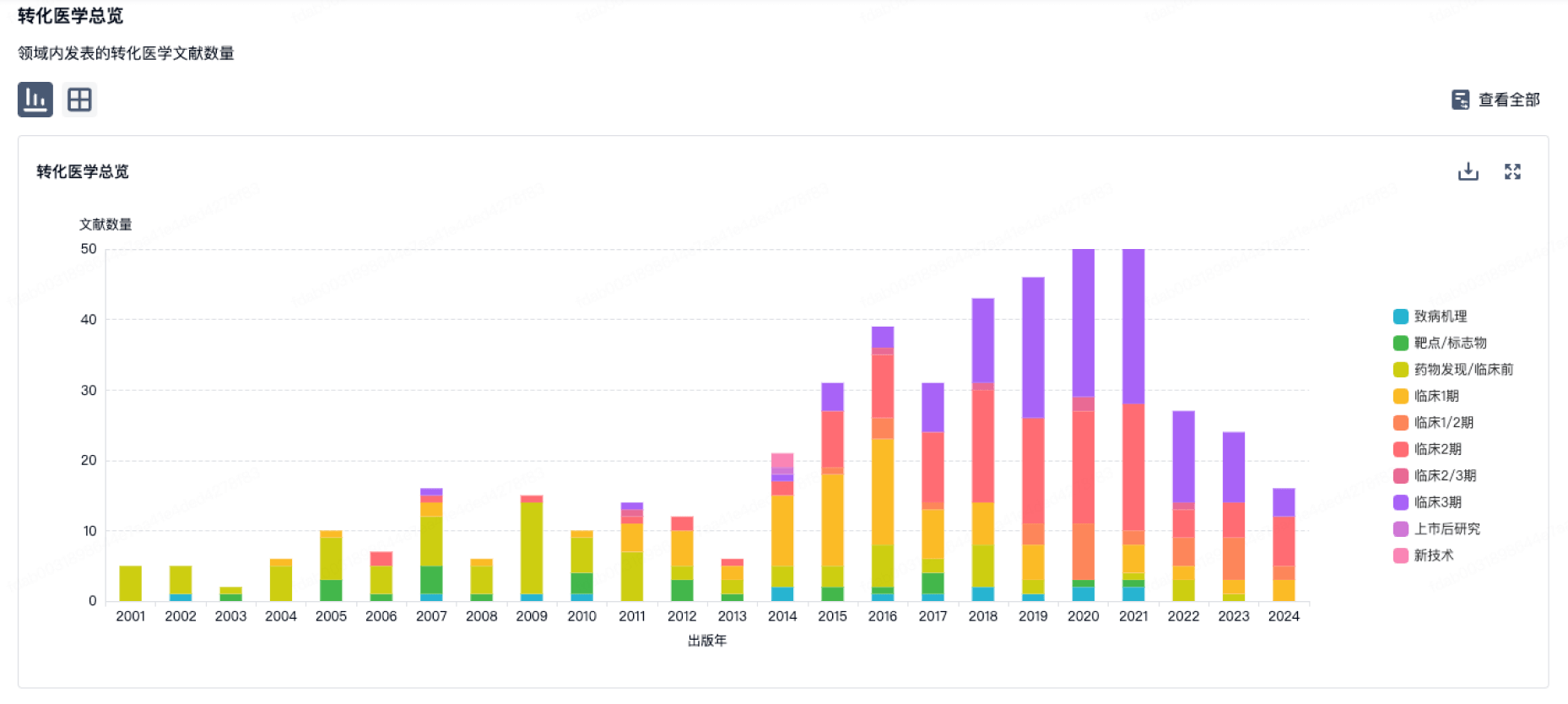
100 项与 杭州厚无生物医药科技有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年09月02日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
临床1期
1
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
