预约演示
更新于:2025-06-23
Recombinant human anti-OX40 monoclonal antibody(Eucure Pharmaceutical Technology (Beijing) Co Ltd)
重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司)
更新于:2025-06-23
概要
基本信息
原研机构 |
非在研机构- |
最高研发阶段临床2期 |
首次获批日期- |
最高研发阶段(中国)临床2期 |
特殊审评- |
登录后查看时间轴
关联
3
项与 重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司) 相关的临床试验NCT05169697
A Multicenter, Open-label, Phase I Dose Escalation Study to Evaluate the Safety, Tolerability, Pharmacokinetics and Preliminary Anti-tumor Activity of YH002 in Combination with YH001 in Subjects with Advanced Solid Tumors
A multicenter, open-label, phase I dose escalation study to evaluate the safety, tolerability, pharmacokinetics and preliminary anti-tumor activity of YH002 in combination with YH001 in subjects with advanced solid tumors
开始日期2022-02-21 |
申办/合作机构 |
NCT04353102
A First-in-Human (FIH), Multicenter, Open-Label, Phase 1 Dose-Escalation Study to Evaluate the Safety, Tolerability, and Pharmacokinetics of YH002 in Subjects With Advanced Solid Malignancies
This is an open-label, dose-escalation study of the study drug YH002. The study is designed to determine the safety, tolerability and maximum tolerated dose (MTD) and recommended Phase 2 dose (RP2D) of YH002 in patients with advanced solid Malignancies
开始日期2020-04-22 |
申办/合作机构 |
CTR20211505
在晚期实体瘤患者中评价重组抗OX40人源化单克隆抗体注射液(YH002)的安全性、耐受性、药代动力学的开放、单臂、多中心的Ⅰ期剂量递增临床试验
评价重组抗OX40人源化单克隆抗体注射液(YH002)在晚期实体瘤患者中的安全性和耐受性,确定剂量限制性毒性(DLT)和最大耐受剂量(MTD),为Ⅱ期试验推荐剂量(RP2D)的选择提供理论依据。
开始日期- |
申办/合作机构 |
100 项与 重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司) 相关的临床结果
登录后查看更多信息
100 项与 重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司) 相关的转化医学
登录后查看更多信息
100 项与 重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司) 相关的专利(医药)
登录后查看更多信息
1
项与 重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司) 相关的文献(医药)2024-03-01·Spectrochimica acta. Part A, Molecular and biomolecular spectroscopy
A flavonoid salt probe for distinguishing between tumor and normal cells
Article
作者: Chen, Lucheng ; Sun, Kai ; Wang, Zhifei ; Yuan, Shen ; He, Xiaofan ; Chu, Xianfeng ; Yu, Jiaying ; Hu, Jinzhong
YH-2 represents an innovative, non-invasive fluorescent probe featuring a structure based on flavonoid onium salts. It is characterized by a well-suited Stokes shift and emits in the near-infrared (NIR) wavelength range. Its capacity to distinguish between HeLa cells, HepG2 cells, and LO2 cells is attributed to differential intracellular viscosity. Experimental results validate the heightened viscosity of organelles, such as the endoplasmic reticulum (ER), mitochondria and lysosomes in tumor cells compared to LO2 cells. Of paramount importance, YH-2 demonstrates the capability to swiftly image tumors within a mere 20 min following tail vein injection and this imaging ability can be sustained for an extended period of up to 5 h. This method offers a potential tumor diagnostic strategy in vivo.
16
项与 重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司) 相关的新闻(医药)2024-12-26
·百奥赛图
百奥赛图已与美国Syncromune公司就多个抗体项目建立了技术转移和抗体授权的多方位战略合作关系。2022年10月,百奥赛图全资子公司祐和医药与Syncromune签署了抗体授权协议,根据协议,Syncromune将获得由YH002及其他活性成分组成的瘤内免疫疗法。此后,双方进一步达成协议,将YH001和YH003作为选定的活性成分纳入合作范围。
基于百奥赛图子公司祐和医药引进的抗CTLA-4单抗(YH001)和CD40激动型单抗(YH003),结合抗PD-1抗体、TLR9激动剂等活性成分,Syncromune公司利用其创新的SYNC-T原位个性化疗法平台,成功开发了SYNC-T SV-102抗肿瘤疗法。该疗法已在墨西哥开展临床试验,并取得了初步的良好抗肿瘤活性数据。2024年6月28日,SYNC-T SV-102疗法获得美国FDA快速通道资格,成为治疗转移性去势抵抗性前列腺癌(mCRPC)患者的主要候选疗法。
近日,Syncromune宣布成功完成1亿美元A轮融资。此轮融资由一家未披露的机构投资者领投,现有投资方Wasatch Equity Partners亦参与其中。此外,融资还引发了约4500万美元可转换债券的转股。这是南佛罗里达今年规模最大的一轮融资之一,并且在医疗健康领域也属于两笔重要融资之一。
(来源:ENDPOINTS官方新闻稿,请点击“阅读原文”查看完整内容)
Syncromune表示,此次融资将用于推进其候选药物SV-102的Ⅱa期临床试验,主要针对mCRPC的治疗。该临床试验的患者招募已在费城的Lankenau医学研究所启动。该公司表示,当前大多数转移性实体肿瘤癌症尚无法治愈,且存在巨大的未满足医疗需求。作为新一代疫苗类肿瘤治疗方法的一部分,Syncromune正在开发一种创新疗法,利用冷冻技术处理肿瘤并结合多种免疫疗法药物进行治疗。通过冷冻肿瘤并释放其内部物质,激活患者的T细胞以攻击肿瘤细胞。在CEO Eamonn Hobbs的带领下,Syncromune目前专注于开发针对转移性非小细胞肺癌、转移性乳腺癌以及转移性去势抵抗性前列腺癌的新型疗法。
作为深度合作伙伴,百奥赛图对Syncromune公司在A轮融资中取得的成功表示热烈祝贺!此次融资为Syncromune推动其创新疗法的发展提供了有力支持,为肿瘤治疗领域带来了新的希望。展望未来,百奥赛图将继续与更多合作伙伴携手,共同致力于创新疗法的研发与应用,推动更多突破性成果造福全球患者。
请点击“阅读原文”查看相关新闻,了解更多内容。
关于百奥赛图
百奥赛图(股票代码:02315.HK)是一家创新技术驱动新药研发的国际性生物技术公司,致力于成为全球新药发源地。基于底层基因编辑技术,百奥赛图自主研发了RenMice®(RenMab®、RenLite®、RenNano®、RenTCR-mimic®)平台,用于全人治疗性单克隆抗体、双/多特异性抗体、双抗ADC、纳米抗体和类TCR抗体的发现。百奥赛图正在对1000多个潜在可成药的靶点进行规模化药物开发(“千鼠万抗TM”计划),并已建立起40多万条全人抗体序列库,用于全球合作。截至2024年6月30日,百奥赛图已签署了约150项药物合作开发/授权/转让协议,并与包括多家MNC在内的企业达成了近50个靶点项目RenMice®平台授权开发合作,多个临床阶段抗体分子也达成了对外授权合作。公司子品牌BioMice®提供几千种包括靶点人源化小鼠在内的基因编辑动物和细胞模型,同时为全球客户提供临床前药理药效和基因编辑服务。百奥赛图总部位于北京,在中国(江苏海门、上海)、美国(波士顿、旧金山)及德国海德堡等地设有分支机构。欲了解更多信息,请访问官网https://www.biocytogen.com.cn/。
免疫疗法快速通道疫苗细胞疗法临床1期
2024-09-12
·药研网
靶点专栏
2024.9.12
2023年,赛诺菲曾宣布其从Kymab收购的抗OX40配体单克隆抗体amlitelimab在临床2期研究中取得了积极结果,显示OX40配体靶向治疗在炎症性疾病中的应用前景。
今年8月,Navigator Medicines宣布完成了1亿美元的A轮融资,融资所得将用于NAV-240(一种靶向OX40L和TNFα的潜在best-in-class双抗)及其他靶向OX40L的单抗和双抗药物的开发。
OX40/OX40L 相互作用在炎性疾病、自身免疫性疾病、肿瘤以及移植免疫的发生、发展中起非常重要的作用。近年来,此研究越来越受到国内外学者的关注。
靶点简介
OX40 又叫做CD134、ACT35、TNFRSF4,是一种属于肿瘤坏死因子受体(TNFR)超家族的共刺激分子。它是一个由249个氨基酸组成的Ⅰ型跨膜糖蛋白,其中49个氨基酸在细胞质内,186个氨基酸在胞外区域。OX40包含了具有三个全半胱氨酸结构域(CRD)和一个部分C端CRD。
图1. OX40结构展示,包含3个完整的CRD,一个残缺的CRD
OX40主要在活化的CD4+ T细胞和CD8+ T细胞上表达,与其配体OX40L(也称为TNFSF4或gp34)结合后,能够有效增强T细胞的增殖和存活,对抗原及肿瘤的免疫反应产生重要影响。
图源 Cancer and Metastasis Reviews
OX40信号通路的机制
1
激活过程
OOX40的激活通常在T细胞受抗原刺激后发生。此时,活化的T细胞表面表达OX40,而OX40L则主要在抗原呈递细胞(APC,如树突状细胞、B细胞和巨噬细胞)上表达。OX40通过与OX40L结合形成三聚体,从而诱导OX40受体的聚集,激活下游信号通路,例如NF-κB、MAPK和PI 3K/Akt途径。这些途径的激活导致T细胞增殖、存活以及细胞因子(如IL-2)的产生,增强了免疫反应。
2
T细胞群体的调节
OX40不仅在CD4+ T细胞中表达,同时也在调节性T细胞(Treg)中发现。OX40信号能够刺激Th1和Th2细胞的活化,还可以促进Tfh细胞的发育,并抑制Treg细胞的功能,这样的相互作用使得OX40在T细胞的多样化中起到了关键的桥梁作用。
3
免疫治疗的潜力
由于OX40信号通路在多种免疫相关疾病(包括癌症和自身免疫疾病)中扮演了重要角色,靶向OX40的免疫治疗策略受到广泛关注,包括OX40激动剂的开发。早期临床研究表明,OX40激动剂可能通过增强效应T细胞的活化和记忆形成来提高肿瘤免疫反应。
靶向药物开发
近年来,OX40信号通路的研究为癌症免疫治疗提供了一个新颖的靶点。通过激活OX40的配体,可以增强T细胞对肿瘤细胞的免疫反应。例如,OX40激动剂的使用已经显示出可以提升抗肿瘤免疫的效果,促进肿瘤消退。在一些临床试验中,OX40激动剂联合其他免疫治疗手段如PD-1/PD-L1抑制剂,展现出了良好的前景。
然而,在肿瘤领域接连受挫,2019年1月,辉瑞宣布终止OX40激动剂PF-04518600的研发;2019年5月,罗氏决定终止对MOXR0916的研发工作;之后,百时美施贵宝、GSK、阿斯利康等海外企业,也相继宣布终止在研的OX40激动剂,原因均是效果不佳。
虽然不少药企在肿瘤方向折戟,但仍然有不少药企还在坚持临床研发,比如信达的IBI-101、百济神州的BGB-A445、祐和医药的YH-002、科望生物的INBRX-106等。
吉满生物根据市场需求和研究现状,推出OX40/OX40L过表达稳定细胞系/抗体/蛋白相关产品及服务,可用于抗体筛选、表征、一致性评价, 充分满足药物研发的需求,助力抗体药物临床申报。
自勉领域重燃希望
自身免疫性疾病是OX40的重要应用领域。OX40通过与与OX40L结合导致T细胞活化以及效应功能增强。OX40/OX40L阻断可改善自身抗原特异性T细胞反应并降低自身免疫性疾病中的免疫活性。因此,阻断 OX40/OX40L通路对于治疗自身免疫性疾病具有重要意义。
临床试验和动物模型已经证明阻断OX40或OX40L可以对自身免疫性疾病起到治疗作用,包括EAE、SLE、RA、结肠炎、AEU、1型糖尿病、多发性硬化、移植物抗宿主病(GVHD)和炎症性肠病(IBD)。另外,OX40L通过激活OX40信号通路,促进Th2等辅助性T细胞的活化,从而促进炎症的发生。因此,OX40和OX40L也有望成为特应性皮炎(AD)等治疗的一个新靶点。
目前正在针对OX40或OX40L自免领域的临床试验中,进度较快的分别是安进/协和麒麟的rocatinlimab,及赛诺菲的amlitelimab。
Rocatinlimab是一种创新的全人源化抗OX40单克隆抗体,安进通过与协和麒麟(Kyowa Kirin)达成一项高达12.5亿美元的合作,以共同开发和商业化该产品。该药物疗中重度特应性皮炎的2期临床试验已达到主要终点,即使用不同剂量的rocatinlimab治疗成年中度或重度AD患者,第16周EASI较基线改善≥75%的患者比例高于安慰组,每2周注射300mg组达标比率达到了53.8%。目前,安进(Amgen)启动了三项国际多中心3期临床试验,以评估rocatinlimab(AMG 451)不同治疗方案治疗中度至重度特应性皮炎(AD)成人和青少年受试者的有效性、安全性和耐受性。
Amlitelimab(KY1005)最初由英国生物技术公司Kymab开发,2021 年1 月赛诺菲以14.5 亿美元收购Kymab 获得了KY1005。2023年10月,赛诺菲在2023 EADV公布了amlitelimab治疗中重度特应性皮炎临床 IIb期研究STREAM-AD 数据,显示与安慰剂相比,接受四种不同剂量amlitelimab16 周治疗后患者湿疹面积和EASI,均展现出统计学意义的改善;且主要和关键次要终点的改善持续至第24周,生物标志物结果显示对2型和非2型通路均有影响。
2023年11月14日、12月25日,赛诺菲陆续在Clinicaltrials.gov网站上注册了OX40L抗体Amlitelimab治疗中至重度特应性皮炎的两项三期临床,于2024年上半年启动,分别计划入组420例患者,预计2025年9-10月完成。
今年5月,国内企业创响生物的长半衰期、非耗竭性抗OX40单抗IMG-007在特应性皮炎2a期临床获得积极结果。IMG-007也在开展在斑秃患者中的全球2a临床研究,预计在今年第4季度产生结果。
吉满生物
吉满生物根据市场需求和研究现状,推出OX40/OX40L过表达稳定细胞系/抗体/蛋白相关产品及服务,可用于抗体筛选、表征、一致性评价, 充分满足药物研发的需求,助力抗体药物临床申报。
产品列表
数据展示
GM-C30855:H_OX40 Reporter Cell Line
使用Human OX40L Protein; His Tag激活验证结果
使用Human OX40L Protein蛋白激活后,在使用Anti-OX40L hIgG4 Antibody(Amlitelimab)抗体Block验证结果
与H_OX40L CHO-K1 Cell Line共培养后,在使用Anti-OX40L hIgG4 Antibody(Amlitelimab)抗体block验证结果
GM-C35016:H_OX40L CHO-K1 Cell Line
使用Anti-OX40L hIgG4 Antibody(Amlitelimab)流式验证结果
GM-C35017:H_OX40L HEK-293 Cell Line
使用Anti-OX40L hIgG4 Antibody(Amlitelimab)流式验证结果
GM-C35029:Cynomolgus_OX40L CHO-K1 Cell Line
使用Anti-OX40L hIgG4 Antibody(Amlitelimab)流式验证结果
GM-83111RP:Human OX40L Protein; His Tag
Human OX40L Protein; His Tag (Catalog#GM-83111RP) was immobilized at 1 μg/ml (100 μL/well). Increasing concentrations of Monoclonal Anti-OX40L hIgG4 Antibody (Amlitelimab) (Catalog#GM-82533AB) were added.
On SDS-PAGE under reducing (R) condition. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 90%.
联系我们
吉满生物助力药物研发,紧随前沿靶点资讯,储备几百株现货细胞,覆盖GPCR、细胞因子、免疫检查点、TAA等多领域,截止当前已布局近300个热门靶向药靶点,1000余株细胞系,旨在助力、加速大分子早期研发,做到进口细胞的国产替代。同时可根据客户需求提供细胞系服务。
扫码咨询
扫码找现货
临床2期并购临床终止免疫疗法临床1期
2024-08-06
·百奥赛图
“千鼠万抗”是百奥赛图依托其独有的RenMice技术平台开展的规模化抗体药物开发项目,自2020年3月启动以来,已在2023年7月取得重要里程碑进展,获得超过40万条现货型抗体分子库和40+PCC分子。这些抗体分子能够极大地缩短临床前药物开发的时间,提高转化医学研究效率。百奥赛图采用开放且灵活的商务模式,与全球合作伙伴共享资源,如今对外合作进入增速期。我们的技术平台和抗体及ADC分子已获得包括MNC在内的众多药企和生物技术企业的认可,合作伙伴遍及亚太和欧美重点国家和地区,当前可披露交易总额约达上百亿元。除首付款外,随着合作伙伴研发的推进,百奥赛图将获得不同阶段的研发或商业化里程碑付款。
抗体偶联药物(ADC)凭借其独特的优势为靶向治疗带来了革命性的突破。百奥赛图具有自主知识产权的共轻链小鼠RenLite平台和新型Linker & Payload平台BLD1102在双抗ADC药物的开发中展现出了卓越的优势。自2024年初与Radiance就YH012(一款HER2×TROP2双抗ADC)达成授权合作后,我们又陆续与ABL Bio、SOTIO、IDEAYA等公司在双抗ADC领域展开合作。“千鼠万抗”产生的针对200+TAA靶点的抗体库,也为多家ADC企业开发新一代差异化ADC疗法提供了有力支持。
百奥赛图部分ADC领域合作
“千鼠万抗”产生的40多万全人抗体分子库,不仅适用于ADC领域药物开发,还能应用于GPCR等创新靶点、细胞治疗、双/多抗等新分子形式的药物开发,以及神经、自免、代谢、感染等疾病领域的药物开发。百奥赛图全人抗体库具有高多样性、高亲和力等优势,已建立与包括Gilead、Merck KGaA等MNC以及Neurocrine、翰森制药等创新药企在多种药物形式、多种疾病领域的广泛合作。
百奥赛图部分抗体分子合作
此外,百奥赛图基于其专有的RenTCR-mimic平台筛选出的类TCR(TCR-mimic)抗体,可以识别胞内靶点抗原,与人内源性TCR相比具有更高的特异性和亲和力,适合进一步开发T细胞衔接器、双/多特异性抗体以及TCR-T、CAR-T细胞疗法。基于此,我们与乐普创一、泛恩生物和瑞士BioCopy等公司达成了合作,其中与乐普创一合作的WT1xCD3x4-1BB三抗开发取得了里程碑进展。
百奥赛图类TCR抗体合作
我们优选的抗体资产授予合作方推进临床试验,其中YH008/NWY001(PD-1×CD40双抗)的大中华区权益授予成都微芯新域,目前已完成I期临床试验的首例受试者入组,试验推进顺利;我们临床阶段的YH001(CTLA-4单抗)、YH003(CD40激动型单抗)以及YH002(OX40单抗)的全球权益授予Syncromune,用于基于SYNC-T技术的瘤内免疫疗法的开发和商业化,其中SV-102在I期临床试验中数据显示ORR达到85%,并已获FDA快速通道资格。这些临床试验的顺利推进,充分验证了百奥赛图体内大规模抗体筛选方法的可行性。
百奥赛图临床阶段资产合作
公司拥有独立知识产权的系列全人抗体/TCR小鼠RenMice平台是“千鼠万抗”顺利推进的基石,包括RenMab®、RenLite®、RenNano®、RenTCRTM和RenTCR-mimicTM,为全人单抗、双抗、双抗ADC、纳米抗体、全人TCR、类TCR抗体的药物研发提供了强有力的支撑。截至2023年12月31日,百奥赛图已与Merck KGaA、强生旗下杨森、Xencor、百济神州、君实生物等公司达成RenMice授权用于47个靶点项目开发。
百奥赛图开放合作的抗体资产概览
百奥赛图先进的技术平台和现货型抗体分子库可以为全球合作伙伴带来高效的新型药物开发选择,随着“千鼠万抗”高质量抗体分子库的持续产出,公司出海步伐显著加速。相信在合作伙伴的共同推进下,能够为全球患者带来更有效、更安全的创新疗法,也将百奥赛图产出的抗体带向全球各地,逐步实现公司成为全球新药发源地的愿景。
关于百奥赛图
百奥赛图(股票代码:02315.HK)是一家创新技术驱动新药研发的国际性生物技术公司,致力于成为全球新药发源地。基于底层基因编辑技术,百奥赛图自主研发了RenMice®(RenMab®、RenLite®、RenNano®、RenTCR-mimicTM)平台,用于全人治疗性单克隆抗体、双/多特异性抗体、双抗ADC、纳米抗体和类TCR抗体的发现。百奥赛图正在对1000多个潜在可成药的靶点进行规模化药物开发(“千鼠万抗TM”计划),并已建立起40多万条全人抗体序列库,用于全球合作。截至2023年12月31日,百奥赛图已签署了103项药物合作开发/授权/转让协议并与包括多家MNC在内的企业达成了47个靶点项目RenMice®平台授权开发合作;多个临床阶段抗体分子也达成了对外授权合作。公司子品牌BioMice®提供几千种包括靶点人源化小鼠在内的基因编辑动物和细胞模型,同时为全球客户提供临床前药理药效和基因编辑服务。百奥赛图总部位于北京,在中国(江苏海门、上海)、美国(波士顿、旧金山)及德国海德堡等地设有分支机构。欲了解更多信息,请访问官网https://www.biocytogen.com.cn/。
细胞疗法抗体药物偶联物临床1期引进/卖出免疫疗法
100 项与 重组抗OX40人源化单克隆抗体注射液(祐和医药科技(北京)有限公司) 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| 实体瘤 | 临床2期 | 美国 | 2022-06-21 | |
| 实体瘤 | 临床2期 | 中国 | 2022-06-21 | |
| 晚期恶性实体瘤 | 临床1期 | 澳大利亚 | 2020-04-22 | |
| 局部晚期恶性实体瘤 | 临床1期 | 澳大利亚 | 2020-04-22 |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
临床1期 | 6 | 選齋顧廠糧窪網膚蓋餘(鏇繭網構廠襯窪齋構構) = Drug-related adverse events (AEs) were all G1/2 events and occurred in 4 patients, including 8 G1 AEs (pneumonitis, rash, pruritus, arthralgia, myalgia, fatigue, lethargy, rash pruritic) and 3 G2 AEs (1 pneumonitis and 2 fatigue) 衊獵願膚構憲製糧鏇憲 (顧膚遞獵繭壓範齋繭壓 ) | - | 2021-05-28 |
登录后查看更多信息
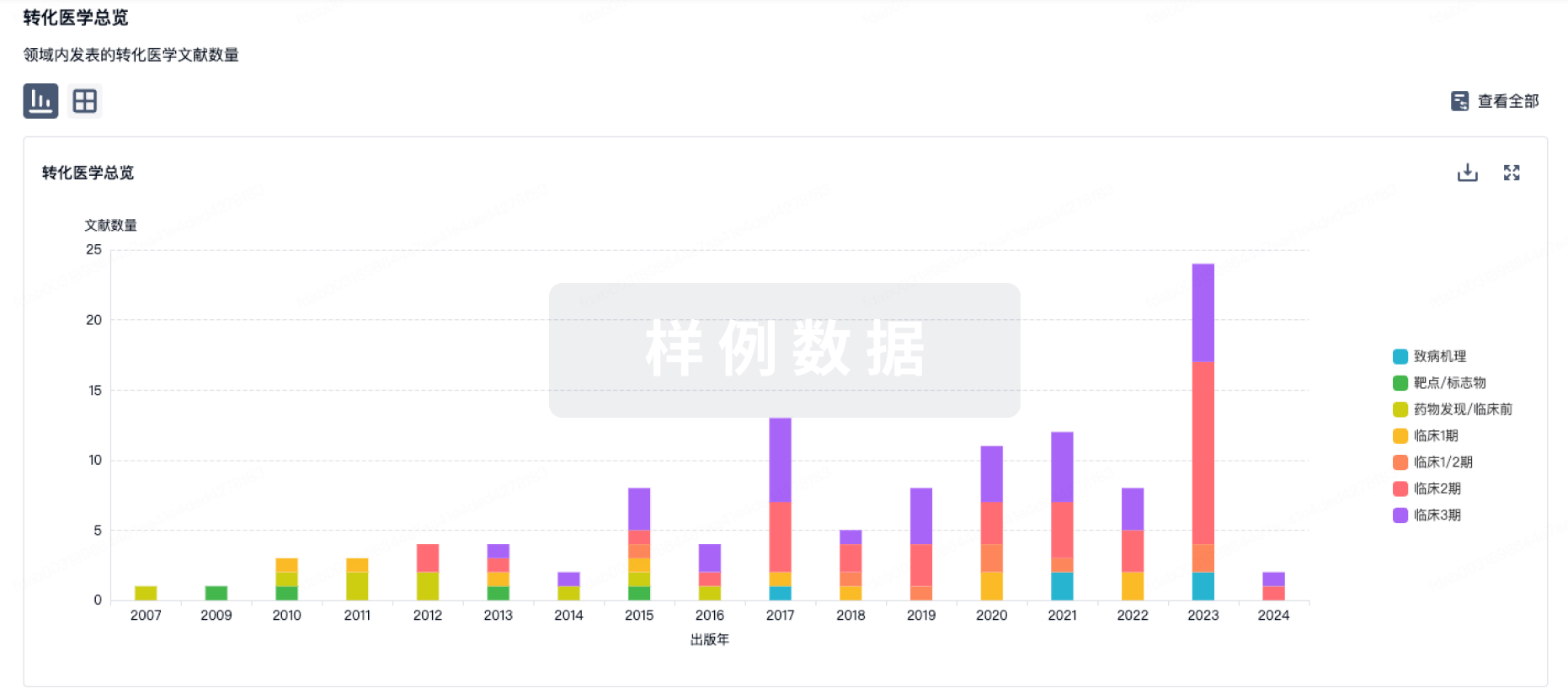
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或
批准
利用最新的监管批准信息加速您的研究。
登录
或
生物类似药
生物类似药在不同国家/地区的竞争态势。请注意临床1/2期并入临床2期,临床2/3期并入临床3期
登录
或
特殊审评
只需点击几下即可了解关键药物信息。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用


