预约演示
更新于:2025-10-18
ANGPTL3 siRNA(Rona Therapeutics)
更新于:2025-10-18
概要
基本信息
原研机构 |
在研机构 |
非在研机构- |
权益机构- |
最高研发阶段临床前 |
首次获批日期- |
最高研发阶段(中国)临床前 |
特殊审评- |
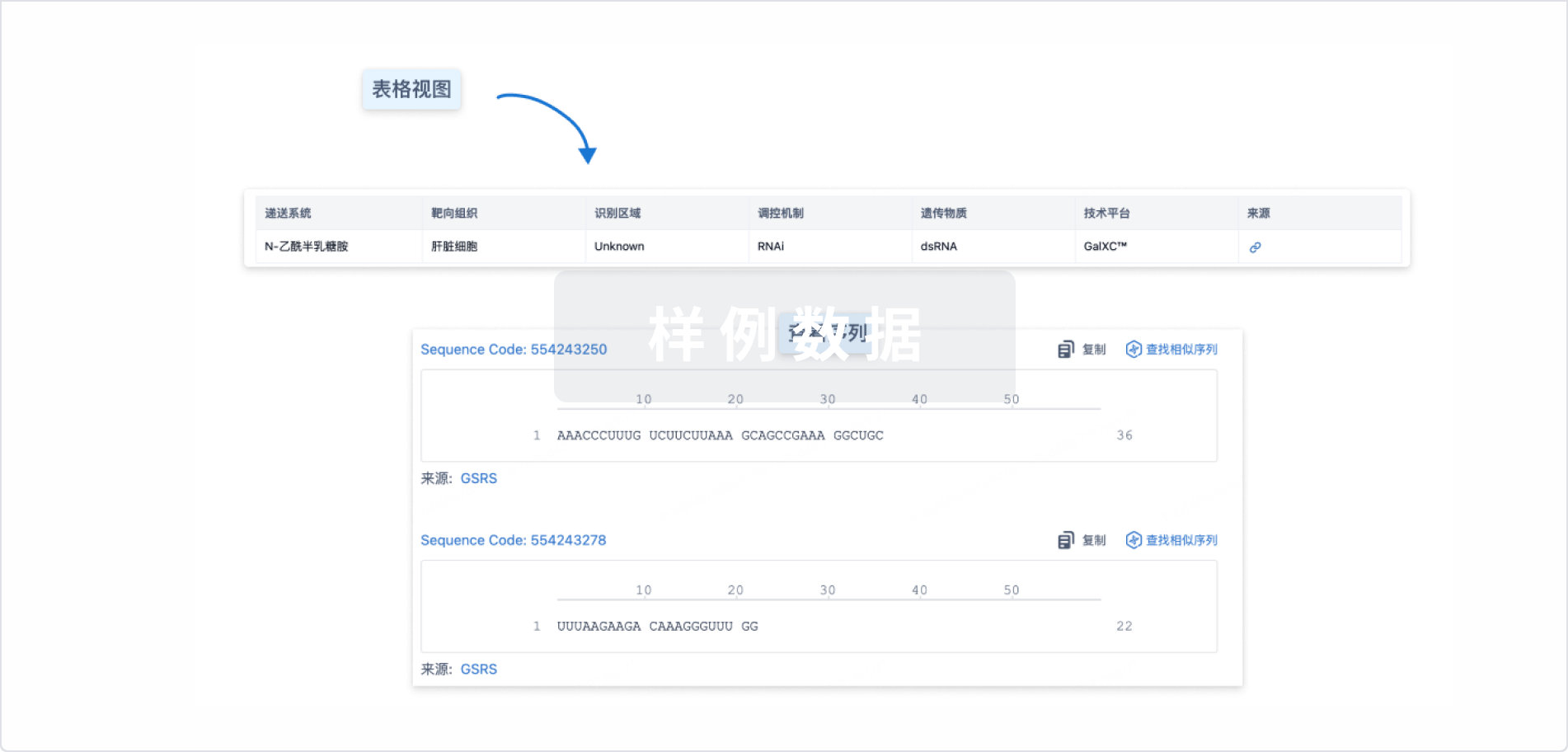
结构/序列
使用我们的RNA技术数据为新药研发加速。
登录
或
关联
100 项与 ANGPTL3 siRNA(Rona Therapeutics) 相关的临床结果
登录后查看更多信息
100 项与 ANGPTL3 siRNA(Rona Therapeutics) 相关的转化医学
登录后查看更多信息
100 项与 ANGPTL3 siRNA(Rona Therapeutics) 相关的专利(医药)
登录后查看更多信息
6
项与 ANGPTL3 siRNA(Rona Therapeutics) 相关的新闻(医药)2025-09-06
·汇聚南药
诺华正在下一盘大棋!
近期,诺华大动作频频,不仅以潜在总额53.6亿美元与舶望制药合作开发多款心血管siRNA疗法,还接连加码神经科学领域,先是以超8亿美元与BioArctic合作开发神经退行性疾病新疗法,又斥资22亿美元引进Arrowhead一款治疗帕金森病的siRNA疗法。
剥离了仿制药业务后的诺华,开始全力出击siRNA疗法、聚焦创新药,带来了不少看点。
TONACEA
01
全力出击siRNA疗法
诺华之所以与舶望制药深化心血管领域合作,背后有着深层逻辑。
心血管-肾脏-代谢业务(CRM)是诺华四大核心治疗领域之一,2025年上半年实现收入同比增长26%至51.73亿美元,成为公司第二大收入来源。其中,重磅心衰药物Entresto(沙库巴曲缬沙坦)实现销售额同比增长22%至46.18亿美元,贡献了CRM业务90%的营收,而且占公司总收入的比重近17%%,是诺华第一大支柱产品。
不过,作为一款已上市11年的产品,Entresto面临增长乏力困境,加之专利即将到期、仿制药将进入美国市场,以及2026年开始执行医保价格(降幅53%),销售额将受到较大冲击。
基于此,诺华在今年3月宣布调整心血管业务的商业化战略,将重心转移至其他高潜力心血管药物,包括销售额保持高速增长的Leqvio(inclisiran,英克司兰钠),以及3款肾病新药:CFB抑制剂Fabhalta(伊普可泮)、ETA拮抗剂EXV811(阿曲生坦)和在研IgA肾病新药Zigakibart。
图片来源:华福证券研报
为了补充产品管线,诺华还两度携手RNAi赛道黑马舶望制药:先是就两款心血管siRNA药物达成潜在总额超41亿美元的合作,又在近期就四款siRNA管线达成总额超53亿美元的合作。
根据近期达成的合作协议,舶望制药将授予诺华两款处于发现阶段的下一代siRNA分子(针对重度高甘油三酯血症及混合性血脂异常)的中国境外许可权、一款正在中美两地开展II期临床的BW-00112(ANGPTL3 siRNA)的优先谈判权、一款预计2026年启动Ⅰ期研究的siRNA候选药物的中国境外许可权。
不得不说,诺华对siRNA疗法是真爱啊。
毕竟,长效PCSK9 siRNA降血脂新药Leqvio,自上市以来一直保持高速增长态势,让诺华尝到了甜头,2025年上半年,实现销售额同比增长66%至5.55亿美元,今年有望成为“十亿美元分子”。
Leqvio成功验证了siRNA在慢病领域的商业化潜力,并推动其他RNAi疗法探索高血压、糖尿病等。例如,罗氏和Alnylam在近期宣布,将启动一项III期心血管结局试验(CVOT),以评估RNAi疗法Zilebesiran降低未控制高血压患者发生重大心血管不良事件风险的能力。
值得注意的是,siRNA疗法还有望拓展至中枢神经系统(CNS)疾病领域。就在近期,诺华以潜在总额22亿美元从Arrowhead引进了一款治疗帕金森病的临床前阶段siRNA疗法。
此次合作,不仅彰显了诺华在siRNA药物领域的深度布局,更暗藏其抢占下一个“黄金赛道”的野心。
TONACEA
02
持续加码神经科学
除了CRM业务,神经科学也是诺华四大核心治疗领域之一:2025年上半年,实现收入同比增长23%至27.59亿美元,占公司总收入比例提升至10.11%。
诺华在神经科学领域的主要产品包括:CD20单抗Kesimpta(奥法妥木单抗)、一次性基因疗法Zolgensma(OAV101),2024年分别实现销售额32.24亿美元(+49% )、12.14亿美元(+2%)。
Kesimpta适用于成人复发型多发性硬化(RMS)。多发性硬化(MS)是一种免疫介导的中枢神经系统炎性脱髓鞘疾病。凭借居家注射的便利性,Kesimpta保持强劲的增长势头,2025年上半年同比增长38%至19.76亿美元,验证了B细胞疗法的市场认可度。
Zolgensma是诺华87亿美元收购AveXis所获得的一种基于腺相关病毒(AAV)载体的基因治疗药物,也是基因疗法领域的首款“重磅炸弹”,用于治疗罕见病脊髓性肌萎缩症(SMA),每剂210万美元(约合人民币1500万元)。
不过,由于市场天花板可见、天价带来的市场准入与支付压力及市场竞争加剧等原因,这两年Zolgensma销售额持续下滑,2025年上半年实现收入同比下降3.11%至6.24亿美元。
可见,诺华的神经科学业务出现了与CRM业务类似的情况:亟待新品补位。
图片来源:方正证券研报
基于此,诺华开启了“买买买”模式:2024年,以11亿美元收购Kate Therapeutics,拓展神经基因治疗领域战略布局;2025年,以超8亿美元与BioArctic合作开发神经退行性疾病新疗法,以22亿美元引进Arrowhead的帕金森病siRNA疗法。
纵观其战略布局,诺华在神经科学领域的规划极具前瞻性,旨在抢占下一代治疗技术的制高点。
例如,诺华选择收购Kate Therapeutics,是为了显著增强其在基因疗法和神经科学创新领域的战略布局。
Kate专注于开发基于AAV的基因疗法,用于治疗遗传性神经肌肉疾病,包括杜氏肌营养不良症(DMD)、面肩肱型肌营养不良症(FSHD),其中最成熟的候选药物KT430,已授权安斯泰来合作开发,用于治疗X连锁肌管性肌病。
与诺华达成授权合作的BioArctic大有来头,后者专注于可以延缓或阻止神经退行性疾病进展的创新疗法。
世界上第一种被证明可以减缓疾病进展并减少早期阿尔茨海默病认知障碍的药物——仑卡奈单抗(lecanemab,Leqembi),正是由BioArctic发现了原型抗体mAb158(仑卡奈单抗的前身),并与负责后期开发、临床试验和商业化的卫材共同开发的。
更关键的是,我们还能从诺华引进帕金森siRNA疗法窥见其差异化战略。
TONACEA
03
将差异化进行到底
诺华的差异化战略,体现在不追热门的ADC、GLP-1赛道,而是“绕过红海、开辟蓝海”,深度布局核药、小核酸药物、细胞与基因疗法。
尤其在核药领域,诺华已经尝到了大甜头:Pluvicto已在2024年成为“重磅炸弹药物”;另一款核药Lutathera今年上半年实现销售额同比增长16%至4亿美元,也有望成为“十亿美元分子”。
为了加强在放射性配体疗法(RLT)领域的领导地位,诺华一直在“买买买”,去年还收购Mariana Oncology,拿下了针对小细胞肺癌(SCLC)的基于锕的先导RLT项目MC-339。
而在小核酸药物板块,诺华主要布局反义寡核苷酸(ASO)和小干扰RNA(siRNA),今年还斥资17亿美元收购肾脏疾病药物研发公司Regulus,获得已进入III期临床的miRNA药物Farabursen。
Farabursen是针对miR-17靶点的下一代寡核苷酸,用于治疗常染色体显性遗传性多囊肾病(ADPKD)这一严重的肾脏疾病。
诺华药品开发部总裁兼首席医学官Shreeram Aradhye表示,“目前ADPKD患者的治疗选择有限,Farabursen作为一种潜在的首创药物,有望在疗效、耐受性和安全性方面优于现有的标准治疗方案。ADPKD是全球范围内,引起肾衰竭最常见的遗传性原因。”
图片来源:方正证券研报
针对siRNA疗法,诺华还将触手伸至CNS领域。此前,艾伯维扬言“明年将成为业内最大的CNS公司”,诺华自然不甘落后。
在帕金森病治疗领域,艾伯维拥有Duodopa(左旋多巴/卡比多巴凝胶)和销售峰值有望超20亿美元的帕金森病复方疗法Vyalev,并收购Cerevel Therapeutics拿下了多巴胺D1/D5受体部分激动剂Tavapadon;反观诺华选择siRNA疗法突围路线,将差异化进行到底。
诺华斥资22亿美元引进的ARO-SNCA,便是一款临床前阶段的siRNA疗法,利用Arrowhead专有靶向RNAi分子(TRiM™)平台进行皮下给药和向中枢神经系统递送,旨在靶向编码α-突触核蛋白的基因,作为帕金森病和其他突触核蛋白病患者的潜在治疗方法。
诺华生物医学研究总裁FionaMar shall表示:“帕金森病等神经退行性疾病影响着全球数百万患者。我们认为ArrowheadTRiM™技术具有巨大潜力,可在关键的大脑结构中实现广泛有效的递送,这对于看到RNA药物在神经退行性病变中的全面益处是必要的。”
正如Leqvio开创了siRNA用于慢性病的新时代,诺华此举也是为了防止在下一代CNS疗法中掉队。若能成功,ARO-SNCA将重塑帕金森病治疗范式,并为诺华带来可观的收入。
此次合作,诺华还将在TRiM™平台开发的产品线之外选择其他合作靶点。可见,TRiM™平台是“会下金蛋的鸡”,诺华看中的是其持续制造“重磅炸弹药物”的潜力。
如此看来,诺华选择重金投入,既是进攻性的开疆拓土,也是防御性的战略卡位。
— 结语 —
在巨头林立的创新药竞赛中,诺华选择了一条差异化且极具前瞻性的突围路径。这一选择的核心驱动力源于对核心产品增长乏力的未雨绸缪。
为此,诺华启动了“买买买”模式、双线并行的“补位”战略。这种聚焦于小核酸、核药等前沿领域的选择,既规避了同质化竞争,又通过深耕技术驱动的创新路径,为其构建了独特的长期壁垒与护城河。
参考资料:
1.诺华的财报、公告、官微
2.《20250822-医药生物行业:诺华2025H1业绩超预期,小核酸药物Leqvio增速领跑》,方正证券研报
3.华福证券研报
喜欢我们文章的朋友点个“在看”和“赞”吧,不然微信推送规则改变,有可能每天都会错过我们哦~
免责声明
“汇聚南药”公众号所转载文章来源于其他公众号平台,主要目的在于分享行业相关知识,传递当前最新资讯。图片、文章版权均属于原作者所有,如有侵权,请在留言栏及时告知,我们会在24小时内删除相关信息。
信息来源:同写意
往期推荐
本平台不对转载文章的观点负责,文章所包含内容的准确性、可靠性或完整性提供任何明示暗示的保证。
siRNA临床3期
2025-05-15
CVM(心血管及代谢),此词重量将堪比ADC、GLP-1。国内心血管疾病患者约3.3亿人、代谢性疾病患者约4.5亿人。据药融云,2018-2022年,中国心血管药物销售额市场规模保持在1450亿元左右。然而,这个超级市场一潭死水,长期被MNC和仿制药企盘踞。死水微澜,创新例外,国内创新药唯一接近百亿大单品,有望诞生于CVM,验证结构性增量逻辑成立。创新靶点成药,以及创新靶点进一步开发小分子药(口服优势)、小核酸药(超长效),让增量Buff拉满。Biotech在站稳肿瘤领域后,正挟创新靶点集体进军CVM。CVM市场将分层,保底层是集采仿制药,量大管饱,承担普惠的社会责任,中间层是口服创新药和次新靶点单抗药或多肽药,顶层是高价值的小核酸药、基因编辑疗法和全新靶点单抗药或多肽药。拿下中间层和顶层,Biotech将改变命运,享受慢病用药品牌依赖度高、生命周期长的红利。散发着腐烂气息的千亿江湖,因为鲶鱼涌入而重生。2023年主要降脂药品种价格梳理,初步呈现价格分层 资料来源:新康界,赛柏蓝,药智网,各药品说明书,华福证券研究所01 MNC凭老药霸屏依旧,仿制药拼老命只赚吆喝国内CVM慢病用药,曾经几乎被MNC垄断。据米内网,2021年中国城市实体药店终端降压药TOP10品牌市场份额、降糖药TOP10品牌市场份额、降脂药TOP10品牌市场份额,外企分别占9席、9席、6席。集采让原研药出局,打破药品阶层板结化?据米内网,2024年Q1-Q3重点省市公立医院终端高血压用药市场品牌TOP20中,外企占据15席;2024年中国零售药店终端糖尿病用药(化+生)品牌TOP20中,外企占据17席;2024年Q1-Q3中国零售药店终端内服血脂调节剂品牌TOP20中,外企占据7席。降压药、降糖药原研霸屏依旧,原研崇拜本质上是一种品牌依赖,客户粘度高,服用周期长,不会轻易中途换药。降脂药市场格局表面上受到国产集采品种的强劲冲击。据药智数据,阿托伐他汀钙片作为首批国家集采的血脂调节药大品种,在执行中标结果前的最后一个完整年度(2018年),在国内公立医疗机构的销售量为16.08亿片,辉瑞原研药为8.87亿片,占比55%,到2023年,阿托伐他汀钙片已增长至30.46亿片,辉瑞原研药为8.51亿片,占比降至28%。齐鲁制药勇夺阿托伐他汀钙片市场销量第一,销量占比47%,紧随其后的是乐普制药和东瑞制药(原兴安药业),销量占比分别为10%和9%。一看销售额,结局就反转。阿托伐他汀钙片2018年国内公立医疗机构销售额为105.01亿元,其中,辉瑞原研药占市场份额71%,集采之后,辉瑞市场份额不降反升,2023年达到83%。国产负责管饱,进口负责赚钱?然而,一旦涉及集采,终究没有赢家。CVM大品种被集采暴击,阿托伐他汀钙片销售额由2018年超100亿下滑至2020年不足55亿元;瑞舒伐他汀钙片由2018年超60亿元下滑至2021年不足25亿元;苯磺酸氨氯地平片由2018年近50亿元下滑至2020年不足23亿元。在CVM未被集采的领域,一个接近百亿元的大单品正冉冉升起。阿斯利康当家花旦达格列净(SGLT-2抑制剂),身披未被集采+原研战袍,据米内网,2024H1在国内三大终端六大市场的销售额接近35亿元,同比增长39.16%,按此趋势(据阿斯利康财报,达格列净全球销售额2024年同比增长31%,2025Q1同比增长16%),2025年或2026年将接近100亿元。达格列净被视为新型降糖药,其实不太新了,最早于2012年11月在欧洲批准上市,2017年3月在中国获批上市,到2022年,达格列净仍然占据国内SGLT-2药物82.6%的市场份额。整个CVM药物迭代缓慢。即使上市近30年,即使是被集采按在地上摩擦,他汀类药物仍是血脂异常治疗基石,据药智数据,2024年前三季度的样本医院血脂调节剂化药销售额中,阿托伐他汀钙片和瑞舒伐他汀钙片的占比超过50%。这一潭死水,体现为药物迭代缓慢,MNC凭借原研老药霸屏依旧,仿制药拼了老命只赚一个吆喝。是时候,来一群鲶鱼了。这群鲶鱼正是迅速崛起的创新药企。创新药大本营在港股,而港股跟踪创新药最权威的指数是HSHKBIO,恒生医药ETF(159892)是HSHKBIO指数下规模最大的ETF,最新规模达到约47亿元。今年以来(截至5月14日),HSHKBIO累计上涨26.35%,跑赢同期恒生科技指数。随着源头创新、差异化创新能力的增强,创新药是未来中国投资主线之一,不要错过这一历史机遇。由于对专业知识要求太高,港股医药投资,最稳妥的选择还是ETF基金(159892恒生医药ETF)。这只基金也有对应的场外基金(A类:016970;C类:016971),费率在同类属于最低档水平,可供长期定投。02 国产创新靶点药物,冲击三大旧格局仿制药未竟的任务,将由国产创新药完成。如果非要给恒瑞医药的创新转型找一个拐点标志,当属2025年3月将Lp (a)口服小分子项目HRS-5346海外权益许可给默沙东,首付款2亿美元,交易总额19.7亿美元。这次BD令人全然耳目一新,不仅含新量远超恒瑞既往BD,而且在整个国产创新药出海事件中都属顶级水平,体现出恒瑞早研能力的巨大飞跃。这次BD不是发生于我们擅长的工程抗体领域,而是长期落后的CVM领域,更加意义非凡。对标海外大厂阿斯利康、罗氏的CVRM(心血管、肾脏及代谢疾病)业务线,信达生物搭建CVM领域全方位能力体系:降脂管线首个国产PCSK9单抗新进入国家医保目录生效;代谢管线玛仕度肽(GLP-1R/GCGR)——全球首个进入III期GLP-1R/GCGR双靶点减重药,预计2025年中获批;痛风管线替古索司他(XO抑制剂)美国II期数据疗效优异,海外II期和国内II期同时推进;降压管线小核酸药物AGT siRNA国内I期已启动。CVM三大旧格局将经受国产创新靶点药物冲击。代谢领域,以信达生物玛仕度肽为代表的GLP-1药物即将汹涌而至,围绕GLP-1升级,以来凯医药LAE102(ActRIIA单抗)为代表的早研药物,在增肌、增加能量消耗、停药不反弹的痛点上进行探索;降压领域,中国约有2.6亿高血压患者,且高血压控制率较低,仅为16%,AGT是RAAS通路的上游靶点,RNA疗法可沉默肝源性AGT基因表达,有望克服RAS逃逸,解决高血压治疗耐药和依从性差的问题,半年给药一次,国产8款靶向AGT小核酸药物已进入临床,包括舶望制药 BW-00163、圣因生物/信达生物SGB-3908、石药集团SYH2062、恒瑞医药HRS-9563、成都先衍生物LDR2402、昂拓生物ART101、施能康/华东医药SNK-2726、大睿生物RN1871;限于篇幅,今天分析重点为新型降脂药。降脂领域仍存较大未满足需求。任何一种他汀类药物剂量倍增时,LDL⁃C(低密度脂蛋白胆固醇)进一步降低幅度仅约6%,此所谓“他汀类药物疗效6%效应,即LDL-C疗效不足;部分患者存在他汀不耐受的情况,包括肝功能异常、他汀类药物相关肌肉并发症、新发糖尿病以及其他不良反应;脂蛋白(a)也称Lp(a),Lp(a)水平的增加与心血管疾病风险的增加直接相关,其浓度几乎完全由遗传决定,传统降脂药物(如他汀类)作用有限。全球靶向PCSK9药物在研情况梳理 截至2025年2月PCSK9PCSK9蛋白与LDL-R直接结合,相较他汀类药物的间接作用,PCSK9抑制剂可以更精准地降低LDL-C水平,对他汀不耐受的血脂异常患者,或难治性高胆固醇血症患者,均有较好疗效,肝肾副作用也相对较小。PCSK9单抗可使LDL-C水平降低达50%~70%,每2周1次皮下注射,但“一辈子打针”的心理负担沉重,长期依从性不佳。安进依洛尤单抗(2015年上市)、赛诺菲/再生元阿利西尤单抗(2015年上市)2024年全球销售额分别为22.2亿美元、12.5亿美元,分别同比增长35.4%、14.7%,并没有成为超级爆款。PCSK9三个潜力方向或可期待。一是开发小核酸药物,诺华Leqvio是全球首款上市的siRNA降血脂药物,2024年全球销售额7.5亿美元,同比增长108.3%,能够强效持久降低LDL-C,长期达标率达80%,亚洲人群降幅高于PCSK9单抗,关键是一年仅需两针(第三个月加强针后)。阿斯利康反义寡核苷酸(ASO)AZD8233可显著降低PCSK9及LDL-C水平73%~79%,这是迄今为止报道的所有PCSK9靶向药物中可使LDL-C水平降低最高的药物。国内石药集团、悦康药业、瑞博生物、圣因生物均在开发PCSK9 siRNA。二是开发口服药物。默沙东MK-0616是全球首个口服PCSK9抑制剂,属于大环肽类药物,可阻断PCSK9蛋白和LDLR的结合,IIb期临床研究中30mg组降低LDL-C水平达60.9%,已推至临床III期。阿斯利康AZD0780是一种PCSK9小分子抑制剂,基于瑞舒伐他汀再用药,LDL-C水平下降52%(联用下降78%)。三是开发PCSK9基因编辑技术。通过CRISPR–Cas基因编辑技术可实现PCSK9的永久抑制,有望实现一次注射,终生降血脂。今年4月,信立泰从尧唐生物引进的靶向PCSK9碱基编辑药物YOLT-101临床试验申请获得受理。YOLT-101 IIT研究数据显示,4周时,高剂量组受试者LDL-C最高降幅近80%。Lp(a)Lp(a)作为降脂治疗的新靶点,全球暂无药物获批上市。在中国,约有20%人群的Lp(a)水平异常。目前全球约有13款用于降低Lp(a)水平的药物处于研发阶段,其中进展最快的3个项目均已进入III期临床试验,分别为ASO疗法诺华Pelacarsen,以及siRNA疗法安进Olpasiran、礼来Lepodisiran。今年3月,礼来长效siRNA疗法II期研究结果出炉,lepodisiran在最高剂量(400mg)下,使Lp(a)水平在治疗后60至180天期间平均降低93.9%,达到主要终点,其中一些患者的降低时间持续近1.5年。国内进展最快的为舶望制药siRNA药物BW-01,已进入II期临床。恒瑞医药、石药集团、信立泰、京新药业、靖因药业均在布局靶向Lp(a)药物。APOC3siRNA热门靶点之一,改善脂质紊乱的新途径,主要针对高甘油三酯血症及罕见疾病。瑞博生物RBD5044是全球第二个进入临床开发的APOC3 siRNA。Arrowhead Pharmaceuticals/维亚臻研发的APOC3 siRNA 药物Plozasiran(VSA001),2025年 3 月针对中国家族性乳糜微粒血症综合征(FCS)患者的 III 期临床试验获得积极顶线数据,成功达到主要疗效终点和所有关键次要终点。ANGPTL3主要针对他汀类药物无效的高甘油三酯血症和家族性混合型高脂血症,有望成为罕见遗传病患者的曙光,目前全球仅有一款药物获FDA批准上市。恒瑞医药SHR-1918是ANGPTL3靶向单抗药物,进入Ⅲ期临床。润佳医药/君实生物、Arrowhead Pharmaceuticals/维亚臻、诺华/舶望制药均在开发ANGPTL3 siRNA。CETP一度被视为心血管重要靶点,却成为MNC的坟场,辉瑞、罗氏、礼来和默沙东均受阻。现存在研药物仅4款,均为口服小分子,NewAmsterdam制药公司于2024年12月公布了ObicetrapibⅢ期BROADWAY试验的积极结果,或成为该靶点的破局者。在CVM创新靶点上,国内创新药与MNC不存在技术代差,部分甚至站在同一起跑线上。恒瑞医药、信达生物、信立泰已成为CVM领军企业,大量Biotech更是风起云涌,不仅分享国内千亿市场的增量机会,还将出现更多大型BD。
核酸药物抗体药物偶联物带量采购基因疗法
2024-04-01
·药智网
创新药行业的寒冬并未过去,但变化在悄然发生。2024年开年以来,国产创新药license out进入新高潮。在这背后,是药企新一代研发成果开始出现,创新药新鲜血液的加速涌现。而在财报季,我们更能看到,部分创新药企研发、商业化环节已经打通,自我造血能力在不断增强。不管是研发能力还是商业化能力,国内创新药企都在持续证明自己。可以预见,一些头部创新药企,接下来将会进入发展新阶段。一方面,这些药企已经打开全球市场大门,国际化布局预期兑现;另一方面,他们此前的研发积累,会随着药物获批、新适应症上市,持续贡献不菲的收入。这些药企往往又是国内创新实力最强的选手,随着自我造血能力的大幅增强,他们将能够摆脱周期的束缚,进入“现金流-创新”飞轮加速的阶段。日前公布财报的君实生物,就在展示这样的发展轨迹。01国际叙事开启从模仿到创新,从国内走向世界舞台,每一步都布满了挑战。然而,正是这些挑战塑造了今天中国创新药企的实力。如今,谈及中国创新药企,我们不再将其视为“追随者”,而是作为“并跑者”,甚至“先行者”和“探索者”,在某些领域取得突破,为全球患者带来了新的治疗方案。这正是君实生物所讲述的故事。作为首个登陆美国市场的国产PD-1,君实生物的特瑞普利单抗,快速放量已经是一张明牌。首先,是独家适应症带来的明确预期。去年,FDA批准特瑞普利单抗用于复发/转移性鼻咽癌的全线(一、二线)治疗,成为美国首个获批鼻咽癌治疗的免疫疗法,填补美国市场空白。除了适应症独家外,特瑞普利单抗还具备极大临床优势:其两项临床研究POLARIS-02和JUPITER-02以极高的试验标准取得了优异的数据结果,患者生存获益显著,获得美国国家综合癌症网络(NCCN)指南的首选推荐。这使得特瑞普利单抗在鼻咽癌治疗领域具备获得广泛认可的基础。在美国,医生极其重视基于“数据”和“证据”的治疗选择。君实生物的合作方Coherus正在尝试推动,让特瑞普利单抗跨越患者的所有治疗线。比如,刚刚接受二线化疗的患者,也能够立即获得特瑞普利单抗。据Coherus透露,其在美国与主流医生超50次会议的广泛交流中,这一策略获得了超过90%专家的支持。按照Coherus预期,特瑞普利单抗在鼻咽癌全线治疗的年销售峰值大约会在2亿美金左右。其次,Coheurs对特瑞普利单抗的高度重视,增强了这一预期实现的确定性。在年初,Coheurs完成了战略转型,将眼科产品出售,专注于肿瘤领域。在Coherus的新战略中,特瑞普利单抗占据了核心位置。根据Coherus表述:其计划专注于肿瘤微环境及与PD-1通路互补的高潜力产品线,特瑞普利单抗是与新型药物联合研究的支柱。这意味着,Coherus将投入更多资源以发掘特瑞普利单抗的潜力。实际情况也证明了这一点。目前,Coherus已经在鼻咽癌领域找到了有效的市场策略——精准营销。具体来说,Coheurs部署了与鼻咽癌ICD-10(疾病分类)代码相关的实时理赔系统和电子病历数据源。借助这些工具,一旦肿瘤医生接触到鼻咽癌患者,就会立即提醒公司的团队进行跟进,随后触发两个步骤:针对性地联系医生/专家进行电话营销,向该医生投放高度针对性的品牌数字广告。这种精准营销策略已证明非常有效,贡献了超过60%的新增订购账户。据Coherus统计,自上市以来,已有59个诊所和医院账户订购了特瑞普利单抗。在NCCN指定的33个癌症中心中,55%已经将特瑞普利单抗加入其处方列表,其余则在进行P&T(药学和治疗)审查。照这个势头,特瑞普利单抗在鼻咽癌适应症上达到销售峰值的时间预计不会太长。根据Coheurs的预测,实现这一目标可能只需大约2-3年。当然,特瑞普利单抗在美国市场的潜力,远不止于鼻咽癌适应症。上文提及,Coheurs将特瑞普利单抗视为战略重心。根据财报,Coherus围绕特瑞普利单抗的联合疗法探索,具有两个特点:一方面,适应症覆盖范围广,包括肝癌、肺癌,甚至是PD-1耐药的肿瘤患者;另一方面,则是探索范围广,联用组合包括DNA疫苗等前沿疗法,意味着后续的竞争力可能更强。特瑞普利单抗联合疗法的推进大概率也会超预期。在电话会议中,Coheurs表示在今年就会启动特瑞普利单抗和贝伐珠单抗、IL-27拮抗剂casdozokitug开展肝癌一线疗法的研究。从策略来看,Coheurs追求的不仅是药物的协同,还包括癌种的协同。日前,Coheurs与INOVIO达成的合作,就是这样一个例子。双方将开展INO-3112(靶向HPV 16/18的DNA癌症疫苗)与特瑞普利单抗联合疗法的探索,适应症是局部晚期头颈部鳞状细胞癌,与鼻咽癌具有显著的协同效应,因为两者都属于“头颈部肿瘤”大类范畴,在科室层面不分家。总体而言,特瑞普利单抗美国市场的发展逻辑极为清晰:从鼻咽癌快速出圈,再到覆盖更多适应症的联合疗法不断突围。这意味着,美国市场能为君实生物带来不菲收入。按照Coheursu预期,到2032年特瑞普利单抗销售额有望逼近20亿美金。根据合作条款,君实生物能够享有美国市场销售净利润的两位数分成。而实际上,美国市场只是特瑞普利单抗国际布局的一个起点。君实生物还在同步加速进军东南亚、中东、北非、欧洲等海外市场。目前,与合作伙伴一同,君实生物已在50多个国家或地区铺建商业化网络,并陆续启动了上市注册工作。目前,特瑞普利单抗已在欧盟、英国、澳大利亚、新加坡、印度、南非、智利、约旦等国家和地区提交了多项适应症的上市申请,其中欧盟已完成对生产现场的GMP核查。特瑞普利单抗获FDA批准后,后续在海外其他国家和地区的注册进程加快是大概率事件。一方面,可以通过一些合作框架走特殊通道。比如,特瑞普利单抗作为第一个加入奥比斯项目(Project Orbis)的国产创新药,有望在澳大利亚、新加坡等多个国家加速上市进程;另一方面,FDA批准之后,在一些非ICH国家(比如中南亚、中东等)也可以简化流程,只做行政审评。不难预见,未来两年,特瑞普利单抗海外里程碑将会密集到来。随着这一系列战略布局陆续落地,君实生物在国际市场上的竞争力和影响力会逐渐展露。除特瑞普利单抗外,君实生物还有另一张“隐藏王牌”,BTLA单抗tifcemalimab。目前,tifcemalimab已启动两项III期注册临床:一项是tifcemalimab联合特瑞普利单抗用于治疗局限期小细胞肺癌(LS-SCLC),正在开展国际多中心III期临床,已完成中、美、欧三地的首例患者入组及给药;另一项是tifcemalimab联合特瑞普利单抗用于治疗经典型霍奇金淋巴瘤(cHL),即覆盖了实体瘤和血液瘤。另外还有多项tifcemalimab联合特瑞普利单抗的Ib/II期临床研究正在中国和美国同步开展中。特瑞普利单抗和BTLA单抗这对王牌组合,未来有望联合解锁更多瘤种的应用,为国际业务的扩展奠定基础。02商业化增长预期兑现先研发后变现的发展模式,决定了创新药企在丰收之前,可能要面对长时间的孤独和等待;但一旦战略布局成熟,步入收获季节,便是连绵不绝的爆发之时。君实生物的崛起印证了这一点。作为国内创新药行业的先行者,君实生物在靶点、疾病适应症的布局上始终保持着前瞻性,静默耕耘织就了一张增长之网。截至目前,君实生物在国内已经有3款创新药进入商业化阶段,分别为:特瑞普利单抗、新冠口服药民得維、阿达木单抗类似药君迈康。3款商业化产品驱动君实生物收入持续增长。2023年,君实生物来自药品的收入同比增长58%。其中,特瑞普利单抗销售收入9.19亿元,同比增长25%。在肿瘤和自免领域之外,君实生物在心脑血管领域的布局也即将迎来首个商业化产品:昂戈瑞西单抗(PCSK9)预计在2024年上市。未来新药物、新适应症的持续获批,保证了君实生物未来业绩增长的可持续性。以PD-1特瑞普利单抗为例。截至目前,特瑞普利单抗在全球开展了超过40多项由公司发起的临床研究。接下来,特瑞普利单抗将会进入有节奏的收获阶段:每年有新适应症逐步上市、进入医保。2023年,特瑞普利单抗3项适应症(1LnsqNSCLC、NPC、ESCC)入围医保;2024年,仍是特瑞普利单抗的密集收获期,特瑞普利单抗联合化疗用于可手术NSCLC围手术期治疗的适应症已获NMPA批准,另外还有用于晚期三阴性乳腺癌、晚期肾细胞癌一线治疗、广泛期小细胞肺癌一线治疗等新适应症的上市申请已获NMPA受理。由于君实生物在以上多个适应症均进度领先,且此类适应症用药周期较长,未来其在市场推广中有望取得先发优势。例如,围手术期NSCLC适应症具有覆盖范围广,“首个+唯一”的特点。围手术期指术前新辅助和术后辅助阶段,覆盖癌症II期或III期癌症患者。太平洋研报数据显示,在NSCLC领域,大约40%患者在确诊时,处于上述阶段。II期或III期患者通常可以手术切除,但30-55%患者面临复发,传统的术前新辅助或术后辅助化疗仅提升5年OS率约5%,免疫治疗的加入带来了治疗革新。目前,国内围手术NSCLC领域,获批的仅有特瑞普利单抗。实际上,不仅是围手术期NSCLC,今年特瑞普利单抗还有望获批的适应症中,包括一线TNBC、一线RCC都具有“独家”特点。并不意外。一直以来,在管线布局方面,君实生物追求的不仅是数量上的增加,更注重的是深度。例如,特瑞普利单抗除了围绕一线疗法展开布局外,还前瞻预判了免疫2.0时代的发展趋势,顺势完成卡位。一方面,在辅助/新辅助治疗领域,君实生物处于全球第一梯队、国内遥遥领先的位置。上文提及,特瑞普利单抗联合化疗用于可手术NSCLC围手术期治疗的适应症已获NMPA批准,是率先突破该适应症的国产PD-1。这只是开始。在术后辅助和围手术期领域,特瑞普利单抗还覆盖了胃癌、肝癌、食管癌等国内高发癌种,公司预计食管鳞癌围术期研究将会在2024年读出数据。另一方面,在与免疫疗法、ADC、抗血管生成药物等诸多前沿领域的联合疗法探索中,君实生物同样基于差异化理念,通过自有搭建的管线和广泛合作具备全球竞争力。因此,随着这些新药物、新适应症的持续上市,君实生物的收入将会持续增厚。03“现金流-创新”飞轮加速一家创新药企的崛起,并非源于某种神秘力量,而是源自不懈的努力和持续的积累。说白了,成功是努力的积累,不是偶然。君实生物的成长故事也是如此。我们能够看到,君实生物发展提速背后,在于其各个环节能力的持续提升。随着邹建军博士等行业顶尖好手的加入,君实生物的执行效率在大幅提升。2023年,君实生物在全球范围内,有6项NDA获得监管机构受理,是数量最多的创新药企之一。在商业化方面,君实生物也是继续加速度。截至报告期末,特瑞普利单抗已累计在全国超过五千家医疗机构及约两千家专业药房及社会药房销售。可以预见的是,君实生物销售效率将会持续改善。毕竟,销售团队的扩张规模是可控的,随着销售额的攀升,人均产能将会显著增加,推动君实生物更快走向盈亏平衡点。而随着君实生物具备更强的造血能力,也将进入“现金流-创新”飞轮加速的发展新周期。在研发储备方面,君实生物已经成功打造了7个技术平台,包括单抗、双抗、ADC、siRNA等。由于这些这些平台均具有一定特色,未来君实有能力依托这些平台在多个前沿领域构筑具有全球竞争力的管线。例如,在siRNA领域,君实生物的技术平台具备提高siRNA稳定性、降低副作用以及高效等特点。因此,其ANGPTL3靶点能够快速展露头角。JS401是基于公司siRNA平台开发的ANGPTL3 siRNA药物,目前已经进入临床1期阶段。在同靶点、同机制领域,JS401的进度处于国内第一,全球前三。当然,对于创新药企来说,能否快速推动核心管线向前,除了能力之外,资金等资源也不可或缺。自我造血能力不断增强的君实生物将加速走入正循环:“特瑞普利单抗等商业化管线带来丰厚的现金流反哺创新,创新成果增厚现金流,现金流继续加速创新成果兑现”的飞轮加速的过程。注:以上图片来源氨基观察来源 | 氨基观察(药智网获取授权转载)撰稿 | 蔡九责任编辑 | 八角声明:本文系药智网转载内容,图片、文字版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间删除。商务合作 | 王存星 19922864877(同微信) 阅读原文,是受欢迎的文章哦
免疫疗法财报
100 项与 ANGPTL3 siRNA(Rona Therapeutics) 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| 高脂血症 | 临床前 | 中国 | 2024-02-15 |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
No Data | |||||||
登录后查看更多信息
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或
批准
利用最新的监管批准信息加速您的研究。
登录
或
特殊审评
只需点击几下即可了解关键药物信息。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
