预约演示
更新于:2025-01-23
HMG-CoA reductase
更新于:2025-01-23
基本信息
别名 3-hydroxy-3-methylglutaryl CoA reductase (NADPH)、3-hydroxy-3-methylglutaryl-CoA reductase、3-hydroxy-3-methylglutaryl-coenzyme A reductase + [5] |
简介 Catalyzes the conversion of (3S)-hydroxy-3-methylglutaryl-CoA (HMG-CoA) to mevalonic acid, the rate-limiting step in the synthesis of cholesterol and other isoprenoids, thus plays a critical role in cellular cholesterol homeostasis (PubMed:2991281, PubMed:21357570, PubMed:6995544). HMGCR is the main target of statins, a class of cholesterol-lowering drugs (PubMed:11349148, PubMed:18540668). |
关联
189
项与 HMG-CoA reductase 相关的药物作用机制 AT1R拮抗剂 [+1] |
在研机构 |
原研机构 |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 韩国 |
首次获批日期2021-09-14 |
作用机制 CETP抑制剂 [+1] |
在研机构 |
原研机构 |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 韩国 |
首次获批日期2021-07-28 |
作用机制 AT1R拮抗剂 [+2] |
在研机构 |
原研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 韩国 |
首次获批日期2020-05-23 |
3,666
项与 HMG-CoA reductase 相关的临床试验JPRN-UMIN000018818
Trail against hyperlipidemia Patients with high risks to Investigate the effect ON small dense ldl & idl by using middlE dosE rosuvastatin, atrovastatin, psSk-9 inhibitor(relationship of blood ANGPTL, Sortilin, miRNA and so on level) (PIONEERs in Saitama Study 3) - PIONEERs Study 3
开始日期2028-12-31 |
申办/合作机构 |
NCT06686615
Effectiveness and Safety of Bempedoic Acid in Combination With Ezetimibe and Either Rosuvastatin or Atorvastatin in Patients With Primary Hypercholesterolemia or Mixed Dyslipidemia: an Observational Study
Data on the real-world use and effectiveness and safety of bempedoic acid combined with both a statin and ezetimibe in clinical practice is limited. There is an increased focus on using combination therapy to lower LDL-C.
开始日期2025-03-03 |
申办/合作机构 |
100 项与 HMG-CoA reductase 相关的临床结果
登录后查看更多信息
100 项与 HMG-CoA reductase 相关的转化医学
登录后查看更多信息
0 项与 HMG-CoA reductase 相关的专利(医药)
登录后查看更多信息
8,379
项与 HMG-CoA reductase 相关的文献(医药)2025-03-01·Metabolic Engineering
Engineering of insect juvenile hormone III biosynthesis in the plant Nicotiana benthamiana
Article
作者: Alam, Ryan M ; Stathaki, Angeliki ; O'Connor, Sarah E ; Köllner, Tobias G
2025-03-01·Brain Research
Fluvastatin, an HMG-CoA reductase inhibitor, exerts protective effect against NMDA-induced seizure by increasing the seizure threshold and modulating membrane excitability in embryonic rat cortical neuron
Article
作者: Hwang, Eric ; Chen, Hwei-Hsien ; Chan, Ming-Huan ; Wang, Ya-Jean ; Liu, You-Xuan ; Huang, Chieh-Min ; Yeh, Che-Jui
2025-02-01·Biomedicine & Pharmacotherapy
Statins and non-alcoholic fatty liver disease: A concise review
Review
作者: Daliry, Anissa ; Santos, Rafaele Dantas Cruz Dos ; Franco, Rafaela Luiza Costa ; da Silva Pereira, Evelyn Nunes Goulart
70
项与 HMG-CoA reductase 相关的新闻(医药)2025-01-07
·信达生物
转载自:医学界内分泌频道
胰高血糖素(glucagon,GCG)作为一种经典的“分解代谢”激素,其发现至今已有100年的历史。GCG协同胰高糖素样肽-1(GLP-1)开发的双靶点、多靶点激动剂现已成为针对糖尿病、肥胖等代谢疾病治疗的重要方向。GCG受体激动在GLP-1受体激动抑制食欲的基础上,促进脂肪代谢、增加能量消耗,达到减重、降糖的双重获益。同时,GCG受体主要在肝脏表达,激活GCG受体能够抑制肝脏脂肪合成、促进脂肪酸β氧化从而燃烧肝脏脂肪,带来肝脏保护的多重受益。
DREAMS-2主要研究者,北京医院国家老年医学中心郭立新教授:
余学锋教授:
肝脏是机体脂质代谢的核心器官,承担了脂质的摄取与处理功能。肝脏中的脂质有2个来源3个去路。
来源:肝脏中脂质的第一个来源是游离脂肪酸的摄入,摄入食物后肠道产生的乳糜微粒以及储存在脂肪组织中甘油三酯(Triglyceride,TG)分解形成的游离脂肪酸释放到血液中输送到肝脏。脂质的第二个主要来源从头脂肪生成(De novo lipogenesis,DNL)是肝细胞将食物中的碳水化合物分解产生的葡萄糖和果糖转化为脂肪酸的过程。
去路:进入肝脏的脂质一部分被运输到线粒体中进行脂肪酸的β氧化,为机体提供能量,这是肝脏脂肪消耗的主要形式。肝脏脂质还可以再酯化形成甘油三酯,以脂滴的形式储存在肝细胞中。这些再酯化形成的甘油三酯少量被组装形成极低密度脂蛋白(VLDL)运输到肝脏外的血液中,剩余的脂质还累积在肝脏中。
当肝脏对脂质的氧化与输出不足以消耗掉肝脏中累积的脂质就会导致肝脏脂肪变性,从而引起脂肪肝,腹型肥胖等一些列的代谢性疾病(图1)。
图1 肝脏脂肪代谢示意图[1]
DREAMS-2主要研究者,北京医院国家老年医学中心郭立新教授:
余学锋教授:
GCG由胰腺中的胰岛α细胞分泌,在体内主要与胰岛素共同作用起到稳定血糖的作用。GCG受体主要在肝脏表达,在肝脏中发挥重要作用调节三大营养物质代谢,减少肝脏脂肪,提高肝细胞存活率。当血糖下降时,胰高血糖素会从胰腺α细胞释放到肝门静脉,从而迅速到达肝细胞与GCG受体结合、刺激腺苷酸环化酶-cAMP系统以及随后激活蛋白激酶A通路来刺激糖原分解和糖异生并刺激内源性葡萄糖生成[2]。此外,GCG受体的激活能够通过多重机制协同作用燃烧肝脏脂肪,包括抑制脏脂肪生成,促进脂肪酸氧化,增加糖异生,改善炎症、纤维化等多个方面减少肝脏脂肪含量。
DREAMS-2主要研究者,北京医院国家老年医学中心郭立新教授:
余学锋教授:
刚刚我们也提到GCG受体激动带来的燃脂作用是多方面的,它既能够抑制脂肪合成,又能够促进脂肪分解,双管齐下,调节脂肪代谢,具体来讲:(1)GCG受体激活抑制脂肪从头合成,增强脂质耐受性。GCG受体激活介导PKA和AMPK信号,使得脂质合成途径中的关键酶乙酰辅酶a羧化酶-1和2(ACC1和ACC2)被磷酸化从而抑制其活性,能直接抑制肝内从头脂肪合成。GCG受体激活还能够抑制二甘油酯酰基转移酶DGAT和HMG-CoA还原酶,抑制甘油三酯合成并降低循环中的胆固醇水平[3]。有研究表明,静脉输注GCG可通过增加脂蛋白脂肪酶(LPL)活性加速TG从血浆中清除从而在数分钟内降低血浆TG浓度[4]。(2)GCG受体激活通过刺激脂肪分解和脂肪酸β-氧化来减少肝脏内脂质的累积。研究表明,GCG受体激活后,磷脂酶A和酰基转移酶1(Plaat1)的表达增加,非酰化脂肪酸输出显著增加,这些都表明GCG受体激活导致肝脏脂质分解代谢增加[5]。线粒体是肝细胞重要的细胞器,是肝脏中脂肪酸β氧化的场所。GCG受体激活能促进脂肪酸进入线粒体,促进脂肪β-氧化功能。同时,GCG能够增强线粒体功能从而刺激肝线粒体脂肪酸β-氧化,逆转肝脏脂肪变性。此外,GCG激活上调线粒体生物合成调节剂PGC-1α基因表达,能够加快线粒体合成,增强线粒体氧化呼吸功能[5]。综上,GCG受体激活通过多种作用机制协同作用,减少肝脏脂肪。(3)GCG激活影响多种代谢途径,减少肝脏脂肪。
肝细胞中GCG受体激活刺激成纤维细胞生长因子21(FGF21)的表达和分泌增加,FGF21能够通过多种途径包括抑制脂肪生成基因的表达,增加脂肪酸的线粒体β氧化减少肝脏脂肪。此外,FGF21显著降低肝星形细胞(HSC)活化和增殖,减少Kupffer细胞和损伤肝细胞促纤维化因子的表达和分泌[6]。GCG受体激活还能够通过肝脏法尼醇X受体(FXR)路径增加能量消耗。在肝细胞中,FXR激活会抑制固醇调节元件因子结合蛋白-1c(SREBP-1c)的表达,抑制从头脂肪生成外,FXR激活还会诱导过氧化物酶体增殖激活受体(PPARα)及其靶基因的表达以促进游离脂肪酸(FFA)氧化,故FXR激活通过抑制从头脂肪生成和促进脂质氧化和清除来减少肝脏脂肪变性[7]。
DREAMS-2主要研究者,北京医院国家老年医学中心郭立新教授:
余学锋教授:
GCG受体激活还能减少肝脏炎症和纤维化,提高肝细胞存活率。
研究表明,在非酒精性脂肪性肝炎(NASH)的肥胖(ob)/ob小鼠模型中,与GLP-1受体激动剂相比,GCG/GLP-1双受体激动剂进一步减轻了肝纤维化和炎症。GCG/GLP-1双受体激动剂降低了血浆丙氨酸氨基转移酶(ALT)、肝脏α-平滑肌肌动蛋白、肝脏羟脯氨酸含量,免疫细胞浸润标志物CD68及纤维化评分,使用GCG/GLP-1双受体激动剂后,肝脏纤维化和炎症相关基因的转录水平显著下降,且下降幅度优于单GLP-1受体激动剂[7]。
此外,在中华医学会第二十一次内分泌学学术会议(2024 CSE)上有报道公布,在胆碱缺乏的高脂肪饮食(CDHFD)建立的NASH小鼠模型中,使用GCG/GLP-1双受体激动剂玛仕度肽治疗4周,小鼠肝脏功能、肝脏脂肪变性、炎症及纤维化均得到显著改善。与NASH模型组相比,使用玛仕度肽后,小鼠肝体重比,肝脏TG,及ALT,天冬氨酸氨基转移酶(AST)均显著降低。同时HE和天狼星红染色结果显示玛仕度肽可显著改善肝脏脂肪变性,炎症反应及纤维化程度且小鼠肝脏中炎症基因与纤维化基因表达降低。
DREAMS-2主要研究者,北京医院国家老年医学中心郭立新教授:
余学锋教授:
GCG作为一种经典的激素,其发现已经有100年的历史,GCG成药之路几经波折,从最初的拮抗剂,到如今GCG的双靶点、多靶点激动剂已成为糖尿病和肥胖等代谢领域药物开发的重要方向。
其中,玛仕度肽是全球研发推进最快的GCG/GLP-1单分子双受体激动剂。玛仕度肽是在人体天然激素——胃泌酸调节素(Oxyntomodulin,OXM)的基础上改造而成的,OXM本身生理性的结合并同时激活GCG受体和GLP-1受体(天然GCG和GLP-1靶点),协同作用发挥调节血糖稳态,保护β细胞功能,促进能量消耗和脂肪分解等重要作用。玛仕度肽在OXM氨基酸序列的基础上进行了改造,优化了GCG和GLP-1的激动比例,满足减重、降糖双重获益;并延长药物半衰期至10天,满足每周一次的给药方式,为减重治疗带来新的选择。玛仕度肽有望2025年在华上市,获批减重和降糖双重适应症。
DREAMS-2主要研究者,北京医院国家老年医学中心郭立新教授:
余学锋教授:
GLORY-1是玛仕度肽在中国超重肥胖(不合并糖尿病)患者中的随机、双盲、安慰剂对照的III期研究。该研究纳入610名体重指数(BMI)≥28kg/m2,或BMI≥24kg/m2且至少有一种体重相关合并症的中国成年患者。研究结果显示,4mg和6mg玛仕度肽治疗48周体重较基线下降达12%和15%。GLORY-1的探索性研究分析了玛仕度肽对中国超重/肥胖患者肝脏脂肪变性的影响,研究者使用核磁共振成像-质子密度脂肪分数(MRI-PDFF)分析了62名基线肝脏脂肪含量(LFC)≥5%的超重/肥胖且不合并糖尿病的中国成人受试者。结果显示:相较于安慰剂组,玛仕度肽4mg、6mg治疗48周,呈剂量依赖的显著减少超重或肥胖受试者的LFC达60-80%;治疗48周,玛仕度肽组的LFC正常化(LFC<5%)受试者的比例达76.0%(4mg)和77.3%(6mg)。且玛仕度肽组肝酶(ALT、AST、GGT)水平较安慰剂组明显下降[8]。
专家简介
余学锋 教授
华中科技大学同济医学院附属同济医院内分泌科主任
内科学教授、主任医师、博士生导师
中华医学会内分泌分会常务委员
中华预防医学会健康生活方式与社区卫生专业委员会副主任委员
中国医师协会内分泌代谢分会常务委员
湖北省内分泌学会主任委员
中华医学会内分泌分会神经与内分泌学组组长
《内科急危重症杂志》副主编、《药品评价》常务编委;《临床内科杂志》、《中华糖尿病杂志》、《中国糖尿病杂志》、《中华老年多器官疾病杂志》、《华科大学报》英文版、《中国医学论坛报社》内分泌专家委员会及《糖尿病天地》编委
参考文献:
[1]ZHAO CL, SHANG DF, ZHOU C, et al. Clin Hepatol, 2023, 39(1): 168-174.
[2]Conceição-Furber E,et al. Front Endocrinol (Lausanne)2022;13:868037.
[3]Albrechtsen, NJW,et al. Diabetologia. 2023 Aug;66(8):1378-1394.
[4]Galsgaard KD, Elmelund E, et al. Molecular Metabolism. 2022 Dec;66:101639.
[5]Adorini, Luciano, et al. Journal of hepatology vol. 79,5 (2023): 1317-1331.
[6]Tillman, Erik J, et al. Frontiers in endocrinology vol. 11 601290. 14 Dec. 2020.
[7]Adorini, Luciano, et al.Journal of hepatology vol. 79,5 (2023): 1317-1331.
[8]JI LN, JIANG HW, LI H, et al. Diabetes 2024;73(Supplement_1):1857-LB.
本文旨在为医疗卫生专业人士传递更多医学信息,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,信达不推荐任何未获批的药品/适应症使用。
2024-12-31
IND2025主会场授课已被预定,大会第一天下午茶歇前授课时间段预定开始,咨询热线:177 0186 0390。点击图片,查看IND2025首批重磅嘉宾
值得庆幸的是,像大多数复杂的事情一样,药物研发的整个过程可以分解为许多个较小的任务。总的来说,药物研发过程可分为两个主要阶段,即药物的发现和药物的开发(图1.7)。第一个阶段是药物的发现,包括从最初的靶点识别到确定单一临床候选药物的全过程。药物发现又包括三个步骤,分别是疾病相关治疗靶点的确认、先导化合物的发现及先导化合物的优化。药物发现过程的每个阶段旨在建立相关靶点(如酶、G蛋白偶联受体、离子通道等)与疾病实验模型之间的科学联系,该过程通常涉及靶点的发现和靶标的验证,主要通过设计合理的分子探针来测试多个系列化合物对靶标生物活性的调节作用来实现。在许多情况下,常采用已知化合物来实现对靶点的选择,并且最终通过先导化合物的发现与优化来获得全新的候选化合物。具体而言,是通过对大量化合物进行系统的生物活性筛选,获得具有预期活性的先导化合物。随后继续开展先导化合物的结构改造和优化,通过反复的活性筛选和再优化,最终获得候选药物,进入药物的开发阶段。通常,先导化合物的发现和优化过程往往重叠在一起,需要对多个系列的化合物同时进行多轮的筛选、优化、再筛选和再优化。这种方法是成功所必需的,因为通常很难确定在一个单一系列的众多化合物中是否包含最终的候选药物。因此,平行操作在一定程度上降低了失败的风险。药物发现阶段所要达成的目的就是发现一个在体内动物模型中有效的化合物,并且具有临床研究所必需的良好理化性质。
图1.7 药物发现与开发全过程
第二个主要阶段即药物的开发,通常是在确定了一个候选化合物后,通过开展各项实验研究,最终在监管部门的批准下成功上市销售的过程。该过程的第一步是提交新药研究(investigational new drug,IND)申请,需要得到批准才能将临床候选药物推进到人体临床试验。申请文件需向监管机构提供详细的临床前研究数据,详细介绍动物药效学和毒理学研究结果,以及化学生产工艺信息(包括剂型、稳定性研究和质量控制方法等)。当然如果研究得到批准,还需要提供开展临床研究的详细方案。
虽然每个候选药物的临床试验设计可能不尽相同,但是临床Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期研究的总体目标是相同的。临床Ⅰ期试验主要研究新药的安全性和耐受性,目的是确定其安全范围是否适合开展后期的临床试验,一般在少数健康个体(通常为20 ~ 100人)中进行测试,试验中将密切监测候选药物的药代动力学和药效学方面的性质。首先进行单次递增剂量(single ascending dose,SAD)研究,然后开展多次递增剂量(multiple ascending dose,MAD)研究。在SAD研究中,先对第一组受试者以某一剂量给药一次,并监测确定药物的影响。如果没有副作用,则提高给药剂量对第二组受试者给药一次,并进行如前所述的监测。以此类推,直至受试者出现不可耐受的副作用,并确定候选药物的最大耐受剂量(maximum tolerated dose,MTD)。MAD研究与SAD研究相似,但是会降低每组受试者在一段时间内的给药剂量,并且是多次给药。与SAD研究一样,通过监控副作用的出现来测试候选药物的MTD。临床Ⅰ期的研究数据将决定后期临床Ⅱ期、Ⅲ期和Ⅳ期的给药剂量。
临床Ⅱ期试验一般需要100~300名受试者,主要是测试候选药物是否具有预期的药效。同样,安全性研究也将贯穿Ⅱ期试验的始终。临床Ⅱ期试验一般分为两个部分,即ⅡA期和ⅡB期。ⅡA期的主要目标是确定候选药物发挥疗效所需的剂量。一旦确定了适当的剂量水平,就可以启动ⅡB期研究。ⅡB期研究的目标是确定候选药物在有限的受试者群体中的总体药效。由于存在安全性问题或缺乏药效,大多数临床候选药物在Ⅱ期试验中以失败告终。截至2011年,只有34%的Ⅱ期临床候选药物能够成功进入到临床Ⅲ期研究。
临床Ⅲ期试验将进一步测试候选药物在更大患者群体中的药效。Ⅲ期试验通常是随机的,并在多个临床试验点开展,受试患者人数一般为数百至数千名。Ⅲ期临床研究所需的成本和时间可能会因实验药物的不同而存在很大差异,具体取决于试验的临床终点。通常,用于治疗急性疾病的试验药物(如抗感染药物)要比治疗慢性病的药物(如抗关节炎药物)试验周期短、受试患者人数少。试验中还会密切监测患者的不良反应和副作用,因为较大数量的受试患者更有助于发现只涉及较少受试患者的Ⅱ期临床试验中不明显的安全性问题。Ⅲ期临床试验(特别是慢性疾病)中的受试者数量、时间要求和复杂设计都决定了它是药物研发过程中最昂贵的环节。完成Ⅲ期试验后,便可向相应的监管机构提交新药申请。申请文件通常包括候选药物动物试验和人体试验的所有结果、所有安全性问题(不良反应和副作用)、生产工艺(包括确保药物质量的分析方法)、所有剂量研究的剂型及详细配方信息,以及药物储藏条件等。监管审查可能会要求补件,提交其他必要的信息,甚至是增加额外的临床试验来进一步确定候选药物的安全性或有效性。在理想情况下,监管部门会批准申请及有关药物的标签信息,最终新药成功获批上市。
但是,新药申请获得监管机构批准并不代表临床试验的结束,一些长期用药的毒副作用可能在Ⅲ期临床试验中仍不易被发现。在许多情况下,监管机构要求开展进一步的跟踪研究,这通常被称为临床Ⅳ期试验或上市后监测。一般来说,这些研究旨在发现可能存在的罕见不良反应。临床Ⅳ期试验监控的患者样本数量要比前期的试验大得多。基于临床Ⅳ期试验的安全性,药品的说明书可能会做出相应的调整,并说明与其他药物联合应用的禁忌,如果发现了非常严重的安全性问题,甚至有撤市的风险。例如,选择性非甾体抗炎药COX-2抑制剂罗非昔布(rofecoxib,Vioxx®),因为在临床Ⅳ期试验中发现具有增加缺血性副作用的风险而不得不撤市(图1.8)。同样的,拜耳公司研发的用于治疗高胆固醇血症和心血管疾病的HMG-CoA还原酶抑制剂西立伐他汀(cerivastatin,Baycol®),在发现其可引发致命的横纹肌溶解症后,也已撤市(图1.8)。
应该指出的是,安全性研究并不是临床Ⅳ期试验的唯一目的。制药企业通常可以借助上市后的监督和其他临床研究数据来确定其产品的竞争优势、市场形势和新适应证。由于这种竞争性的临床试验结果通常难以预测,因此相关试验存在一定程度的风险。在某些情况下,公司雄心勃勃地期望证明他们的候选药物优于竞争对手的药物,但结果却事与愿违。
图1.8 罗非昔布和西立伐他汀分别因为缺血性副作用和致命性横纹肌溶解症风险而撤市。
参考文献
《Basic Principles of Drug Discovery
and Development》, Benjamin E. Blass
END
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
IND2025主会场授课已被预定,大会第一天下午茶歇前授课时间段预定开始,咨询热线:177 0186 0390。点击图片,查看IND2025首批重磅嘉宾
戳“阅读原文”立即注册,抢IND2025免费参会名额!
临床申请临床1期临床2期
2024-12-24
·米内网
精彩内容
日前,国家药监局官网显示,山东新时代药业的依折麦布片以仿制4类报产获批,视同过评。米内网数据显示,依折麦布片在2023年中国三大终端六大市场(统计范围见文末)销售额超过10亿元,是血脂调节剂(化学药+生物药)TOP3产品。
来源:米内网一键检索
依折麦布片适应症包括:原发性高胆固醇血症,作为饮食控制以外的辅助治疗,可单独或与HMG-CoA 还原酶抑制剂(他汀类)联合应用于治疗原发性(杂合子家族性或非家族性)高胆固醇血症,可降低总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白B(ApoB);纯合子家族性高胆固醇血症(HoFH),与他汀类联合应用,可作为其他降脂治疗的辅助疗法(如LDL-C血浆分离置换法),或在其他降脂治疗无效时用于降低HoFH患者的TC和LDL-C水平;纯合子谷甾醇血症(或植物甾醇血症),作为饮食控制以外的辅助治疗,用于降低纯合子家族性谷甾醇血症患者的谷甾醇和植物甾醇水平。
2023年中国三大终端六大市场血脂调节剂产品TOP5来源:米内网格局数据库
依折麦布片在2023年中国三大终端六大市场销售额超过10亿元,是血脂调节剂(化学药+生物药)TOP3产品,欧加农制药的市场份额最大,2024年上半年同比增长近7%。米内网数据显示,依折麦布片有14家企业拥有生产批文,山东新时代药业、江苏德源药业、北京百奥药业、重庆圣华曦药业等12家过评,山东鲁抗医药、华润赛科药业等6家以新分类报产在审。
今年以来,山东新时代药业已有20款产品获批,涵盖多个治疗大类,其中,抗肿瘤和免疫调节剂最多,有醋酸曲普瑞林注射液、普乐沙福注射液、来曲唑片等6款产品;其次是心脑血管系统药物,有依折麦布片、硝苯地平控释片、沙库巴曲缬沙坦钠片等4款产品。
资料来源:国家药监局官网、米内网数据库注:米内网《中国三大终端六大市场药品竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。如有疏漏,欢迎指正!
本文为原创稿件,转载请注明来源和作者,否则将追究侵权责任。投稿及报料请发邮件到872470254@qq.com稿件要求详询米内微信首页菜单栏商务及内容合作可联系QQ:412539092
【分享、点赞、在看】点一点不失联哦
上市批准
分析
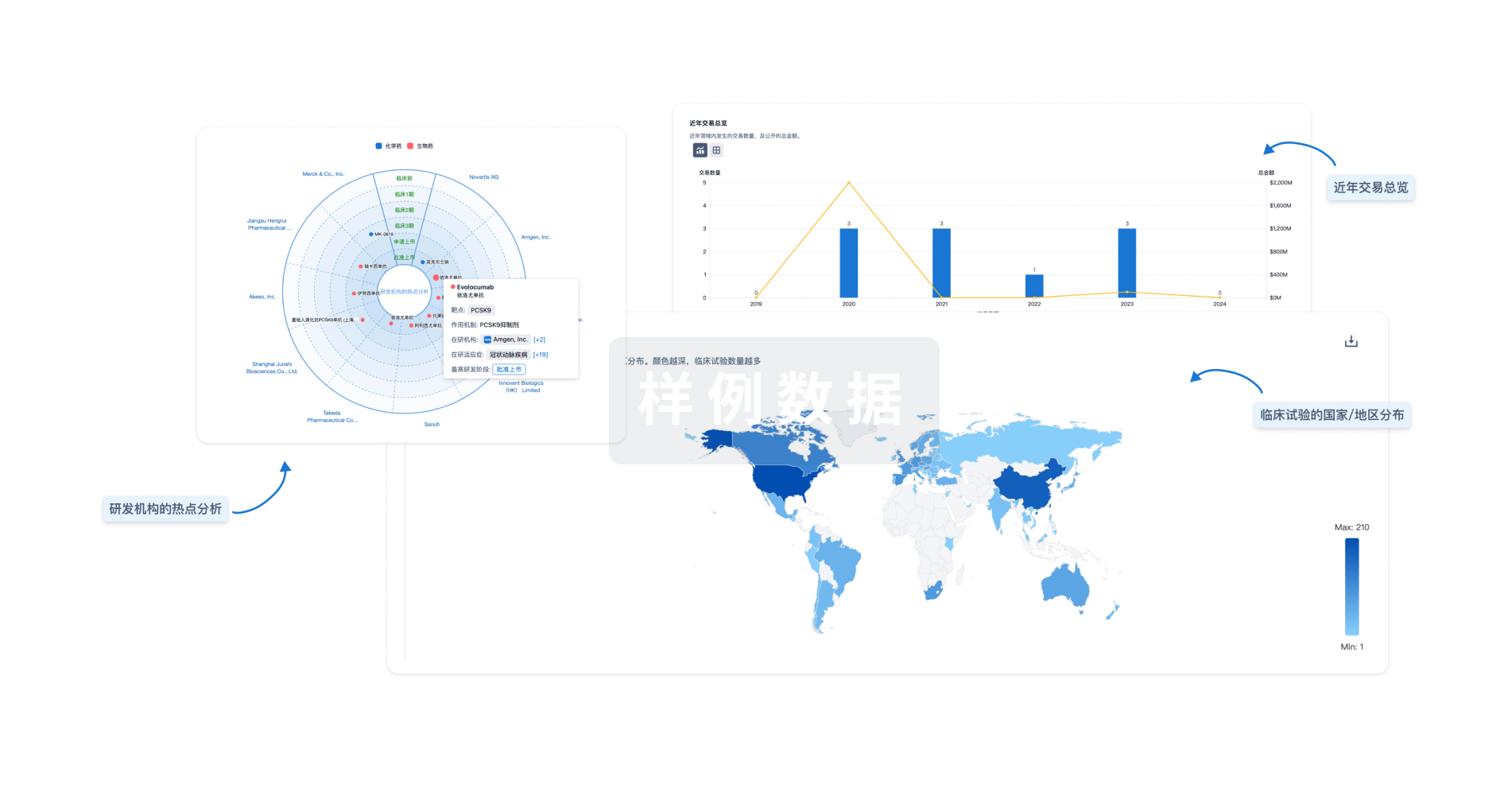
对领域进行一次全面的分析。
登录
或
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用