预约演示
更新于:2025-05-07

Suzhou Idiocess Medical Technology Co., Ltd.
注销
| 私营公司|2010|中国江苏省注销
| 私营公司|2010|中国江苏省更新于:2025-05-07
概览
关联
100 项与 Suzhou Idiocess Medical Technology Co., Ltd. 相关的临床结果
登录后查看更多信息
0 项与 Suzhou Idiocess Medical Technology Co., Ltd. 相关的专利(医药)
登录后查看更多信息
8
项与 Suzhou Idiocess Medical Technology Co., Ltd. 相关的新闻(医药)2025-02-28
·米内网
精彩内容
2025年,奥赛康新药研发持续推进,1类新药利厄替尼片获批上市,1类新药注射用ASKG915、2.2类新药ASKC635干混悬剂申报临床……2024年至今,公司已有8个品种获批上市,其中多个品种为国内首批上市。目前公司有34个品种过评(11个首家),15个品种中标国采;9款重点新药处于申报临床及以上研究阶段,7个仿制药上市申请在审。
拿下8个重磅品种,首款1类新药亮眼
步入2025年,奥赛康研发管线进展不断:1类新药利厄替尼片、4类仿制药曲氟尿苷替匹嘧啶片获批上市,4类仿制药来特莫韦注射液、硫酸艾沙康唑胶囊申报上市,1类新药注射用ASKG915、2.2类新药ASKC635干混悬剂申报临床。
2024年至今,奥赛康已有8个品种获批上市,包括1类新药利厄替尼片,2类改良型新药注射用右兰索拉唑,以及仿制药曲氟尿苷替匹嘧啶片、马来酸奈拉替尼片、注射用福沙匹坦双葡甲胺、注射用硫酸艾沙康唑、枸橼酸托瑞米芬片、艾曲泊帕乙醇胺片,进一步丰富了公司的产品线。
2024年至今奥赛康获批品种
多个仿制药为国内首批上市,彰显了公司研发实力。其中,注射用硫酸艾沙康唑、艾曲泊帕乙醇胺片为国内首仿+首家过评,枸橼酸托瑞米芬片为国产第2家,曲氟尿苷替匹嘧啶片、马来酸奈拉替尼片为国产第3家,注射用福沙匹坦双葡甲胺为国产第6家。
利厄替尼片是具有全新分子结构的口服第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),用于治疗EGFR突变非小细胞肺癌(NSCLC),是公司获批上市的首个1类创新药。该药一线治疗NSCLC注册申请已于2024年8月13日获CDE承办。2024年10月,奥赛康与信达生物就利厄替尼片在中国大陆地区达成独家商业化合作。
米内网数据显示,2023年中国三大终端六大市场(统计范围详见本文末)蛋白激酶抑制剂销售额超过410亿元。此前,奥赛康在该领域已有甲磺酸仑伐替尼胶囊、哌柏西利胶囊、塞瑞替尼胶囊、马来酸奈拉替尼片等品种获批上市。
34个品种过评,抢攻10亿大品种
截至目前,奥赛康已有34个品种通过/视同通过一致性评价。其中,11个品种为国内首家过评,包括注射用硫酸艾沙康唑、塞瑞替尼胶囊、地拉罗司分散片、泊沙康唑注射液、注射用兰索拉唑、沙格列汀片、注射用右雷佐生、注射用奈达铂等。
34个过评品种涉及7个治疗大类,主要集中在抗肿瘤和免疫调节剂(13个)、消化系统及代谢药(11个)。米内网数据显示,2023年中国三大终端六大市场抗肿瘤和免疫调节剂、消化系统及代谢药销售额分别超过2200亿元、2100亿元。
奥赛康通过/视同通过一致性评价品种来源:米内网一致性评价进度数据库
在国家开展的九批化药集采中,奥赛康累计有15个品种获得中选资格。未纳入集采的品种中,艾曲泊帕乙醇胺片已有11家企业过评,注射用右雷佐生、注射用福沙匹坦双葡甲胺各有7家企业过评,有机会被纳入拟于上半年开展的第十一批集采。
奥赛康聚焦高壁垒复杂制剂的开发,目前还有7个仿制药品种上市申请在审中,包括硫酸艾沙康唑胶囊、来特莫韦注射液、马立巴韦片、甲氨蝶呤注射液、注射用德拉沙星、马来酸阿伐曲泊帕片、注射用右旋雷贝拉唑钠,获批生产后将视同通过一致性评价。
其中,马来酸阿伐曲泊帕片是一款非肽类口服血小板生成素受体激动剂(TPO-RA),适用于择期行诊断性操作或者手术的慢性肝病相关血小板减少症的成年患者。该药2023年在中国三大终端六大市场销售额首次突破10亿元,同比增长25.44%。
4个品种硫酸艾沙康唑胶囊、马立巴韦片、注射用德拉沙星、注射用右旋雷贝拉唑钠在国内暂无仿制药获批上市,奥赛康有望夺得国内首仿或实现国内首批上市。
9款新药在研,1类新药猛攻2200亿市场
1月23日,奥赛康披露2024年度业绩预告显示,预计2024年归属净利润1.5亿元-1.95亿元,上年同期亏损1.49亿元,同比扭亏为盈。
奥赛康表示,业绩变动原因为公司抗感染类、慢性病类产品销售增速较快,公司营业收入实现同比增长,盈利能力进一步提升;公司持续进行研发项目的分析评估与优化,聚焦推进重点优势品种的研发,研发费用同比减少;公司不断加强成本管理,降低单位生产成本,优化各类费用开支。
近年来奥赛康持续推进新药研发,通过自主研发与引进合作双向发力,重点聚焦小分子靶向创新药和肿瘤免疫生物创新药的研发,主要在研项目已有48项,包括已公开的多项重点在研化学、生物创新药,另有多款创新药处于临床前研究阶段。
奥赛康重点在研新药
除了已获批上市的1类新药利厄替尼片,目前奥赛康还有9款重点新药处于申报临床及以上研究阶段,包括7款1类新药及两款2类改良型新药,其中ASKB589注射液、注射用ASKG915、ASKC202片、注射用ASKG315均属于抗肿瘤和免疫调节剂。
7款1类新药中,ASKB589注射液(胃癌一线治疗)、麦芽酚铁胶囊(治疗成人铁缺乏症)已处于Ⅲ期临床研究阶段,上市可期;ASKG712注射液处于Ⅱa期临床研究阶段,注射用ASK0912、注射用ASKG915、ASKC202片、注射用ASKG315等多款1类新药处于Ⅰ期临床研究阶段。
资料来源:米内网数据库、公司公告注:米内网《中国三大终端六大市场药品竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。
免责声明:本文仅作医药信息传播分享,并不构成投资或决策建议。
本文为原创稿件,转载文章或引用数据请注明来源和作者,否则将追究侵权责任。投稿及报料请发邮件到872470254@qq.com稿件要求详询米内微信首页菜单栏商务及内容合作可联系QQ:412539092
【分享、点赞、在看】点一点不失联哦
上市批准一致性评价免疫疗法
2025-01-17
药械追踪
No.1 / 英派药业PARP抑制剂塞纳帕利获国家药监局批准上市
2025年1月16日,南京英派药业有限公司宣布,自主研发的塞纳帕利胶囊(商品名:派舒宁)已获国家药监局(NMPA)批准上市,用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在一线含铂化疗达到完全缓解或部分缓解后的维持治疗。
塞纳帕利是由英派药业自主研发的新型、高效的PARP1/2抑制剂,具有独特的分子结构,使其具备体外和体内高活性,以及高靶向选择性和广泛的安全窗口。塞纳帕利的获批是基于FLAMES研究,结果显示,塞纳帕利维持治疗能够显著延长晚期卵巢癌患者的中位无进展生存期(mPFS)(未达到vs 13.6月, HR 0.43,P<0.0001),且不论患者的BRCA基因表达如何,均能从塞纳帕利治疗中获益。同时,塞纳帕利耐受性良好,安全性可控。
2023年12月,英派药业与华东医药(000963.SZ)全资子公司中美华东就塞纳帕利在中国大陆的商业化推广达成合作。华东医药获得塞纳帕利在中国大陆的独家市场推广权益。
->点击文末阅读原文,解锁完整双语新闻
No.2 / 礼来抗IL-23米吉珠单抗获FDA批准克罗恩病新适应证
2025年1月15日,礼来宣布,美国食品药品监督管理局(FDA)已批准白细胞介素 23(IL-23)p19 拮抗剂Omvoh(米吉珠单抗)用于治疗成人中重度活动性克罗恩病。此前,Omvoh已于2023年10月获FDA批准用于成人中重度活动性溃疡性结肠炎(UC)。
此次获批基于随机、双盲、安慰剂对照的III期VIVID-1研究,该研究评估了Omvoh用于成人中重度活动性克罗恩病患者的疗效及安全性,入组患者对皮质类固醇、免疫抑制剂和/或生物制剂治疗反应不佳、失去反应或不耐受。VIVID-1研究已达到两项主要终点,治疗1年后Omvoh治疗组患者的临床缓解率(53% vs 36%)和内镜应答率(46% vs 23%)均显著高于安慰剂组。
此外,Omvoh还在开放标签扩展(OLE)研究VIVID-2中接受评估,旨在评估其在中重度活动性克罗恩病成人患者中长达三年的疗效和安全性。初步结果显示,在VIVID-1研究中达到一年内镜应答的患者继续接受额外一年治疗(即连续治疗两年),仍有超过80%维持内镜应答。
->点击文末阅读原文,解锁完整双语新闻
No.3 / 信达生物EGFR TKI利厄替尼获国家药监局批准上市
2025年1月17日,信达生物(1801.HK)发布公告称,第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)靶向药物奥壹新(利厄替尼片)的新药上市申请(NDA)获国家药监局批准上市,用于既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者治疗。
利厄替尼治疗EGFR T790M突变阳性NSCLC关键ⅡB期临床研究中,共计入组了301例经既往EGFR-TKI治疗后进展的EGFR T790M突变阳性或原发性EGFR T790M突变阳性局部晚期或转移性NSCLC受试者。经独立评审委员会(IRC)评估的客观缓解率(ORR)为68.8%,疾病控制率(DCR)为92.4%,中位缓解持续时间(DoR)为11.1个月,中位无进展生存期(PFS)为11.0个月。在颅内存在可评估病灶患者中,IRC评估的最佳ORR为65.9%,患者中位PFS为10.6个月,提示利厄替尼对中枢神经系统(CNS)患者具有良好疗效。利厄替尼主要不良反应与既往同类EGFR靶向抑制剂治疗的报道一致,耐受性较好。
同时,利厄替尼片的第二项NDA在国家药监局审评审批中,适应症为具有EGFR外显子19缺失(19DEL)或外显子21置换突变(L858R)的局部晚期或转移性NSCLC成人患者的一线治疗。2024年10月,信达生物与奥赛康药业就利厄替尼片在中国达成独家商业化合作。奥赛康作为该药上市许可持有人,负责合作产品的商业化生产及供货,并根据合作协议向信达生物支付销售推广服务费。信达生物取得合作产品在中国大陆地区的独家推广销售权,将按合作协议约定向奥赛康药业支付首付款、注册里程碑和销售里程碑款项。
->点击文末阅读原文,解锁完整双语新闻
企业动态
No.1 / 施维雅与谷歌云扩大合作,AI驱动药物研发
2025年1月16日,施维雅与谷歌云共同宣布,双方将扩大为期五年的合作伙伴关系,专注于利用人工智能(AI)和生成式人工智能(gen AI)技术,加速为患者研发创新治疗方案。施维雅与谷歌云曾于2022年8月签署了为期五年的初步合作伙伴关系协议,旨在帮助施维雅集团部署强大的技术结构,此次协议使双方的合作关系在原协议生效两年后延长了五年。
目前,双方已确定约60个生成式AI用例,以加速药物开发,包括识别新的治疗靶点和筛选(早期研究)、提高成功率、加速上市时间、了解疾病和药物的生物学演变以优化配方、开发精准医疗、数字化临床试验以进行患者招募和远程试验管理等。此外,此次合作还将涉及生产预测性维护、供应链优化、减少环境影响、加强医患互动以及优化监管事务管理和提升集团整体效率。谷歌云将支持施维雅团队在整个价值链中集成各种AI技术,同时确保所生成数据的安全性和保密性。
->点击文末阅读原文,解锁完整双语新闻
No.2 / 礼来与a16z合作成立风投基金,立足长期视角助力企业发展
Andreessen Horowitz(简称“a16z”)Bio+ Health宣布与礼来携手成立一项全新的、开创性的风险投资基金。该生物科技生态系统风投基金(Biotech Ecosystem Venture Fund)旨在通过投资治疗平台及前沿科技公司,带来新药和疾病治疗方法,以改善患者生活,从而驱动医疗保健领域的变革性进步。
基金将由a16z Bio+ Health管理,部署高达5亿美元的资金,用于公司从创立到成长的各个阶段。基金将重点推进新药研发、新型治疗模式平台的开发以及新兴健康技术的规模化应用。作为传统风投资金来源的补充,该基金将立足长期视角,助力颠覆性企业充分发挥新生物科学、工程技术和人工智能的潜力。基金将利用a16z在生物+健康公司搜寻、建立和扩展方面的优势,并结合礼来公司在生命科学研发方面的深厚专业知识。除了提供全部资本外,礼来还将有能力为这些公司提供额外资源,包括Catalyze360,这是一个专为生物科技初创企业提供支持的专门结构,涵盖礼来风投(Lilly Ventures)、礼来门户实验室(Lilly Gateway Labs)和礼来探索研发(Lilly ExplorR&D)。
->点击文末阅读原文,解锁完整双语新闻
行业政策
No.1 / 国家医保局:2026年底前全面实现基本医保基金即时结算
近日,国家医疗保障局办公室就推进基本医保基金即时结算改革发布通知,明确改革目标,以全国统一的医保信息平台为支撑,在做好医保基金预付的同时,充分考虑定点医药机构需求和能力,2025年全国80%左右统筹地区基本实现即时结算,2026年全国所有统筹地区实现即时结算。
国家医保局要求各地坚持优化传统结算与创新结算方式相结合,充分压缩流程和时长,由原来从定点医药机构申报截止次日到医保基金拨付不超过30个工作日减少至20个工作日。坚持基金预付与即时结算相结合,既通过基金预付增加医药机构现金总量,也通过即时结算加快医药机构现金流速。坚持试点与全面推进相结合,指导地方从实际出发,合理确定结算模式,以点及面,分步推开,按照时间节点逐步推进完成相关工作。
目前,首批基本医保基金即时结算改革试点将在6个全省、76个统筹地区开展。
->点击阅读原文,解锁完整双语新闻
行业政策
No.2 / 深化“证照分离”改革,药监局取消部分药品与放射性药品审批事项
2025年1月15日,国家药监局综合司发布了关于落实《国务院关于修改和废止部分行政法规的决定》(国务院令第797号)相关事宜的通知。
根据该通知,自2025年1月20日起,我国将取消“药品批发企业筹建审批”、“药品零售企业筹建审批”以及“医疗机构使用放射性药品(一、二类)许可”等三项审批事项,并将“药品、医疗器械互联网信息服务审批”改为备案管理。
此次改革是国务院深化“证照分离”改革的重要举措之一。取消上述审批事项后,开办药品批发企业和药品零售企业的申请人可依据相关法律法规要求,向所在地县级以上药品监督管理部门申请办理药品经营许可。同时,医疗机构使用放射性药品的无需再办理《放射性药品使用许可证》,使用配制的放射性制剂的医疗机构,应向所在地省级药品监督管理部门申请核发相应等级的许可证。
开展药品、医疗器械互联网信息服务的,应当向所在地省级药品监督管理部门办理备案。在备案管理具体办法发布前,备案资料将参照深化“证照分离”改革在自贸试验区开展备案试点工作的要求执行,提交资料即完成备案。
为确保改革措施的有效实施,通知要求各级药品监督管理部门认真落实事中事后监管责任,加强药品和医疗器械全过程、全生命周期质量监管,依法查处违法违规行为,督促企业持续依法合规经营,有效保障产品质量安全。
->点击阅读原文,解锁完整双语新闻
全球医疗情报领导者
解锁隐藏在数据中的商业潜力
关于 G B I
”
自从2002年成立以来,GBI始终以技术为驱动,为药企、器械及行业相关服务商提供贯穿生命周期的全球药品市场竞争数据、全球行业资讯、HCPs洞察、全国医疗器械数据等商业信息与洞察,助力企业在进行战略布局和决策时,脱颖而出。历经20余年的深耕细作GBI已成为95%以上跨国药企、国内头部药企、咨询与投资机构等医疗圈灯塔用户值得信赖的长期合作伙伴。
联系我们
投稿 | 发稿 | 媒体合作
▶ zhangxinyue13@baidu.com
数据库 | 咨询服务 | 资讯追踪
▶ 点击左下“阅读原文”完成表单填写
点击阅读原文,解锁完整双语新闻
上市批准临床3期临床结果
2024-04-23
·药研发
「 本文共:15条资讯,阅读时长约:3分钟 」今日头条鞍石脑胶质瘤新药获批上市。鞍石生物旗下浦润奥生物c-Met抑制剂伯瑞替尼肠溶胶囊获国家药监局批准新适应症,用于治疗经放疗和替莫唑胺(TMZ)治疗后复发或不可耐受的、具有PTPRZ1-MET(ZM)融合基因的异柠檬酸脱氢酶(IDH)突变型WHO 4级星形细胞瘤或既往有较低级别病史的胶质母细胞瘤(GBM)成人患者。在Ⅱ/Ⅲ期临床中,伯瑞替尼相比化疗降低了患者48%的死亡风险。国内药讯1.传奇/强生CAR-T获批新适应症。传奇生物与强生开发的BMCA CAR-T疗法西达基奥仑赛(Carvykti,cilta-cel)获欧盟委员会(EC)批准,用于治疗至少经一线治疗(包括蛋白酶体抑制剂和免疫调节剂)、并对来那度胺耐药的复发和难治性多发性骨髓瘤(RRMM)患者。在III期CARTITUDE-4研究中,Carvyktii二线治疗改善了患者无进展生存期(HR=0.41,p<0.0001)。2022年5月,该新药已被EC附条件批准上市,治疗至少接受过3种前期疗法的RRMM患者。2.信达引进胆管癌新药获批澳门上市。信达生物从Incyte引进的FGFR1/2/3抑制剂pemigatinib(达伯坦)获澳门药监部门(ISAF)批准上市,用于治疗FGFR2融合或重排、局部晚期或转移性胆管癌经治患者。在Ⅱ期临床FIGHT202中,pemigatinib在这类患者中经影像学确认的ORR达到37.0%(95% CI: 27.94%, 46.86%),中位DOR为8.08个月。信达拥有该新药在中国大陆、香港、澳门和台湾地区的商业化权益。3.百利天恒双抗ADC获批II期临床。百利天恒HER3/EGFR双抗ADC创新药BL-B01D1获国家药监局临床默示许可,即将开展评估BL-B01D1与PD-1抑制剂信迪利单抗双药不联合或联合化疗治疗局部晚期或转移性非小细胞肺癌患者的Ⅱ期临床。BL-B01D1此前已被CDE拟纳入突破性治疗品种,用于既往经PD-1/PD-L1单抗治疗且经至少两线化疗(至少一线含铂)治疗失败的复发性或转移性鼻咽癌(NPC)患者。4.华东双靶点减肥药获批美国临床。华东医药旗下中美华东GLP-1R/GIPR双靶点激动剂HDM1005获FDA批准开展Ⅰ期临床,用于成人超重或肥胖人群的体重管理。HDM1005可通过激活GLP-1受体和GIP受体,促进胰岛素释放、抑制食欲,具有降糖和减重的潜力。今年3月,该新药已在国内获批临床许可,拟开发用于2型糖尿病和超重或肥胖人群的体重管理。5.熙源安健融资开发止痛新药。熙源安健宣布完成超亿元Pre-A和Pre-A+融资,用于推进产品管线疼痛管理领域创新性候选药物(BR005和BR01T等)的临床开发。BR005是一款小分子CGRPR拮抗剂,旨在选择性结合CGRP受体以抑制该通路,从而发挥治疗作用,目前正在国内开展用于治疗成人有先兆或无先兆急性偏头痛的Ⅰ期临床。BR01T是一款TrkA抗体,正在美国针对慢性下腰痛患者开展Ⅰ期临床。国际药讯1.ImmunityBio公司膀胱癌新药获批上市。ImmunityBio公司IL-15超级激动剂Anktiva(nogapendekin alfa inbakicept)获FDA批准上市,联合卡介苗(BCG)用于治疗对BCG无应答且伴有原位癌(CIS)的非肌层浸润性膀胱癌(NMIBC)成年患者。在II/III期研究QUILT 3.032中,患者的完全缓解(CR)率达到62%(95% CI:51,73),有58%的患者持续缓解时间超过12个月,40%的患者持续缓解时间超过24个月。此前,FDA已授予Anktiva突破性疗法认定。2.辉瑞/艾伯维复方抗生素获批上市。辉瑞制药与艾伯维联合开发的复方抗生素Emblaveo(aztreonam/avibactam)获欧盟委员会(EC)批准上市,用于治疗成人复杂性腹腔内感染(cIAI)、医院获得性肺炎(HAP,包括呼吸机相关性肺炎[VAP]),以及复杂性尿路感染(cUTI,包括肾盂肾炎)。在Ⅲ期研究中,Emblaveo的治愈率相比活性对照药物达到了非劣效标准,对cIAI患者的治愈率达到76.4%(vs74.0%),对于HAP和VAP的治愈率达到45.9%(vs41.7%)。3.拜耳心衰基因疗法获快速通道资格。拜耳旗下公司Asklepios基因疗法AB-1002获FDA授予快速通道资格,用于一次性冠状动脉内输注,治疗充血性心力衰竭(CHF)。AB-1002旨在促进产生CHF相关蛋白质抑制剂1(I-1c)的组成型活性形式,阻断蛋白磷酸酶1的作用,以达到治疗目的。目前,AB-1002正在Ⅱ期临床中评估用于治疗患有非缺血性心肌病伴有纽约心脏病协会(NYHA)III级心衰症状的成年患者的安全性和有效性。4.血癌小分子新药获突破性疗法认定。Kura Oncology公司选择性menin抑制剂ziftomenib获FDA授予突破性疗法认定,用于治疗携带NPM1基因突变的复发/难治性急性髓系白血病(AML)患者。在Ⅰ期临床KOMET-007中,ziftomenib联合标准疗法一线治疗NPM1突变型和KMT2A重排型AML患者,达到了100%的完全缓解(CR)率;在难治/复发(R/R)性AML患者中,达到了56%的完全缓解或完全缓解伴部分血液学恢复(CRh)率。5.卫材与BioArctic公司再次合作开发AD新药。卫材与BioArctic公司就后者基于专有穿越血脑屏障技术开发的下一代阿尔茨海默病(AD)候选药物BAN2802达成合作许可协议。双方将共同分担研究评估计划的费用,卫材将拥有开发BAN2802用于治疗AD的选择权。值得一提的是,两家公司此前合作开发的Aβ抗体Leqembi(lecanemab)已在去年7月获得FDA完全批准上市,可以减缓早期阿尔茨海默病的进展。6.Marinus公司癫痫调节剂Ⅲ期临床失败。Marinus公司GABAAR正变构调节剂加奈索酮(Ganaxolone)治疗难治性癫痫持续状态(RSE)的Ⅲ期临床RAISE未达到预设的终止标准。独立数据监测委员会(DMC)建议继续评估经静脉注射Ganaxolone在难治性RSE的未来发展。2022年3月,FDA已批准该产品口服混悬制剂上市,商品名为ZTALMY,用于治疗与CDKL5缺乏症(CDD)相关的癫痫发作。医药热点1.石药创新制药高管辞任。石药创新制药(新诺威)发布公告,宣布董事会收到总经理韩峰先生及董事王怀玉先生的书面辞任报告。因工作调整需要,韩峰先生申请辞任公司总经理职务,将继续担任公司董事职务,并分管公司功能性原料相关业务。王怀玉先生因个人原因申请辞任公司董事职务,辞职后不再担任公司任何职务。2.全国胰岛素集中采购在上海开标。国家医保局近期组织全国各省份开展胰岛素集采协议期满后接续采购,并于23日在上海开标。本次接续采购全国共有35000多家医疗机构参加,填报胰岛素需求量超过2.4亿支,涵盖临床常用的二代和三代胰岛素。2021年11月,国家组织胰岛素集中采购首次将生物药纳入集采范围,中选产品平均降价48%,我国胰岛素价格从全球价格高地降至全球较低水平。3.上海:三级医院50%号源提前5天下放。4月19日,上海市卫健委党组书记、主任闻大翔做客“2024民生访谈”栏目时谈到,上海持续推进社区卫生服务中心能力建设,其中为进一步做好“上下联动”,今年将大力推进上级医院号源下放社区卫生服务中心,即三级医院50%的号源将提前5天给到社区卫生服务中心,优先向家庭医生、向社区居民开放,没有用掉的号源回到号源池,上级医院再向社会其他平台开放。评审动态 1. CDE新药受理情况(04月23日) 2. FDA新药获批情况(北美04月22日)股市资讯上个交易日 A 股医药板块 +0.27%涨幅前三 跌幅前三迪哲医药+10.99% 拓新药业-13.15%甘李药业 +9.99% 智飞生物-11.99%奥 赛 康 +9.98% 富 士 莱 -8.43%【通化东宝】4月23日公司在全国药品集中采购(胰岛素专项接续)投标中,产品人胰岛素注射液、精蛋白人胰岛素注射液、精蛋白人胰岛素混合注射液(30R)、精蛋白人胰岛素混合注射液(40R)、精蛋白人胰岛素混合注射液(50R)、甘精胰岛素注射液、门冬胰岛素注射液、门冬胰岛素30注射液、门冬胰岛素50注射液多个规格产品获得拟中选资格。【甘李药业】4月23日公司在全国药品集中采购(胰岛素专项接续)投标中,产品精蛋白人胰岛素混合注射液(30R)、赖脯胰岛素注射液、门冬胰岛素注射液、甘精胰岛素注射液、精蛋白锌重组赖脯胰岛素混合注射液(25R)及门冬胰岛素30注射液等品种获得拟中选资格。【新产业】公司产品“抗Ro-52抗体IgG测定试剂盒(磁微粒化学发光法)”和“氨测定试剂盒(谷氨酸脱氢酶法)”获得医疗器械注册证。【百克生物】公司“鼻喷流感减毒活疫苗”上市许可申请获得受理。【百济神州】欧盟委员会批准“百泽安(替雷利珠单抗注射液)”用于三项非小细胞肺癌适应症的一线及二线治疗。- The End -戳“阅读原文”,了解更多医药研发及股市资讯。
上市批准免疫疗法临床2期细胞疗法临床3期
100 项与 Suzhou Idiocess Medical Technology Co., Ltd. 相关的药物交易
登录后查看更多信息
100 项与 Suzhou Idiocess Medical Technology Co., Ltd. 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年09月26日管线快照
无数据报导
登录后保持更新
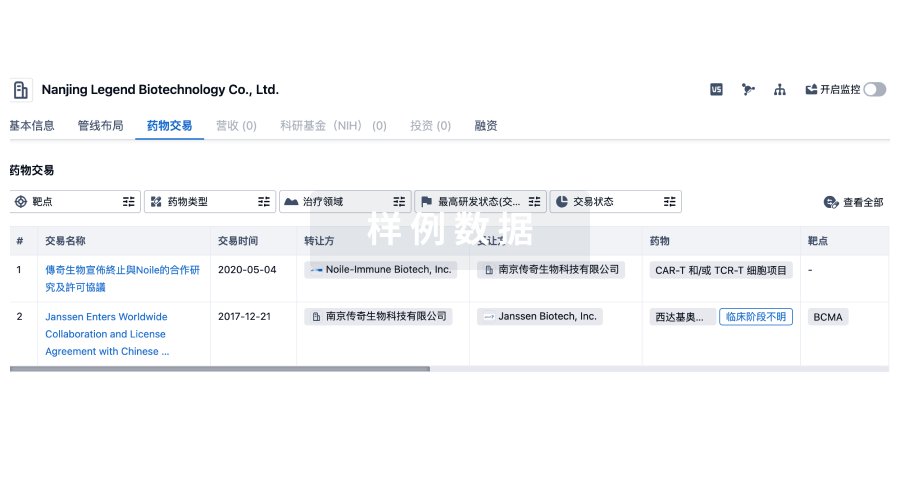
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
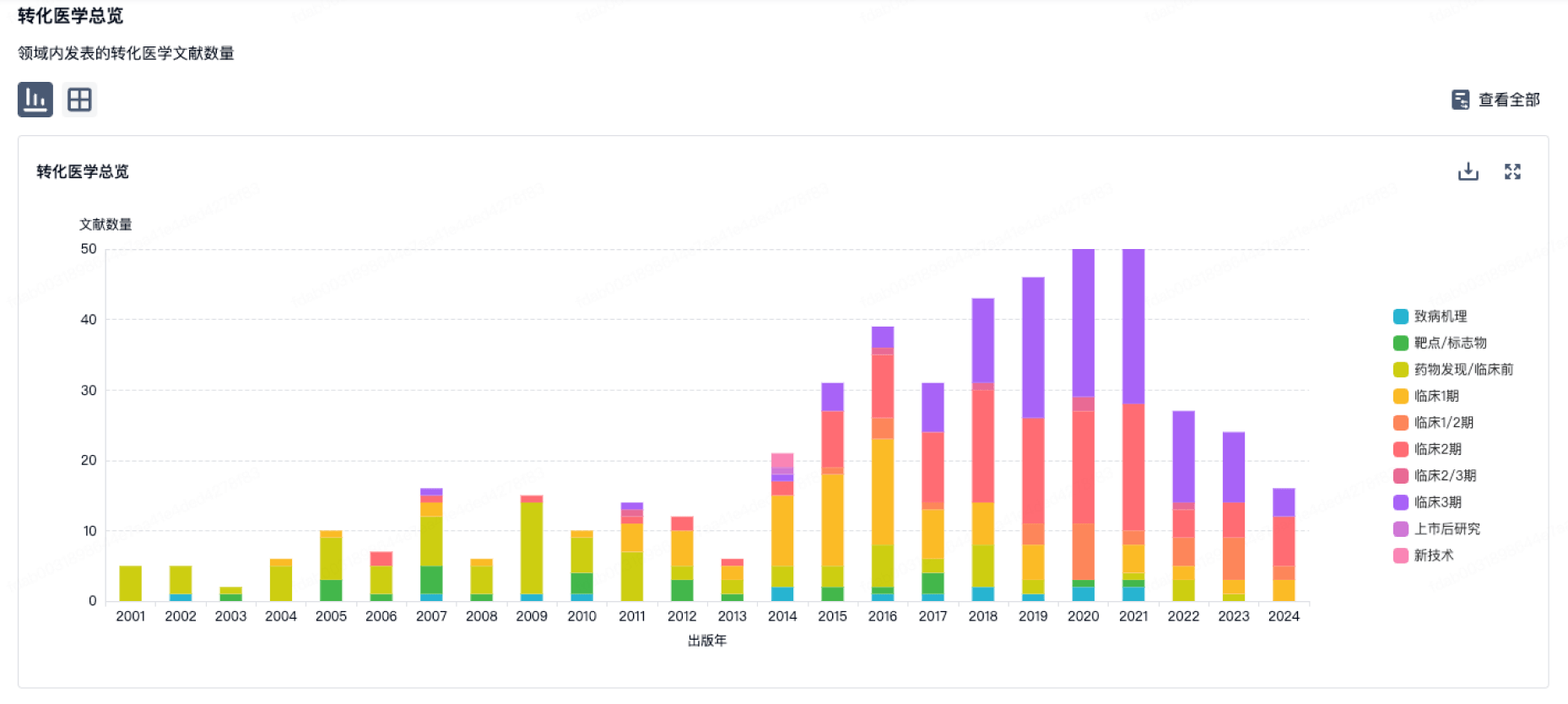
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
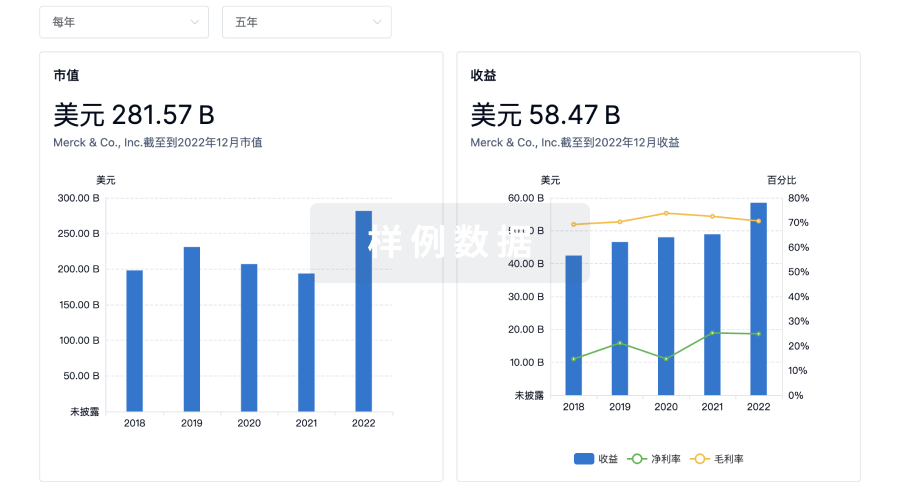
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
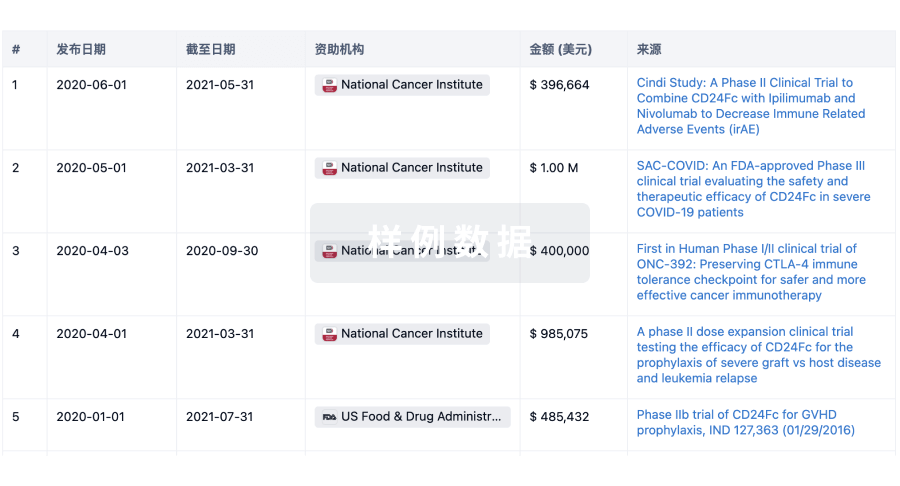
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
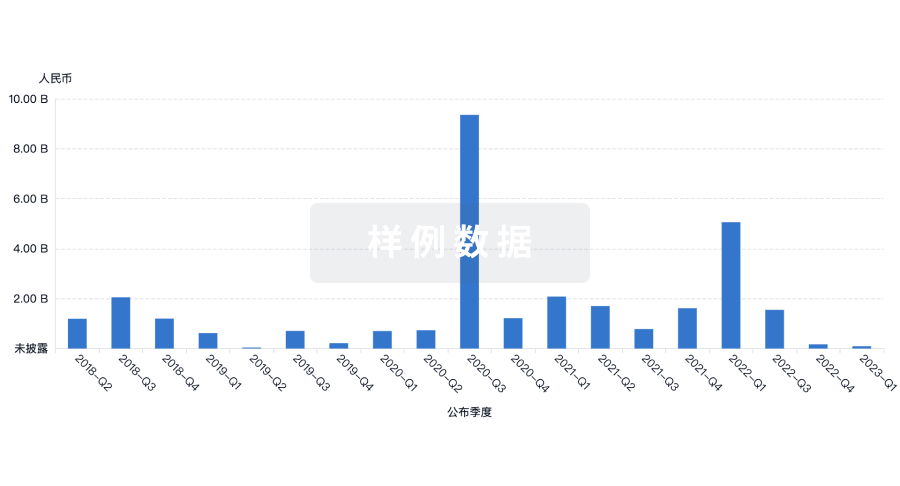
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
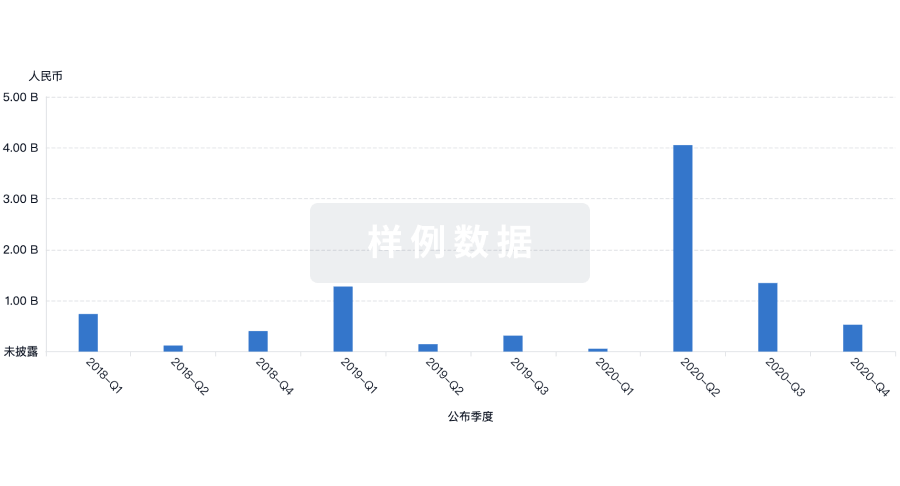
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用