更新于:2024-11-01

Taiwan Global Angels
更新于:2024-11-01
概览
关联
100 项与 Taiwan Global Angels 相关的临床结果
登录后查看更多信息
0 项与 Taiwan Global Angels 相关的专利(医药)
登录后查看更多信息
74
项与 Taiwan Global Angels 相关的新闻(医药)2024-10-23
·药研
是否参会均可转发领奖,详见标题六【有奖转发】
【邀请函】
冻干是非常严苛的脱水过程,如何在冻干过程中保持生物药的活性,以及保持冻干产品的货架储存期稳定性是对制剂人员的极大的挑战。通过广泛的分析表征、透彻了解生物药(治疗性蛋白质)在冻干条件下的稳定性行为,结合对蛋白质及相关辅料基本性质的良好理解,能够使制剂工作者更合理地进行生物冻干制剂的处方设计。而对冻干工艺、原理的深刻理解则是正确设计与优化冻干流程,制备稳定冻干产品的先决条件。所以对一个成功的冻干制剂,其配方与工艺两方面必须同时开发。
本课程将力求对这两方面进行深入浅出的解释:首先从蛋白质的结构与性质出发,阐述影响蛋白质各种物理与化学不稳定性因素之原因与解决对策;同时对冻干各步骤工艺参数之设定与优化予以深入解析,并结合实例介绍如何将参数优化运用到冻干曲线的开发之中。优质课程,请勿错过!
一、培训大纲
模块一:概述
第1节:生物药的范畴、分类与发展前景
第2节:冻干技术在生物药制剂领域的应用与前景
模块二:冻干过程与原理
第1节:冻干机的种类、容量、基本组件构成、及其各组件的功能
第2节:冻干曲线的阶段划分与作用
● 预冻与成核
● 退火与结晶
● 初级干燥解析
● 二级干燥解析
第3节:冻干原理与过程浅析
● 稀溶液的依数性
● 相点与体系点
● 平衡态、亚稳态、与非平衡态
● 从水的单组分体系相图看水在冻干中的状态变化与传质过程
● 水-糖二元体系相图解析
● 水-糖赝二元体系状态图解析
● 最大浓缩相及特性
● 低温下的化学反应动力学
● pH位移及其对蛋白质稳定性的影响
● 生物药的降解与影响因素
模块三:冻干工艺流程解析
第1节:冻干工艺的关键技术参数、意义、及其相互关系
● 冷冻温度与时间
● 退火温度之设定
● 搁板温度与产品温度
● 真空度与凝固点
● 冷凝室温度
● 冻干腔水分的监测
● 两种玻璃化转变温度及各自的作用功能
● 水分对玻璃化转变温度的影响
● 传热与传质平衡
第2节:冻干终点的确定
模块四:生物冻干制剂的处方研究
第1节:冻干制剂配方开发的若干考虑
第2节:冻干制剂常用辅料及其功能
● 晶体与无定形
● 单糖与多糖,还原糖与非还原糖
● 赋型剂
● 保护剂
第3节:蛋白质在冻干过程中的退化、降解
第4节:冻干过程蛋白质稳定性的保护机理
第5节:冻干制剂案例解析
● ADC
● 吸入剂
● 微球
● 脂质体
● 抗体
● 融合蛋白
模块五:冻干工艺参数的测试方法
第1节:冻干关键工艺参数的常用检测仪器
第2节:如何获取正确的关键工艺参数
模块六:冻干工艺设计、优化实例解析
第1节:关键工艺参数的确定
第2节:应用关键工艺参数设计、优化冻干曲线
第3节:冻干产品的存储稳定性
模块七:冻干注射剂发补分析解读
第1节:冻干注射剂技术质量要点
第2节:冻干注射剂常见发补汇总
第3节:冻干注射剂发补分析解读
本培训含3次互动答疑
*培训内容会前可能有适当调整,请以最终通知为准。
二、专家简介
刘老师
跨国药企研发部门负责人
刘老师具有近30年美、中制药行业的制剂研发与生产工作经验。曾分别在数家美国药企及国内药企任高级或资深研究员,高级首席研究员,产品研发总监,CMC高级总监,研发部门负责人等职。曾参与数家全球知名药企的多款上市新药以及医美产品的研发,包括但不限于:Exubera® (胰岛素干粉吸入剂,Inhale/Pfizer辉瑞),Tobi Podhaler® (妥布霉素干粉吸入剂, Inhale/Novartis诺华), Natrecor®(注射用奈西立肽,Scios/JNJ 强生), Nplate® (注射用罗米司亭, Amgen安进), JUVÉDERM Ultra® 系列面部美容填充剂(Allergan/Abbott艾尔健/雅培);亦曾参与、负责或领导过多款创新药项目的早期开发筛选,制剂的临床前及临床研究,以及多个改良药、仿制药项目的研发、生产、或项目管理。对于各类注射制剂及固体、半固体制剂, 干粉吸入剂,药械组合的研发与生产, 冻干及热喷干燥技术,API、辅料的处方前研究与理化表征等有丰富经验,对IND、CTA、A/NDA等资料的撰写与申报亦有丰富经验。回国后曾帮助多家中外药企进行新药、仿制药研发与中美、欧双报,国外药品地产化,及一致性评价等方面的项目。
经常受邀为各种药学行业会议做专题演讲,曾为多家药企提供技术培训或咨询,并多次为各类基金机构提供医药领域投资的技术咨询,以及为业界同行提供了无数次的技术咨询。
黄老师
国内Top3注射剂企业研究院院长
从事药品研发接近20年,具备丰富的注射剂研发与注册申报经验,熟悉冻干等无菌制剂从研制到大生产的各个环节,黄老师作为国内排名靠前制药集团的研发负责人,极少公开授课。此次有幸邀请到黄老师,期望可以为广大制药同仁带来更多干货!
三、培训对象
1.生物药物(血液、细胞、蛋白质、酶、疫苗、肽等)生产企业研发、质量、生产、注册申报、设备管理等相关人员。
2.化学药物(抗生素、维生素、肿瘤药物、循环器官药物等)生产企业研发、质量、生产、注册申报、设备管理等相关人员。
3.化妆品产品生产企业研发、质量、生产、注册申报、设备管理等相关人员。
4.冻干设备生产、研发、代理销售及外资、合资企业。
5.从事冻干相关产业的高校科研人员及合作研发机构CRO公司等。
四、时间及形式
1.培训时间:2024年10月26-27日
26日上午9:00-12:00,下午13:30-16:30
27日上午9:00-12:00,下午13:30-15:30
2.培训形式:在线研讨班(腾讯会议)
报名人员可投影大屏幕,召集员工集体学习。培训开始前3天进行集中调试。培训全程实时线上授课+互动答疑!
3.回放:培训结束后提供3天不限次免费回放。
五、培训报名
1.报名费(原价6800元/账号/企业)
3800元/账号/企业
企业会员:免费
报名人员可投影大屏幕,召集员工集体学习。
2.交费信息:
诺和医药科技沧州有限公司;
账号:0408010809300138975;
开户行:中国工商银行沧州福宾支行;
付款时请备注:药研论坛第100期
如使用个人账户缴费,请付至刁老师微信/支付宝:15911172616
3.报名咨询:
周老师:13363179160
微信:扫码添加
4.服务监督电话:15911172616
FDA药品IND/NDA/ANDA注册与注册发补
药品出海东南亚、WHO、EU及TGA全流程指导
生物制品生产质量体系全流程建立及合规管理
六、有奖转发(资料、笔记本、体重秤)
1.非参会人员
奖品:CDE等行业专家电子版文章合集820+篇(截至2024.10)。
获得方式:非参会人员转发本会议通知到朋友圈(所有人可见)或3个制药微信群,满12小时后截图,并在10月25日24:00前将截图上传至下方二维码,即可在10月29日当天邮件获得该电子版资料合集,本活动真实有效。
非参会人员上传截图专用
2.参会人员
奖品1:笔记本2个或体重秤1个,2选1(每家报名企业限5人,按登记时间为序)。
奖品2:CDE等行业专家电子版文章合集820+篇(截至2024.10)。
获得方式:参会人员转发本会议通知到朋友圈(所有人可见)或3个制药微信群,满12小时后截图,并在10月25日24:00前将截图上传至下方二维码,即可在培训结束后一周内免费邮寄奖品1(奖品2将于10月29日当天邮件群发),本活动真实有效。
参会人员上传截图专用
支持媒体
关于药研
药研论坛:药研主导的大型培训会议(收费类)已筹办90余期,据统计,中国医药工业百强企业和研发百强企业均超过90%参加过药研培训会议。截至2023年底,已为包括上海强生、辉瑞、阿斯利康、山德士、日本大冢、大鹏、卫材、小林制药、扬子江、华海药业、恒瑞医药、正大天晴、科伦药业、西安杨森、丽珠集团、石药集团、华北制药、香港澳美、东阳光、中国医学科学院、中国科学院、上海医工院、亚宝药业、远大集团、豪森药业、海正药业、天士力、以岭药业、成都倍特、陕西步长、北京协和、华润紫竹、华润双鹤、北京泰德制药、江苏先声药业、鲁南制药、山东齐鲁、山东绿叶、仙琚制药等知名企业在内的2800+企业和机构提供了高质量的专业化培训,均收到良好效果,会后获得参会企业一致好评。药研论坛培训班质量在近几年制药行业培训机构中处于一流水平。
报名及会员咨询:
周老师:13363179160,微信:yaoyanluntan
欲报从速、额满为止!
抗体药物偶联物
2024-10-18
·同写意
此次医博会由同写意策划,以“发展新质生产力,共享健康新未来”为主题,用全新的视角瞄准国内外医药及大健康产业发展前沿。诚邀海内外医药及大健康各界嘉宾齐聚中国医药城,共赴时代之约。展位/报告火热征集中!
澳大利亚治疗品管理局(TGA)表示,不会批准卫材和渤健的阿尔茨海默病治疗药物Leqembi(lecanemab),因为其疗效并未大于风险。
该监管机构对此的解释是,尽管在关键的Clarity AD试验中,接受Leqembi治疗的患者与接受安慰剂治疗的患者相比,疾病进展减少,“但这种差异不足以提供有意义的临床获益或大于相关的安全风险”。
TGA引用了使用抗淀粉样蛋白药物的患者出现脑肿胀或出血的案例,即淀粉样蛋白相关性影像异常(ARIA),称其立场是根据下设的药物咨询委员会(ACM)的建议。
患者权益组织澳大利亚痴呆症协会评论道,他们对TGA的决定感到失望,认为这将剥夺澳大利亚人痴呆患者获得新疗法潜在益处的选择。
卫材澳大利亚公司表示会在90天内提交申请,请求TGA重新考虑这个决定,后者必须在60天内做出回应。
无独有偶,今年7月,欧盟监管机构也对Leqembi给出了类似的态度,EMA的药品委员会(CHMP)对卫材和渤健的阿尔茨海默症药物Leqembi的批准给出负面意见。
当时,CHMP表示,虽然在主要研究中,大多数ARIA病例并不严重,也没有症状,但有些患者出现了严重的症状,包括脑部大出血,需要住院治疗。此外,该机构还担心携带APOE4蛋白基因的人患ARIA的风险更高。
随后,卫材和渤健报告了Clarity AD的最新结果。数据显示,与基线相比,接受Leqembi治疗的最早期阿尔茨海默病患者亚群中,51%在三年内表现出持续的认知和功能改善,这些患者在基线时大脑没有检测到Tau蛋白或Tau蛋白水平很低。
持续三年使用lecanemab治疗未观察到新的安全问题。大多数淀粉样蛋白相关成像异常(ARIA)发生在治疗的首六个月。六个月后,ARIA的发生率较低,与安慰剂组相似。
报告称治疗的益处会随着时间的推移而增加。
Leqembi已经在美国、日本、中国、韩国、香港、以色列、阿联酋和英国获得批准,且已登陆美国、日本和中国市场。
今年第二季度,Leqembi销售额达到4000万美元,高于今年前三个月的1700万美元和2023年全年的1000万美元。虽然Leqembi的销售有所放缓,但有回升的迹象。
参考文章:
1、Australia joins EU in turning down Alzheimer's drug Leqembi;pharmaphorum
2、卫材/渤健阿尔茨海默病疗法3年长期数据公布!;药明康德
同写意媒体矩阵,欢迎关注↓↓↓
2024-10-15
·药研
(点击图片 查看详情)
目前有越来越多的药物制备成肠溶制剂,笔者根据以往审评经验,同时参考调研文献,主要以质子泵抑制剂类肠溶制剂为切入点,从肠溶制剂的处方工艺、质量研究、稳定性等方面,提出了药学研究的一般考虑,重点需关注调试制剂的剂量倾泻研究、溶出曲线相似性研究和涉及鼻胃管给药时的体外对比研究等,以期对该类仿制药物的研发和注册申报提供参考。
肠溶制剂指在规定的酸性介质中不释放或几乎不释放药物,而在要求的时间内,于pH 6. 8 磷酸盐缓冲液中大部分或全部释放药物的制剂[1] 。将药物制成肠溶制剂的目的主要有以下几个方面:① 避免药物受到胃内酶类或胃酸的破坏,如质子泵抑制剂类肠溶制剂。② 避免药物对胃黏膜产生强烈刺激,引起恶心、呕吐等不良反应。③ 将药物传递至局部部位(如肠)发挥作用。④ 提供延迟释放作用。⑤ 将主要由小肠吸收的药物尽可能以最高浓度传递至该部位。
药品出海东南亚、WHO、EU及TGA全流程指导
肠溶制剂在其处方工艺、质量控制等方面有一定的特殊性,本文主要结合质子泵抑制剂类(主要指拉唑类)肠溶仿制制剂的审评经验,并参考前期的文献调研,总结汇总了质子泵抑制剂类肠溶仿制制剂开发中药学研究的一般考虑,以期为该类仿制药物的研发和注册申报提供一定参考。本文内容仅代表个人观点,如与现有的技术要求有出入,请以官方发布的技术指南为准。
1 质子泵抑制剂类肠溶仿制制剂开发中药学研究的一般考虑
下文主要从此类仿制制剂的处方工艺开发、质量研究及稳定性等方面展开,更多研究内容仍需持有人或生产企业根据品种情况具体问题具体分析。
1. 1 处方工艺开发
处方工艺开发主要依据ICH Q8 开展相关研究,以下分2 个方面进行论述,即处方开发和工艺开发。
1.1. 1 处方开发
建议先对参比制剂的处方信息进行充分调研,参考参比制剂说明书及公开的相关文献,确定处方中的辅料种类。以产品的关键质量属性为考察指标对辅料的用量进行筛选,根据研究结果确定处方中的辅料用量。下面重点介绍质子泵抑制剂类肠溶制剂处方研究中的特殊关注点。
如原料药的晶型和粒度对产品的溶出等有影响,需对其晶型和粒度进行研究,根据研究结果制定合理的控制策略。拉唑类活性物质一般情况下遇酸易降解,而常用的肠溶材料呈弱酸性,药物与之接触会降解或变色,一般需要在含药部分与肠溶层之间增加一道隔离层,避免活性成分发生降解。
此外,当涉及该类制剂申请多规格生物等效性豁免时,有一个较关键的问题就是处方相似性判定。
生物药冻干制剂开发:处方与工艺
肠溶制剂处方中包括释药控释性辅料和非释药控释性辅料,其处方变化幅度的计算方式不同,需参照《已上市化学药品变更研究的技术指导原则(试行)》[2] 执行。释药控释性辅料以辅料占原批准处方中所有释药控释性辅料总重量的百分比进行计算,非释药控释性辅料以辅料占原批准处方总重量的百分比计算。如要进行生物等效性豁免,一般要求不同规格处方等比例变化或与参比制剂处方一致抑或其处方变更幅度在中等变更范围内。肠溶制剂所有辅料(含非释药控释性辅料和释药控释性辅料)变更占原批准处方总重量的和不超过5%,属微小变更;所有辅料变更占原批准处方总重量的和不超过10%,属中等变更;超过中等变更属重大变更[3] 。一般情况下,包肠溶衣机制的肠溶制剂的比表面积对肠溶制剂的溶出行为影响较大,在变更其辅料用量时,可以考虑肠溶制剂的比表面积[3] 。
1.1. 2 工艺开发
目前获批的质子泵抑制剂类肠溶片的制备工艺主要有2 种。一种是湿法制粒压片后包隔离衣和肠溶衣,最终靠最外层的肠溶衣膜达到延迟释放的作用,活性成分在素片中。该工艺并不复杂,采用常规的设备和工艺便能制备,建议控制包衣增重在合适范围内,并关注工艺的稳健性和可重复性。
另一种制备工艺较复杂,即采用微丸压片工艺制备的肠溶片,如艾司奥美拉唑镁肠溶片,参考阿斯利康公司艾司奥美拉唑镁肠溶片专利(专利号:95190815. 4,多单元片剂)[4] ,该制备工艺一般是采用蔗糖丸芯或其他糖丸作为载体,先进行上药层微丸包衣,然后依次是隔离层包衣、肠溶层包衣、保护层包衣、总混、压片等工艺,制备成含多单元药物的口服肠溶片。该工艺较复杂,各工艺参数可能都会对成品质量产生影响,需进行详细的研究和验证,以充分证明工艺的稳健性。
对于采用微丸压片工艺制备的拉唑类肠溶片一般需重点关注以下内容:① 处方中丸芯为关键辅料,不同大小的丸芯可能会影响上药层的厚度,进而影响溶出,需要关注处方中丸芯的粒度。② 如采用流化床上药工艺制备载药层,该工艺对原料药粒径要求较高,建议对原料药的粒径进行研究,根据研究结果制定合理的控制策略。③ 隔离衣厚度不同可能导致对上药层微丸的包裹完整程度不同,进而表现为对上药层微丸的保护作用不同。不同的隔离层衣膜厚度也会对产品的溶出产生一定影响。建议对不同的隔离层包衣增重进行研究,根据研究结果制定合理的隔离层包衣增重范围。④ 肠溶衣膜需要具有一定的柔韧性,防止在后续压片工艺中产生裂纹,从而导致产品耐酸的失败而无法达到肠溶释放的目的。建议对增塑剂的用量进行考察,确定增塑剂的合理用量。增塑剂用量过多可能会导致酸性物质透过隔离层迁移到上药层中与原料药直接接触,产生稳定性问题。同时也需要选择合适的肠溶层厚度,以达到目标肠溶效果。⑤ 一般情况下,在肠溶层外还会选择包保护层,可进一步防止肠溶衣的小丸聚集,进一步保护肠溶包衣层,以防在压制过程中开裂。⑥ 其他可能的关注事项需视具体产品具体分析。
除了肠溶片外,目前按新注册分类4 类获批的剂型中主要还包括肠溶胶囊,其处方工艺开发可参考片剂,不再赘述。其他剂型的申报相对较少,不再进一步讨论。
1. 2 质量研究
肠溶制剂的质量标准及质量研究有其特殊之处,除了常规考察项(如性状、鉴别、有关物质及含量等)外,仍需重点关注以下内容。
1. 2. 1 溶出度
该类制剂一般是先在酸性介质中进行耐酸考察1 ~2 h,然后转移到pH 6. 8 或其他偏碱性的缓冲液介质中进行溶出度考察。如雷贝拉唑钠肠溶片,《中华人民共和国药典》中规定耐酸2 h后,供试片均不得有变色、裂缝或崩解现象,耐酸2 h后转移到偏碱性的缓冲液介质中,并拟定相应的溶出度标准。部分品种需要制定耐酸力考察项。
1.2. 2 剂量倾泻研究
肠溶制剂为调试制剂,需按照现行的技术指导原则开展剂量倾泻研究,以证明自制制剂无剂量倾泻风险或剂量倾泻程度低于参比制剂,如自制制剂倾泻程度高于参比制剂,应评估是否需要通过生物等效性试验证明与参比制剂的一致性[5] 。
一般情况下,调试制剂的剂量倾泻试验参照我国发布的指导原则开展即可,但也有个别情况存在例外,如右兰索拉唑肠溶口崩片[12] 。美国FDA 个药指南中除了要求在0. 1 盐酸介质中的剂量倾泻研究,同时还要求缓冲液介质中的剂量倾泻研究,即将完成酸介质中剂量倾泻研究的供试品转移到加入相同浓度乙醇的pH 7. 2 的缓冲液介质中继续考察剂量倾泻情况。关于剂量倾泻试验需要具体品种具体分析。
1.2. 3 溶出曲线相似性研究
一般情况下,溶出曲线相似性研究符合现行的技术指导原则要求即可,当涉及多规格生物等效性豁免时,需重点关注溶出曲线相似性评价。溶出介质和溶出转速应参照《〈已上市化学药品药学变更研究技术指导原则(试行)〉溶出曲线研究的问答》[6] 进行选择。由于部分肠溶制剂的溶出差异较大,批内批间均一性较差,药物溶出量的相对标准偏差可能不符合非模型依赖的相似因子法(f2 )的要求,可能需要选用其他溶出相似性评价方法进行评价。
某些产品可能比较特殊,需要具体问题具体分析,如右兰索拉唑肠溶胶囊[10] 。该产品已在美国上市(商品名:Dexilant),该胶囊中装填有2 种不同释药行为的微丸,使其能有效地在全天控制胃酸的分泌,减轻不良反应[11] 。美国FDA 个药指南中涉及该产品的大小规格生物等效性试验豁免时对溶出曲线提出了更高要求,需要提供多种溶出介质中的溶出相似性研究资料,具体溶出条件要求汇总见表1。
对右兰索拉唑肠溶胶囊的溶出曲线提出如此高的要求是因为该产品体现出双相释放机制,该产品中灌装了2 种类型的肠溶微丸,其中一种微丸在小肠的近端(pH 约5.5)释放,另一种微丸在肠道的远端(pH约6.75)释放,为达到较好的血药浓度,这2 种类型的微丸需保持在合适的比例[7] 。为验证这种双相释放机制,故对溶出曲线相似性提出了较多要求。
1.2. 4 肠内营养管给药的体外试验研究
经肠内营养管给药,即通过肠内营养管(诸如鼻胃管、鼻十二指肠管、胃造口术管等)将药物直接输入胃肠道,这种剂型对无法吞咽口服剂型的患者十分重要。美国FDA已有相关指南供业界参考,如《Oral Drug Products Administered Via Enteral FeedingTube: In Vitro Testing and Labeling Recommendations》[8] 和《Use of Liquids and/or Soft Foods as Vehicles for Drug Administration: General Considerations for Selection and in vitroMethods for Product Quality Assessments Guidance for Industry》[9] 。
近几年,有些含有微丸或混悬颗粒的质子泵抑制剂类肠溶制剂说明书中增加了鼻胃管给药方式,对于不能吞咽的患者,可将药品溶于说明书规定的分散介质中,然后通过鼻胃管给药。如艾司奥美拉唑镁肠溶干混悬剂,其说明书中涉及鼻胃管给药,其给药方式如下:将1 包本品倒入带导管头的注射器中,并取水15 mL。迅速摇动注射器并等待2 ~3 min 使其变稠。摇晃注射器,在30 min 内通过连接鼻胃管或胃管注入胃中。将等量水(15 mL)加入注射器。摇晃并将剩余药物经鼻胃管或胃管冲洗至胃中。
美国也有较多个药指南针对肠内营养管给药的体外对比研究试验给出相关参考,关于美国FDA 批准的质子泵抑制剂类肠溶制剂涉及鼻胃管给药的产品体外试验对比研究情况[12 -17] 汇总见表2。为保证仿制制剂与参比制剂通过鼻胃管给药的质量和疗效一致,需根据风险评估制定合理的研究方案,提供详细的体外对比研究资料。
1. 3 稳定性研究
一般情况下,仿制制剂的贮藏条件可参照参比制剂拟定[18 -21] 。企业应根据拟定的贮藏条件设置合理的稳定性考察条件对产品的稳定性行为进行考察,稳定性考察中所用样品应至少在中试规模下生产,稳定性研究建议考察在贮藏过程中易发生变化的项目,涵盖物理、化学、微生物学特性等,所用分析方法应经过充分的验证,并能指示制剂的稳定性特征。稳定性
2 小结
本文仅以现有的审评经验及文献调研,对质子泵抑制剂类肠溶制剂的仿制开发提供建议,而在实际研究中仍需具体问题具体分析。
生物制品生产质量体系全流程建立及合规管理
质子泵抑制剂类肠溶制剂的仿制,首先需对参比制剂进行深入解析,在对参比制剂进行深入研究的基础上进行处方工艺开发,仿制制剂的释药机制通常应与参比制剂保持一致。随后结合产品的具体情况进行合理的质量研究,结合肠溶制剂特点增加针对性研究和控制,确保仿制制剂质量不低于参比制剂。
来源:中国新药杂志2024年第33卷第19期
免责声明:文章版权归原作者所有,转载本文仅为交流学习使用。如涉及作品内容、版权和其它问题,请与我们联系删除(yaoyanjun007)!文章内容仅代表作者个人观点,不代表本公众号赞同或支持其观点。
参考文献
免疫疗法
100 项与 Taiwan Global Angels 相关的药物交易
登录后查看更多信息
100 项与 Taiwan Global Angels 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2024年11月19日管线快照
无数据报导
登录后保持更新
药物交易
使用我们的药物交易数据加速您的研究。
登录
或

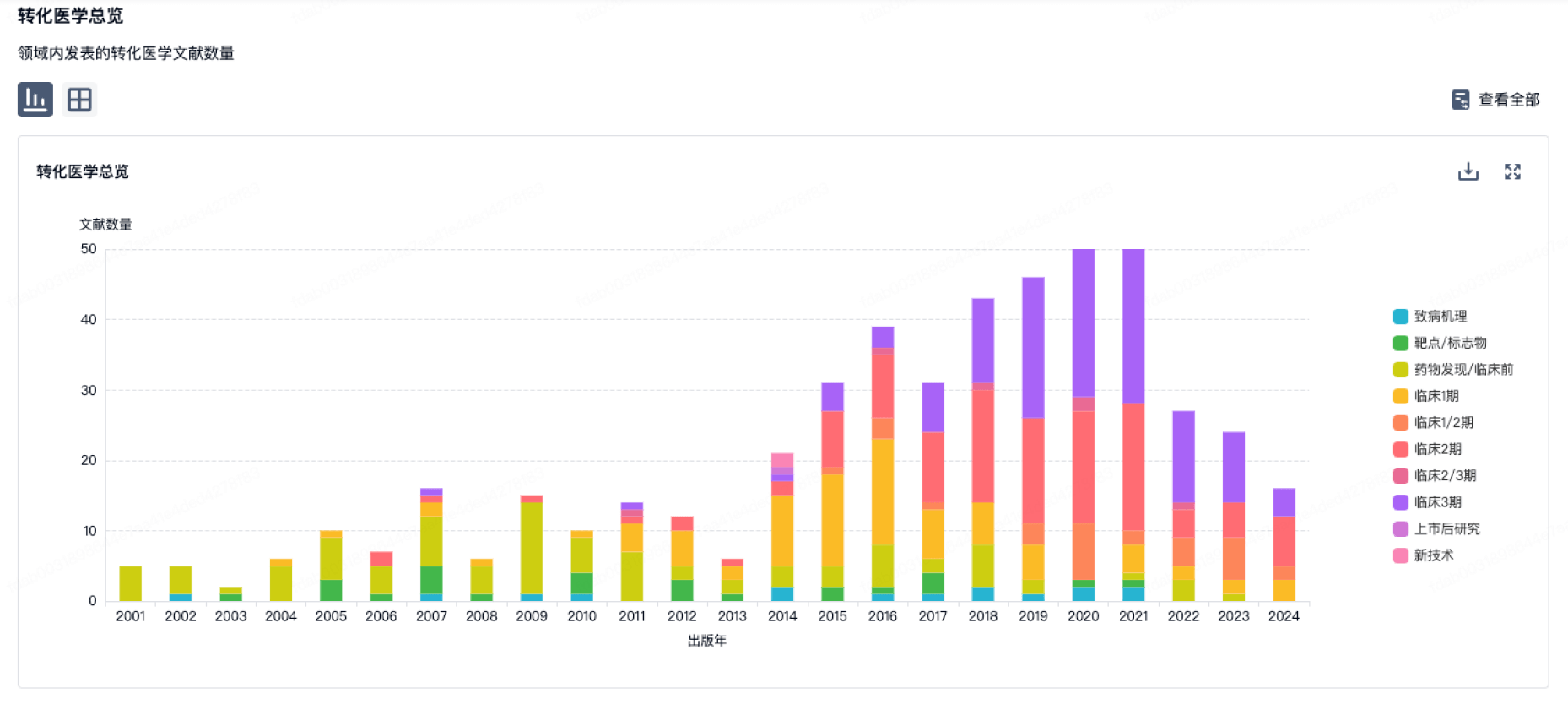
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
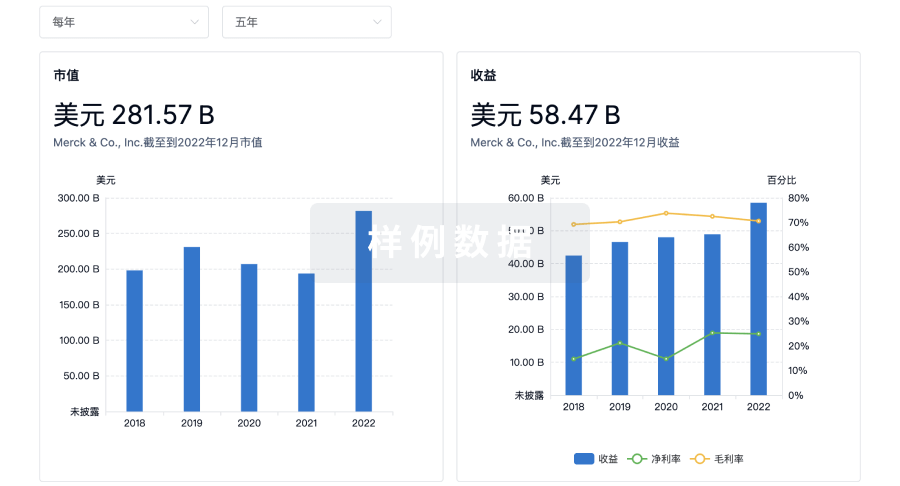
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或

投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或

融资
发掘融资趋势以验证和推进您的投资机会。
登录
或

标准版
¥16800
元/账号/年
新药情报库 | 省钱又好用!
立即使用
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用