预约演示
更新于:2025-05-07
济南平方生物科技有限公司
私营公司|2023|中国山东省
私营公司|2023|中国山东省
更新于:2025-05-07
概览
关联
100 项与 济南平方生物科技有限公司 相关的临床结果
登录后查看更多信息
0 项与 济南平方生物科技有限公司 相关的专利(医药)
登录后查看更多信息
4
项与 济南平方生物科技有限公司 相关的新闻(医药)2024-10-23
·药时代
2024 年 10 月 21 日,LENZ Therapeutics(LENZ)宣布,FDA已接受其老花眼新药LNZ100的NDA申请,PDUFA为2025年8月8日,也就是说这款药后有可能会在明年8月获批上市。LENZ新闻稿指出,FDA并不打算召开咨询委员会会议来讨论此申请。
LNZ100是全球首个也是唯一一个基于醋克利定的滴眼液,此前获批此适应症的大多为毛果芸香碱滴眼液。LNZ100的III期研究结果表明,有71%的受试者在使用药物后30分钟时视力就得到了有效改善。LENZ披露的更多信息显示,这款药仅需每日使用一次,对视力的改善作用可持续10个小时甚至以上,其获批将为饱受老花眼折磨的人群带来新的治疗选择。
另外,根据此前披露信息,箕星药业拥有这款药的大中华区独家开发及商业化许可权益。
临床数据极佳,获批迟早的事
2024年4月3日,LENZ公布了其III期CLARITY研究的积极顶线结果。数据显示,71%接受LNZ100治疗的受试者的视力在3小时时实现三线或更大的改善,研究达到主要终点。
CLARITY研究由两项为期六周的疗效试验 CLARITY 1 (载体对照)和 CLARITY 2(溴莫尼定对照)及一项为期六个月的安全性试验 CLARITY 3 组成,主要是考察候选药物LNZ100(1.75% 醋克利定) 和 LNZ101(醋克利定+溴莫尼定) 治疗老花眼疗效和安全性。研究共招募了1059名受试者,这些受试者年龄在45~75岁之间,屈光范围为 -4.0D SE 至 +1.0D SE,一部分受试者曾接受过激光矫正视力手术/人工晶体植入手术。
其中,聚焦考察疗效的CLARITY 1 和 CLARITY 2 研究的主要终点为接受治疗后的3小时内BCDVA改善三行或以上而不损失一行的受试者比例。
研究结果显示,主要候选药物LNZ100达到所有主要终点和次要终点,并具有以下几点优势:
1)起效快:CLARITY 1研究中,30 分钟时有72%的受试者实现了三行视力改善,83%的受试者实现了两行视力改善;在CLARITY 2研究中,有71%的受试者实现了三行视力改善,91%的受试者实现了两行视力改善.
2)持续时间长:CLARITY 1研究中, 10 小时时有27%的受试者实现了三行或更好视力改善,61%的受试者实现了两行或更好视力改善;在CLARITY 2研究中, 10 小时时有40%的受试者实现了三行或更好视力改善,69%的受试者实现了两行或更好视力改善。
3)3小时主要终点数据佳:CLARITY 1研究中,3小时有64%的受试者实现了三行或更好视力改善,83%的受试者实现了两行或更好视力改善;在CLARITY 2研究中,3小时有71%的受试者实现了三行或更好视力改善,91%的受试者实现了两行或更好视力改善。
另外,在 CLARITY 2 中,几乎所有接受 LNZ100 治疗的受试者(95%) 在治疗后 1 小时都实现了具有临床意义的两行或更大视力改善 (p<0.0001)。LNZ100 还显示正常光线下远视力改善 2-4 个字母具有统计学意义 (p<0.0001),并且在所有时间点对弱光下的远视力没有负面影响。
值得注意的是,在CLARITY 研究中,并未观察到与治疗相关的严重不良事件。
销售额起码30亿!
在今年的公开演讲活动中,LENZ曾表示,LNZ100是具有30亿美元销售额潜力的大单品。并指出,这一销售数值仅考虑了美国本土的销售情况,其他国家和地区有望带来在更多增长空间。
值得注意的是,老花眼人群对这款药的使用意愿极高。LENZ信息显示,在CLARITY研究的第28天,223 名接受 LNZ100 的受试者接受了他们的跟踪调查。其中,90% 的受试者表示他们注意到近视力有所改善,75% 的受试者表示他们希望在研究后继续使用这款药,另有81%的受试者表示他们预计每周使用4-7天。
目前,箕星药业拥有这款药的大中华区的开发及商业化权益。2022年4月,LENZ与箕星药业就LNZ100和LNZ101签订独家许可协议,交易金额最高达1.1亿美元(1500 万美元预付款+高达 9500 万美元的额外付款)。一年多以后(2023年8月),箕星药业将两款产品成功推入III期临床阶段。如若国内正在进行的这项临床研究也如此顺利的话,那么这款药在国内获批上市也将指日可待。
小结
LNZ100的主要有效成分为醋克利定,这是一种小分子乙酰胆碱酯酶受体激动剂,可引起瞳孔缩小,从而产生改善近视力的针孔效应。研究表明,醋克利定的作用机制非常理想,既可以产生缩瞳效应,又避免了近视漂移,故能够被潜在用于广泛的患者群体。
《2023中国老花眼人群洞察报告》曾指出,老花通常在38岁左右出现,高峰在42-44岁,52岁以上人群老花眼的发病率接近100%。调查数据显示,我国35岁以上的人口中,有老花眼问题人群占比56.9%,达3.9亿人。但目前老花眼的矫治选择并不多,最常见的就是佩戴老花镜或角膜接触镜,但这已经无法满足大多数人的工作生活需求。
参考资料:
1.LENZ Therapeutics 和箕星宣布达成大中华区独家许可协议-美通社PR-Newswire
2.各公司官网
3.其他公开资料
封面图来源:pixabay
版权声明/免责声明
本文为原创文章。
本文仅作信息交流之目的,不提供任何商用、医用、投资用建议。
文中图片、视频、字体、音乐等素材或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络,部分素材根据CC0协议使用,版权归拥有者,药时代尽力注明来源。
如有任何问题,请与我们联系。
衷心感谢!
药时代官方网站:www.drugtimes.cn
联系方式:
电话:13651980212
微信:27674131
邮箱:contact@drugtimes.cn
重要新政!生物制品分段生产试点工作启动
GSK “状告” Moderna
喜讯频传!1天3家,礼新、若弋、平方和官宣融资成功!百裕制药成功出海!雅本化学新研发大楼启用典礼圆满举行
点击查看更多精彩!
临床结果临床3期
2024-10-22
·药时代
2024年10月22日,金斯瑞生物发布内幕消息,宣布因存托协议发生变更,公司决定解除与传奇生物的合并,并将其重新分类为联营公司。
金斯瑞表示,根据2020年6月5日签订的先前存托协议,任何未能按时提供投票指示的美国存托凭证持有人,将自动授权存管人向传奇生物指定的代表转让投票权。
然而,2024年10月18日(纽约时间),传奇生物与存管人签订了一份协议书,正式终止了全权委托权制度。此变更意味着存管人将不再有权授予全权委托权。
截至2024年9月30日,金斯瑞持有传奇生物约47.56%的股份。鉴于传奇生物在2024年10月21日(纽约时间)举行的股东大会上,高达95.7%的股东参与了投票,金斯瑞董事会认定公司已丧失在股东大会上投出多数票的能力,因此决定解除与传奇生物的合并。
发布公告称,由于近期存托协议的变更,公司已决定解除与传奇生物的合并,并将传奇生物视为联营公司进行投资处理。
根据香港财务报告准则第10号的要求,自2024年10月18日起,传奇生物的资产和负债将不再被计入金斯瑞的合并财务报表,而金斯瑞持有的传奇生物投资将以公允价值计量,并确认因丧失控股权而产生的损益。
解除合并后,金斯瑞将采用权益法对传奇生物的投资进行会计处理。预计金斯瑞将确认一笔一次性免税收益,反映其在解除合并时传奇生物公允市场价值与其净资产份额之间的差异。未来,金斯瑞将根据传奇生物的业绩确认相应的损益份额,并对可识别无形资产进行摊销调整。
金斯瑞董事会认为,解除合并后的财务报表将更公正地反映公司截至2024年12月31日止年度的整体业绩。目前,公司正在量化解除合并对财务的具体影响,并计划在2024年度报告中披露详细情况。
封面图来源:123rf
版权声明/免责声明
本文为原创文章。
本文仅作信息交流之目的,不提供任何商用、医用、投资用建议。
文中图片、视频、字体、音乐等素材或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络,部分素材根据CC0协议使用,版权归拥有者,药时代尽力注明来源。
如有任何问题,请与我们联系。
衷心感谢!
药时代官方网站:www.drugtimes.cn
联系方式:
电话:13651980212
微信:27674131
邮箱:contact@drugtimes.cn
GSK “状告” Moderna
喜讯频传!1天3家,礼新、若弋、平方和官宣融资成功!百裕制药成功出海!雅本化学新研发大楼启用典礼圆满举行
三期临床失败后,吉利德决定自愿撤回适应症
点击查看更多精彩!
临床3期引进/卖出
2024-10-21
·药时代
氧化还原稳态的失衡是各种人类疾病的根源之一,特别是ROS(活性氧)水平的异常升高,被证实对肿瘤的发生与发展具有关键推动作用。鉴于此,科学家们将通过调节ROS及其复杂的调控网络作为抗癌治疗的新策略。近期,该领域取得了突破性进展,不仅揭示了新氧化还原信号通路,还发现了生物分子相分离现象在ROS调控中的独特作用。本文将重点讨论靶向ROS的癌症治疗策略与药物,并对未来研究方向进行展望。
01
ROS的基本概念和生成
ROS指生物体内由氧分子直接或间接转化而来的具有高度化学活性的含氧物质,包括超氧阴离子、过氧化氢、羟自由基等。它们广泛存在于生物体内,在调节生物过程成发挥重要作用。
ROS在生物体内的生成途径主要包括线粒体呼吸链、酶促反应(如NADPH氧化酶能催化生成ROS)、外源性因素(如紫外线辐射、化学物质)等方面。为了维持生物体内的氧化还原稳态,细胞通过抗氧化酶系统(超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)等催化ROS的分解和清除)、非酶抗氧化剂(非酶抗氧化剂:如维生素C、维生素E、谷胱甘肽(GSH)等能与ROS反应并中和其活性)等机制来控制和调节ROS的水平[1]。
02
ROS介导的信号传导
翻译后修饰(PTMs)是ROS调节细胞信号传导的主要机制,ROS通过修饰氧化还原敏感残基影响其目标蛋白的功能。ROS直接介导半胱氨酸硫醇基和蛋氨酸硫残基的氧化修饰,进而影响蛋白质的结构和稳定性、蛋白质之间的相互作用、亚细胞定位等,导致其各自功能的改变。这些变化可以影响组蛋白和DNA的表观遗传修饰,从而影响转录过程。ROS通过PTMs调节对氧化还原敏感的转录因子进而影响mRNA和非编码RNA(ncRNA)的转录[2]。
图1 ROS介导的信号传递过程
03
靶向ROS的癌症治疗策略
在癌症中靶向ROS能够实现对肿瘤细胞的选择性治疗,且对正常细胞的毒性相对较低。根据作用机制,靶向ROS的癌症治疗策略可分为两类:靶向ROS生成机制和靶向氧化还原适应机制[3]。
图2 靶向癌症中ROS的治疗策略
04
靶向ROS生成机制
癌细胞由于其异常的代谢活动和遗传背景,往往处于较高的氧化应激状态,即细胞内ROS水平相对较高。这种内在的ROS应激是癌细胞生物学特性的一部分,与它们的增殖、生存和耐药性密切相关。当针对癌细胞中的ROS生成机制进行靶向治疗时通过增加细胞内的ROS水平,加剧氧化应激,对细胞内的DNA、蛋白质和脂质等生物分子造成广泛损伤,当这种损伤达到一定程度时,会触发癌细胞的凋亡或坏死机制,导致不可逆的细胞损伤和死亡,或者通过减少ROS水平使其降低到不足以支持癌细胞的正常增殖。
多种药物和化合物可以通过上调ROS产生酶(如NOX5)的活性来增加ROS的生成。例如,多靶点酪氨酸激酶抑制剂安罗替尼(anlotinib)能够在体外诱导鳞状细胞癌细胞中的O2•−生成和凋亡。一些氧化还原调节剂能够在癌细胞中作为促氧化剂,促进ROS的生成,而在正常组织中则作为抗氧化剂,保护组织免受氧化应激的损害,这种选择性作用机制使得它们在癌症治疗中具有潜在的应用价值。NADPH氧化酶(NOX)是一种能够催化生成ROS的酶,在癌症中某些致癌转化,如RAS基因驱动的NOX表达上调,会导致ROS的生成增加。ROS的过量生成与多种癌症的恶性进展有关。GKT831是一种有效的双NADPH氧化酶(NOX)抑制剂,主要针对NOX1和NOX4亚型,GKT831能够抑制ROS的生成,并使肿瘤细胞对辐射更加敏感。
05
靶向氧化还原适应机制
野生型p53在ROS应激下被激活,导致细胞周期停滞或凋亡,这是一种防止细胞损伤和癌变的重要机制。而某些p53突变后则能在应激条件下促进细胞存活,这也是癌细胞逃避凋亡的一种策略。突变型p53通过上调ROS清除系统(如NRF2介导的途径)和激活抗凋亡信号(如NF-κB)来适应ROS应激。抑制内源性抗氧化剂或其上游调控分子成为破坏p53突变细胞氧化还原适应机制的手段。
表1 靶向癌症中活性氧(ROS)并具有治疗潜力的新药物
06
结语
针对癌症中的活性氧(ROS)进行靶向治疗是一项充满前景的治疗策略,它带来了新机遇与挑战。ROS应激下的免疫反应对癌症具有双刃剑作用,既能通过细胞毒性免疫细胞抑制肿瘤生长,也能通过免疫抑制细胞促进癌细胞增殖。ROS与炎症细胞因子相互刺激,放大炎症信号,影响肿瘤生长或导致系统性代谢异常。未来研究应综合考虑癌细胞和免疫系统,基于患者的癌症阶段、ROS应激和免疫功能,实现抗氧化剂和氧化还原调节的个性化治疗。
Ref.
[1] Wu K, El Zowalaty AE, Sayin VI, Papagiannakopoulos T. The pleiotropic functions of reactive oxygen species in cancer. Nat Cancer. 2024 Mar;5(3):384-399.
[2] An X, Yu W, Liu J, Tang D, Yang L, Chen X. Oxidative cell death in cancer: mechanisms and therapeutic opportunities. Cell Death Dis. 2024 Aug 1;15(8):556.
[3] Glorieux C, Liu S, Trachootham D, Huang P. Targeting ROS in cancer: rationale and strategies. Nat Rev Drug Discov. 2024 Aug;23(8):583-606.
封面图来源:123rf
版权声明/免责声明
本文为授权转载文章。
本文仅作信息交流之目的,不提供任何商用、医用、投资用建议。
文中图片、视频、字体、音乐等素材或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络,部分素材根据CC0协议使用,版权归拥有者,药时代尽力注明来源。
如有任何问题,请与我们联系。
衷心感谢!
药时代官方网站:www.drugtimes.cn
联系方式:
电话:13651980212
微信:27674131
邮箱:contact@drugtimes.cn
喜讯频传!1天3家,礼新、若弋、平方和官宣融资成功!百裕制药成功出海!雅本化学新研发大楼启用典礼圆满举行
三期临床失败后,吉利德决定自愿撤回适应症
“创新是金,赛出新高”——金赛药业2024首届研发日圆满落幕
点击查看更多精彩!
信使RNA
100 项与 济南平方生物科技有限公司 相关的药物交易
登录后查看更多信息
100 项与 济南平方生物科技有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年06月24日管线快照
无数据报导
登录后保持更新
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
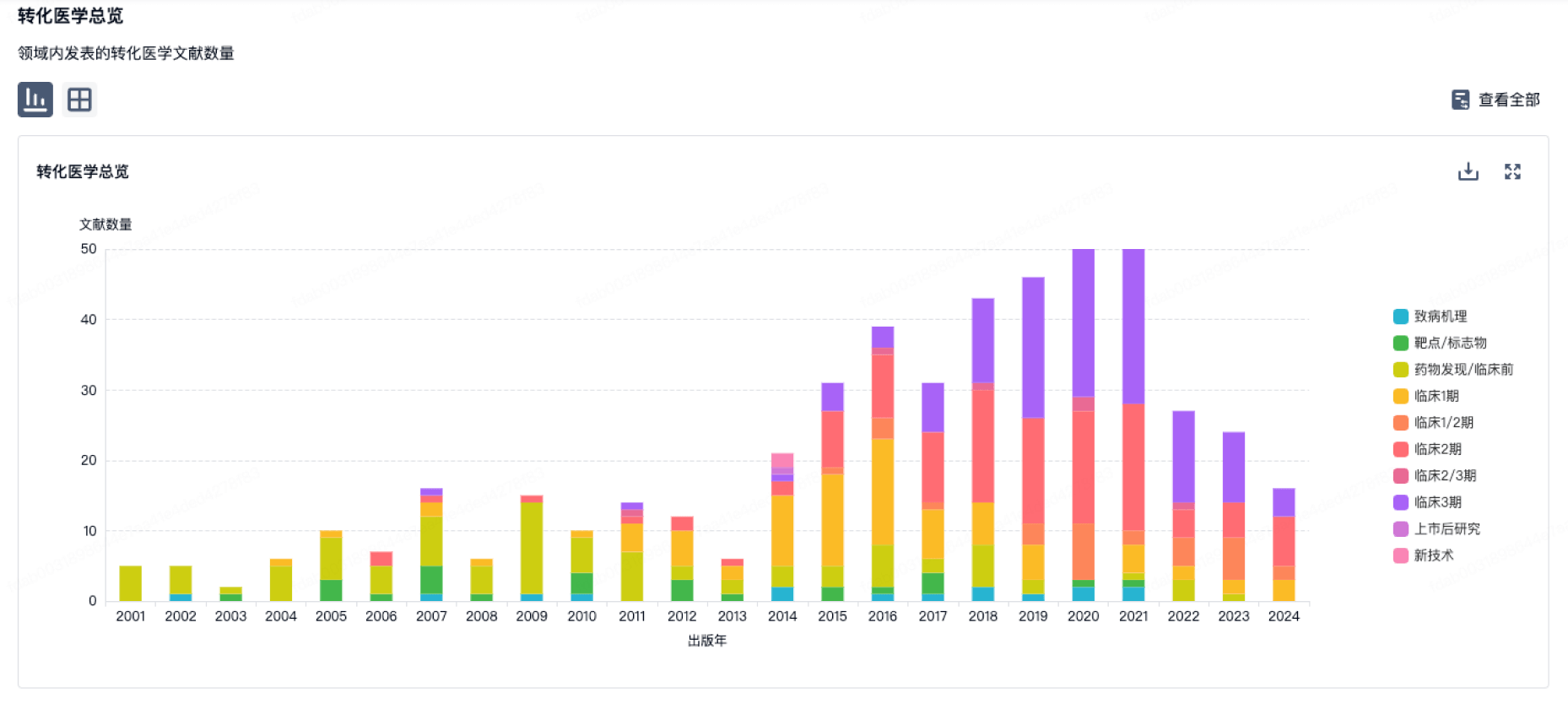
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用