更新于:2024-11-01
Changsha Dingxiangyuan Biotechnology Co., Ltd.
私营公司|
2014|
中国湖南省
私营公司|
2014|
中国湖南省
更新于:2024-11-01
概览
关联
100 项与 Changsha Dingxiangyuan Biotechnology Co., Ltd. 相关的临床结果
登录后查看更多信息
0 项与 Changsha Dingxiangyuan Biotechnology Co., Ltd. 相关的专利(医药)
登录后查看更多信息
76
项与 Changsha Dingxiangyuan Biotechnology Co., Ltd. 相关的新闻(医药)2024-10-31
海量靶点中如何寻找准确的临床应用适应症?
竞争激烈的热门疾病中,如何寻找未满足的临床需求,挖掘差异化的赛道?
实际患者的新药研发的风险获益如何?
Insight 数据库「临床 PI 谈新药」栏目,带您走近新药研发的临床真相。
栏目将从靶点出发,选择 KRAS、HER2、TROP2 等热门靶点形成系列,分享对应靶点主要癌种领域的创新药研发进展与展望。
点击文末「阅读原文」可查看往期回放
系列一选择「KRAS」靶点的胰腺癌、结直肠癌、非小细胞肺癌三个领域。第二期邀请到了北京大学肿瘤医院消化内科主任医师 周军教授进行分享。
直播时间
2024 年 11 月 6 日(周三)下午 14:00-14:40
直播内容
1)KRAS 突变胰腺癌的治疗现状与未满足的临床需求;
2)KRAS 突变胰腺癌的新药研发进展;
3)胰腺癌领域相关问题答疑;
下期预告
上海市肺科医院 苏春霞教授:分享 KRAS 突变的非小细胞肺癌创新药研发进展与展望。(直播时间:待定)
湖南省肿瘤医院 谢宁教授:分享 HER2 阳性乳腺癌的创新药研发进展与展望。(直播时间:待定)
西安交通大学第一附属医院 吴胤瑛教授:分享 HER2 阳性胆管癌的创新药研发进展与展望。(直播时间:待定)
系列主题抢先知
系列主题一:热门靶点 KRAS 在主要肿瘤治疗的新药临床进展分析与展望
系列主题二:热门靶点 HER2 在主要肿瘤治疗的新药临床进展分析与展望
系列主题三:热门靶点 TROP2 在主要肿瘤治疗的新药临床进展分析与展望
待续……
更多商务合作
吴经理:13456807798(微信同号)
添加小音
第一时间获取最新讲堂直播信息
(朋友圈每日更新热门资讯、行研报告、行业盘点等)
丁香园 Insight 数据库
丁香园 Insight 数据库作为真实可溯源的全球医药数据情报分析平台,专注于医药行业 18 年,追踪国内外 30000+ 信源,整合药品从临床前到上市后的全生命周期情报数据,为药企、投资公司、CRO 等国内外 3000+ 家企业提供数据情报服务,助力企业决策更精准,工作更高效。
基于「AI+分析师」的专业能力,打造了全球新药情报、企业分析、上市策略分析、临床策略分析、靶点分析、准入分析等特色模块,为企业提供药品调研、企业分析、竞争格局分析、临床策略分析等场景解决方案。
数据准确
覆盖 3w+ 国内外药监、企业官网、新闻、文献、会议等不同渠道的可信数据源,核心数据源 24h 更新。全职数据分析团队,均拥有医药相关从业经验,人工二次判断保证数据准确。
功能好用
根据不同类型客户使用数据库的需求,拥有超过 600 个业内最丰富的筛选条件以及可视化图表、在线分析功能,解决不同工作场景下的数据检索与分析需求。首创时光轴功能,助力用户通过可视化方式,快速获得想要了解的关键信息。
服务专业
专属项目经理,一对一支持,均具备专业背景,深刻了解客户需求。服务药企、投资公司、CRO 等各类型企业,不仅经验丰富,还响应速度快、反馈及时。
临床1期临床2期
2024-10-27
·赛柏蓝
作者 | 陈芋
来源 | 赛柏蓝
有企业代表谈判后复盘:价格“差得远得很”。
01
“天花板就在那儿呢”
10月27日,2024年国家医保谈判在北京全国人大会议中心正式开始,会场门口人头攒动,有企业表示“明天才谈但提前来踩踩点、看看氛围”。
今年共162个通用名药品将参加谈判/竞价,谈判由全国各地遴选的25名医保部门的谈判专家分成5个小组进行,一直持续至10月30日,最终结果拟于11月公布。
据悉,首日谈判品种涉及抗病毒、麻醉镇痛、降压等领域,恒瑞、默沙东、康缘、正大天晴、人福、海思科、信立泰、第一三共、百特等企业入场。现场企业透露,其旗下的中药品种将在10月29日展开谈判。
赛柏蓝10月27日摄于全国人大会议中心
有企业代表在场外表示希望能“往上谈一谈,整体不要压太低”,同行的企业代表则直言“天花板就在那儿呢”。
近年来,业内普遍认为国谈有着“50万不谈,30万不进”的“隐形天花板”,不少药企从业者期待这一天花板能上提,但有专家认为,在医保基金有限的背景下,“天花板”短期内可能不会改变。
另外,“115%”和“信封价”成为入局企业报价的关键。
根据以往规则,现场谈判由企业报价,一般会有两次机会报价并确认。如果企业方第二次确认后的价格高于医保方谈判底价的115%(不含),谈判将直接终止;低于115%则进入磋商环节,最终双方达成不高于医保局信封价的价格则代表谈判成功。
有企业代表回忆起初次参与谈判的场景——由于对规则不够熟悉等原因,确认后价格超出医保局上限,当时“急了,把门关着还想(跟医保局)再聊”。
今年是国家医保局成立以来连续第7年对医保药品目录进行调整,现场不少代表透露“我们(企业规模)小,这次全员出动”“(谈的是)我们今年最重磅的品种”,尽管态度上同样重视,但谈判结束后能看出各家企业心态不尽相同。
有多次参与现场谈判的企业代表在入场前轻松地提到:“我不紧张,我们没什么压力”,谈判结束后也面露喜色,表示“挺好,挺好”。
与此同时,还有企业谈判结果不及预期。国谈首个上午,有企业代表超过12点才面色凝重地走出会场,走出不远后又停在人行道上复盘方才的谈判过程,站在寒风中一边翻阅材料一边表示价格“差得远得很”,并开始为下一次谈判总结经验与教训。
02
今年更强调高质量、高性价比的创新
从去年开始,医保部门在药物评审中新引入了药品分类方法,基于临床价值分为突破性疗法、改良型新药、药效相当、不及性药物4种。此次国谈对临床数据、试验数据等的真实可靠性要求更加严格,也意味着对创新药进目录门槛更高。
据丁香园Insight数据库,今年249个目录外药品通过了形式审查,162个品种参与谈判竞价,专家审评环节通过率不足50%,与2022年74.2%、2023年63.8%的通过率相比出现明显下降。
本轮国谈中,CAR-T、PD-1、三代EGFR-TKI、自免、ADC药物等均是业内关注重点。
162个参与品种中涉及多款首次上场的肿瘤高值创新药及罕见病新药,例如康方生物的卡度尼利单抗、依沃西单抗均是首次出现在初审名单中,两款药物分别于2022年6月、2024年5月获批,均为全球首创双抗。
此外,海思科的克利加巴林、泽璟生物的重组人凝血酶、京新药业的地达西尼、迪哲医药的舒沃替尼和戈利昔替尼等也都是首次“开谈”。
西南证券指出,在此前8轮针对创新药的医保药品谈判中,首次入选的创新药品平均降幅基本都在40%至62%之间,绝大多数创新药进入医保之后实现了以价换量,销售额大幅增长。
以国产PD-1抗肿瘤药物信迪利单抗为例,其于2019年被纳入医保,2020年销售额实现954%的增长,达到2.73亿元;进口特应性皮炎新药度普利尤单抗注射液于2020年纳入医保,次年销售额实现47486.2%的增长。
现场谈判正式启动前,国家医保局已组织基金测算、药物经济学测算,并与通过专家评审的企业进行了预谈判等。有创新药企负责人曾表示:“从前期沟通来看,今年医保目录调整规则跟去年基本相同,估计整体基调不会有太大变化,但今年更强调高质量、高性价比的创新。”
END
内容沟通:郑瑶(13810174402)
左下角「关注账号」,右下角「在看」,防止失联
一致性评价带量采购
2024-10-27
据 Insight 数据库统计,本周(10 月 20 日—10 月 26 日)全球共有 74 款创新药(含改良新)研发进度推进到了新阶段,其中 1 款申报上市,25 款启动临床,15 款获批临床,15 款申报临床。
值得一提的是,对国内创新药企们而言,本周最值得关注的正是每年一度的医保谈判开场。今年的谈判日在 10 月 27 日(今天)至 30 日(下周三),11 月即将公布结果,比往年节奏快些。Insight 也就此密切跟进,读者们可点击跳转阅读以下新鲜报道:
2024 医保谈判首日,这 3 类药物值得关注!丁香园直击现场
2024 国谈专家审评通过率仅 41%?这些重磅品种有望参加「灵魂谈判」
2024 年医保谈判拟于 10 月 27 日开始,11 月份公布结果
下文,Insight 仍将分别摘取本周国内外部分重点项目进展做介绍。
境外创新药进展
境外部分,本周共有 17 款药物研发阶段推进,包括 1 款首次启动 III 期临床、5 款首次启动 I 期临床、5 款首次获批临床。
Insight 新药周报将介绍重点项目的审评审批进展、临床试验进展和审评通道进展。全球医药交易及投融资周报可点击链接跳转阅读周六专栏。
获批上市
据 Insight 数据库显示,本周共有 5 项新药/新适应症在全球主要国家/地区(中国内地、美国、日本、EMA)获批上市。数据详见下图:
截图来自:Insight 数据库网页版
1、辉瑞:RSV 疫苗获批扩大适应症,可用于 18-59 岁人群
10 月 22 日,辉瑞宣布,FDA 已批准其 RSV 疫苗 ABRYSVO® 用于 18 至 59 岁高风险成人以预防 RSV 病毒造成的下呼吸道疾病。这是首个获批用于此人群的 RSV 疫苗。
此前,ABRYSVO 已经获批用于 60 岁以上人群,且是唯一获批用于 32 - 36 周孕妇以预防出生至 6 个月内新生儿的 RSV 感染风险,本次适用人群再获拓展,意味着这款疫苗将在 RSV 市场中夺得更多份额。
截图来自:PR Newswire
FDA 的批准是基于关键 3 期临床试验 MONeT(NCT05842967)的结果,相应数据将发布于同行评议的期刊之上,并将在未来的医学会议中公布。
辉瑞此款疫苗最初获批于 2023 年 5 月,并在同年 8 月获批用于孕妇。GSK 开发的 RSVPreF3 疫苗(Arexvy/GSK 3844766A)与辉瑞同月获批,成为主要竞争对手;而 Moderna 的 RSV 疫苗也紧随两者之后。这三款 RSV 疫苗在技术路线、抗原选择、佐剂、适应人群和保护效力等方面均存在显著差异。
对比来看,GSK 和辉瑞的 RSV 疫苗均采用重组蛋白亚单位技术路线,而 Moderna 采用了其擅长的 mRNA 技术,其中辉瑞使用的是双价抗原(来自 RSV A 与 RSV B 病毒亚型的 Pre-F 蛋白),另两者均选择以 DS-Cav1 为基础的 Pre-F 抗原。
此外,辉瑞和 Moderna 的 RSV 疫苗均未使用佐剂,而 GSK 使用了自主研发的 AS01e 佐剂,增加了体液免疫和细胞免疫这一优势。
根据 WHO 估计,全球每年有约 3300 万-6000 万的儿童感染 RSV,以及大约 3%-7% 的 60 岁以上老年人会受到 RSV 感染。据分析师预测,RSV 疫苗的市场规模预计到 2030 年会增长到 100 亿美元以上,接近 13 价肺炎疫苗的市场空间。
2、Iterum Therapeutics:首款口服培南类抗生素获美国 FDA 批准
10 月 25 日,Iterum 公司宣布,ORLYNVAH™ (sulopenem etzadroxil/probenecid) 已获美国 FDA 批准上市,用于治疗由指定微生物(大肠杆菌、肺炎克雷伯菌或奇异变形杆菌)引起的、没有或几乎没有可替代口服抗菌治疗方案的无并发症尿路感染(uUTIs)成年女性。
这是这家公司获批的首款新药,也是 FDA 批准的首款口服培南类抗生素。
截图来自:Globe Newswire
FDA 的批准是基于两项关键 3 期临床试验 SURE 1 和 REASSURE,其中 SURE 1 评估了 ORLYNVAH™ 相较于环丙沙星在成年女性 uUTI 中的疗效,而 REASSURE 则评估了该药相较于阿莫西林克拉维酸钾(Augmentin)的疗效。
结果显示,Orlynvah 在对抗氟喹诺酮耐药性感染方面优于活性对照药物,且在对阿莫西林克拉维酸钾敏感的人群中与活性对照药物相比非劣,并在统计学上具有显著优势。
申报上市
1、老花眼新药 NDA 申请获 FDA 受理,国内箕星药业引进
10 月 22 日,箕星合作伙伴 LENZ Therapeutics 宣布,FDA 已受理该公司用于治疗老视的 LNZ100 的新药申请(NDA)。PDUFA 目标行动日期为 2025 年 8 月 8 日。
截图来源:企业官微
此次 NDA 提交是基于关键 III 期临床研究 CLARIFY 的积极数据结果。
在 III 期安全性和有效性试验(CLARITY 1 和 2)中,LNZ100(1.75% 乙酰克利定)达到了主要终点和关键次要终点,近距离最佳矫正视力 (BCDVA) 显著提高三行或更多,同时远距离视力没有下降一行或更多。在 CLARITY 2 中,临床结果显示患者视力快速改善且持久:
起效迅速:71% 的患者在 30 分钟内视力改善≥3 行。
达到主要终点:71% 的患者在 3 小时内视力改善≥3 行。
持续时间长:40%的患者视力改善≥3 行可以持续 10 小时。
在为期四周的研究期间,CLARITY 1 和 2 的近视力改善具有可重复性且一致性。
2022 年 4 月 14 日,箕星药业获得了 LENZ Therapeutics 公司旗下两款用于治疗老花眼药物 LNZ100 和 LNZ101 在大中华地区(包括中国大陆、香港、澳门和台湾)的商业化权利。据 Insight 数据库显示,目前该药在中国正处于III 期临床阶段。
其他重要监管资讯
1、阿斯利康/Ionis:每月一次反义寡核苷酸疗获欧盟 CHMP 推荐批准
10 月 21 日,阿斯利康和 Ionis 宣布 Wainzua (Eplontersen) 已获得欧盟人用药品委员会 (CHMP) 的推荐批准,用于治疗患有 1 期或 2 期多发性神经病(通常称为 hATTR-PN 或 ATTRv-PN)的成人患者的遗传性转甲状腺素蛋白介导的淀粉样变性。
新闻稿指出,如果获得欧盟委员会批准,Eplontersen 将成为欧盟唯一获批的治疗 ATTRv-PN 的药物,患者可通过自动注射器每月自行注射。
截图来源:阿斯利康官网
转甲状腺素介导的淀粉样变性 (ATTR) 是由肝脏来源的错误折叠 TTR 蛋白在心脏和周围神经等组织中积累引起的,导致器官损伤和衰竭。ATTR 有遗传性 (ATTRv) 和非遗传性 (野生型) 两种形式,在诊断后五年内会导致周围神经损伤和运动障碍,如果不进行治疗,通常会在十年内致命。
Eplontersen 是 Ionis 公司开发的一种反义寡核苷酸 (ASO) 疗法,可抑制 TTR 的产生,每月注射一次。它是一种 RNA 靶向药物,旨在减少肝脏中 TTR 蛋白的产生,从而有潜力治疗所有类型的 ATTR。
此前,Eplontersen 已于去年 12 月获美国 FDA 批准上市,用于治疗 ATTRv-PN。今年 9 月,Eplontersen 也已在中国申报上市,根据该药在中国的研究进度,推测其在中国申报的适应症可能为:适用于转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)成人患者。
本次 CHMP 的批准意见是基于积极的 NEURO-TTRansform III 期试验。该试验数据表明,与安慰剂相比,在 66 周内,接受 Eplontersen 治疗的患者在血清转甲状腺素蛋白 (TTR) 浓度和神经病变损伤的共同主要终点以及生活质量 (QoL) 的关键次要终点方面,表现出一致和持续的益处在。此外,在整个 NEURO-TTRansform 试验中,Eplontersen 继续表现出良好的安全性和耐受性。
2021 年,Ionis 公司和阿斯利康达成合作,双方在美国联合开发和商业化 Eplontersen,并授予阿斯利康在拉丁美洲以外的世界其他地区开发和商业化该药物,该合作总金额超 35 亿美元。2023 年 7 月,双方再次扩大合作,阿斯利康又获得了在拉丁美洲商业化 Eplontersen 的独家权利,此项合作总金额也超过 36 亿美元。
2、百济神州:PD-1 抑制剂获欧盟 CHMP 推荐批准,一线治疗胃癌和食管鳞癌
10 月 21 日,百济神州宣布欧洲药品管理局(EMA)人用药品委员会(CHMP)发布积极意见,推荐批准扩大 PD-1 抑制剂百泽安®(替雷利珠单抗)用于胃或胃食管结合部(G/GEJ)腺癌和食管鳞状细胞癌(ESCC)患者治疗的适应症。
对于 G/GEJ 腺癌患者,CHMP 的积极意见支持百泽安®联合含铂和含氟嘧啶类化疗用于 PD-L1 肿瘤面积阳性(TAP)评分 ≥5% 的 HER-2 阴性、局部晚期、不可切除或转移性 G/GEJ 癌症成年患者一线治疗。对于 ESCC 患者,CHMP 的积极意见支持百泽安®联合含铂化疗用于 PD-L1 TAP 评分 ≥5% 的 HER-2 阴性、局部晚期或转移性 ESCC 成年患者一线治疗。
替雷利珠单抗目前已经在欧盟获批用于治疗符合条件的、既往接受过含铂化疗的晚期或转移性 ESCC 患者,以及用于三项非小细胞肺癌(NSCLC)适应症的一线和二线治疗。
本次拟扩大适应症,主要基于 RATIONALE-305 和 RATIONALE-306 的临床结果:
一线 G/GEJ 适应症扩展申请基于百济神州 RATIONALE-305(NCT03777657)研究结果,该研究是一项随机、双盲、安慰剂对照的全球 3 期试验,旨在评价替雷利珠单抗联合化疗用于晚期不可切除或转移性 G/GEJ 患者一线治疗的有效性和安全性。
该研究在欧洲、北美和亚太地区的研究中心入组了 997 例患者。结果显示,接受百泽安®联合研究者选择的化疗的患者中位 OS 为 15.0 个月,而接受安慰剂联合化疗的患者中位 OS 为 12.9 个月(n=997;HR:0.80 [95% CI:0.70,0.92];P=0.0011),表明死亡风险降低了 20%。在 PD-L1≥5% 的人群中,百泽安®联合化疗组中位 OS 为 16.4 个月,而安慰剂组中位 OS 为 12.8 个月(HR:0.71[95% CI:0.58 ~ 0.86]),表明死亡风险降低了 29%。
一线 ESCC 适应症扩展申请基于百济神州 RATIONALE-306(NCT03783442)研究结果,该研究是一项随机、安慰剂对照、双盲的全球 3 期研究,旨在评价替雷利珠单抗联合化疗用于不可切除、局部晚期复发或转移性 ESCC 患者一线治疗的有效性和安全性。
该研究在欧洲、北美和亚太地区的研究中心入组了 649 例患者。结果显示,百泽安®联合化疗组中位 OS 为 17.2 个月,而安慰剂联合化疗组中位 OS 为 10.6 个月(HR:0.66 [95% CI:0.54 ~ 0.80,单侧 p 值< 0.0001]),表明死亡风险降低了 34%。PD-L1≥5% 的患者群体中,百泽安®组 3 年 OS 也得到显著改善(中位 OS 为 19.1 个月 vs. 10.0 个月;HR:0.62[95% CI:0.49 ~ 0.79]),表明死亡风险降低了 38%。
重要临床结果
1、诺和诺德:口服司美格鲁肽又一项 3 期临床成功
10 月 21 日, 诺和诺德宣布口服司美格鲁肽的 3 期临床试验 SOUL 研究结果积极。
这项随机、双盲全球多中心临床试验比较了口服司美格鲁肽相较于安慰剂作为标准护理之外的附加疗法对主要心血管事件(MACE)的预防效果,纳入了 9650 例患有 2 型糖尿病和确诊心血管疾病(CVDL)和/或慢性肾病(CKD)患者。试验达到了主要终点,相较于安慰剂显著降低了 14% 的 MACE 发生风险。
截图来源:企业官网
约有三分之一的 2 型糖尿病患者患有心血管疾病,这意味着很大的临床需求。基于此项临床试验的成功,诺和诺德期望在 2025 年初向美国和欧盟提交口服司美格鲁肽(Rybelsus®)的新适应症上市申请。而该项研究的详细结果,则将在 2025 年的医学会议中予以披露。
多肽类药物通过胃肠吸收、实现口服一直是药物研发历程上的难题。借助「SNAC 吸收促进剂」创新技术,诺和诺德突破了这一技术壁垒,实现了 GLP-1RA 类药物经口服途径给药的历史性跨越。SNAC 的促吸收作用可将口服给药途径的司美格鲁肽分子生物利用度提高约 100 倍。司美格鲁肽片每日口服给药,即可强效降糖,获得平稳血药浓度曲线。在 2023 年度,司美格鲁肽口服制剂已经实现 27.23 亿美元全球销售额,同比增幅高达 70%。
MNC 财报
1、罗氏 2024Q3:制药业务前三季度营收 343 亿瑞士法郎,中国区增长 8%
10 月 23 日,罗氏公布三季度报,前九个月,制药业务销售额 343 亿瑞士法郎,增长 7%,基础业务(不包括 COVID-19)增长 9%;第三季度,实现销售额增长 9%(以瑞士法郎计算为 6%),与第二季度持平。
其中,中国地区销售额增长 8%,主要得益于 Xofluza、Perjeta、Polivy 和 Avastin。
诊断业务全球销售额增长了 5%,而基础业务(不包括 COVID-19)销售额由于对免疫诊断、病理学和分子解决方案的需求增加而增长了 8%。
国内创新药进展
本周国内共有 51 款创新药(含改良新)研发进度推进到了新阶段,其中 1 款申报上市,2 款启动 III 期临床,12 款新药获批临床,20 款申报临床。
本周国内首次获批临床的 15 款创新药(含改良新)
来自:Insight 数据库网页版
(下文如无特殊标注,为同一来源)
获批上市
1、百济神州:PD-1 抑制剂在中国获批第 14 项适应症
10 月 21 日,百济神州宣布,其 PD-1 抑制剂百泽安(替雷利珠单抗)正式获得中国国家药监局批准,联合含铂化疗新辅助治疗,并在手术后继续本品单药辅助治疗,用于可切除的 II 期或 IIIA 期非小细胞肺癌患者的治疗。
截图来源:百济神州官微
本次获批是基于 RATIONALE 315(NCT04379635)的临床试验数据。该研究是一项多中心、随机、安慰剂对照、双盲的 3 期研究,评价了替雷利珠单抗联合含铂双药化疗作为新辅助治疗,后续辅以替雷利珠单抗辅助治疗,用于可切除 II 期或 IIIA 期 NSCLC 患者的有效性和安全性。
研究结果显示,无事件生存期(EFS)和主要病理学缓解率(MPR 率)的双重主要终点皆已达到,证实围术期替雷利珠单抗联合新辅助化疗的治疗方式可以显著降低患者的围术期进展或复发转移风险。
与围术期安慰剂联合新辅助化疗相比,围术期替雷利珠单抗联合新辅助化疗显著提高了 MPR 率(56.2% vs 15.0%)和病理学完全缓解率(pCR 率,40.7% vs 5.7%),并显著延长了 EFS(HR:0.56,95% CI: 0.40~0.79),且已观察到总生存期(OS)显示良好的延长趋势(HR:0.62,95% CI: 0.39~0.98);
该治疗方案的总体耐受性良好,未发现新的安全性信号。
此项研究的结果也已在 2024 年 2 月召开的欧洲肿瘤内科学会年会全体会议(ESMO plenary session)上发布。
2、强生:复方制剂「泽倍珂」在华获批, 治疗前列腺癌
10 月 21 日,强生宣布,旗下创新治疗药物泽倍珂(尼拉帕利阿比特龙片)正式获得国家药品监督管理局批准。作为目前国内首个且唯一获批的双效复方制剂,泽倍珂联合泼尼松或泼尼松龙用于治疗携带胚系和/或体系 BRCA 基因突变的转移性去势抵抗性前列腺癌成人患者(mCRPC)。
截图来源:强生官微
泽倍珂是 BRCA1/2 突变 mCRPC 成人患者的一线靶向治疗方案。作为一种高选择性聚腺苷二磷酸核糖聚合酶 (PARP) 抑制剂,尼拉帕利和醋酸阿比特龙的组合联合泼尼松或泼尼松龙,能够靶向 mCRPC 患者的两种致癌驱动因素——雄激素受体轴和 BRCA1/2 突变。
经临床验证,泽倍珂联合泼尼松或泼尼松龙可显著延长 BRCA1/2 突变 mCRPC 患者的影像学无进展生存期(rPFS)。此外,与安慰剂相比,尼拉帕利还显示出总体生存 (OS) 改善的趋势,可显著延长至症状进展时间(TSP)和至细胞毒性化疗起始时间(TCC),同时并维持了患者的生活质量。
3、罗欣药业:1 类新药「替戈拉生」获批新适应症
10 月 21 日,NMPA 官网显示,罗欣药业替戈拉生片新适应获批上市,与适当的抗菌疗法联用根除幽门螺杆菌。本次是替戈拉生片获批的第 3 项适应症,另外两项已获批的适应症分别是反流性食管炎和十二指肠溃疡。
截图来源:NMPA 官网
替戈拉生片是我国首款自研钾离子竞争性酸阻滞剂类药物(P-CAB),拥有全新抑酸作用机制。和传统抑酸药物相比,替戈拉生片拥有 30 分钟快速起效、黏膜愈合率高、有效改善夜间酸突破、药物相互作用较少,且服药方便不受进食影响等显著优势。
此次获批上市是基于国内开展的一项多中心、随机、双盲双模拟的 III 期临床研究,旨在评价含替戈拉生对比含艾司奥美拉唑的铋剂四联疗法根除幽门螺杆菌的疗效和安全性。该研究结果入选 2024 年 DDW 口头报告。
该研究共纳入561 例受试者,其中 555 例被纳入全分析集(Full Analysis Set,FAS)。受试者被随机分配至替戈拉生(50 mg)组或艾司奥美拉唑(20 mg)组治疗 14 天。主要终点是治疗后通过 13C-尿素呼气试验确定幽门螺杆菌根除率,次要终点是在阿莫西林或克拉霉素不同敏感人群中的幽门螺杆菌根除率。
FAS 中替戈拉生组和艾司奥美拉唑组的幽门螺杆菌根除率分别为 93.5% 和 86.4%(差值 7%;95%CI,2.06-11.99%)。证明了含替戈拉生铋剂四联疗法根除幽门螺杆菌的非劣效性。根据研究方案进行预先设定的优效性检验,含替戈拉生铋剂四联疗法优于含艾司奥美拉唑铋剂四联疗法(P=0.0055)。在阿莫西林或克拉霉素不同敏感人群中,替戈拉生组的Hp根除率均高于艾司奥美拉唑组,但差异无统计学意义(P>0.05)。在 PPS(Per Protocol Set)中也观察到类似的结果。
两组之间的安全性相似。替戈拉生组和艾司奥美拉唑组的治疗中出现的不良事件发生率(TEAE)分别为 75.5% 和 73.4%,分别有 173(62.2%)例和 165(58.5%)例受试者报告了与研究药物有关的不良事件(TRAE)。
申报上市
1、首药控股:新一代 ALK 抑制剂「康太替尼颗粒」申报上市
10 月 23 日,CDE 官网公示,首药控股的 1 类新药康太替尼颗粒申报上市,单药适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者治疗。
康太替尼(CT-707)是一款第二代 ALK 多靶点激酶抑制剂,靶向 ALK/FAK/PTK2B/IGF1R。今年上半年,该药已在头对头克唑替尼(辉瑞)的 Ⅲ 期临床中达到研究主要终点。
截图来源:CDE 官网
康太替尼本次上市申请是基于一项关键性 Ⅲ 期临床试验(CTR20200770)。该研究旨在比较康太替尼与克唑替尼治疗 ALK 阳性晚期 NSCLC 患者的有效性和安全性。主要研究终点为经过独立影像评价的无进展生存期(PFS),次要研究终点包括研究者评价的 PFS、研究者和独立影像评估的客观缓解率(ORR)、缓解持续时间(DOR)、总生存期(OS)等。
该研究由中国医学科学院肿瘤医院石远凯教授领衔担任主要研究者,全国 80 余家中心共同参与,共纳入 414 例既往最多接受过 1 线化疗方案的治疗、且未接受过任何 ALK 抑制剂治疗的 ALK 阳性晚期 NSCLC 患者。
今年上半年,康太替尼治疗 ALK 阳性 NSCLC 患者的关键性 Ⅲ 期临床试验完整数据读出,主要研究终点结果达到方案预设的优效标准。数据显示,与对照组相比,康太替尼在治疗 ALK 阳性 NSCLC 患者中取得了显著且有临床意义的改善,安全性方面同样展现出独特的优势。
拟优先审评
1、第一三共:「吡昔替尼」拟纳入优先审评,首款治疗 TGCT
10 月 24 日,CDE 官网显示,第一三共新药盐酸吡昔替尼胶囊(PLX3397)拟纳入优先审评,用于治疗伴有重度病变或功能受限且无法通过手术改善的症状性腱鞘巨细胞瘤(TGCT)成年患者。这是目前全球首个也是唯一一个获批治疗 TGCT 的药物。
截图来源:CED 官网
吡昔替尼(Pexidartinib)是一种小分子酪氨酸激酶抑制剂,能够抑制集落刺激因子 1 受体 (CSF1R),CSF1R 配体的过表达促进滑膜中细胞的增殖和积累。此外,吡昔替尼还能抑制 KIT 和 FLT3。
2019 年 8 月 2 日,FDA 批准 Pexidartinib(Turalio) 用于存在严重的发病率或功能限制且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者的治疗。该项批准基于一项关键 III 期 ENLIVEN 研究的积极数据。ENLIVEN 研究入组了 120 例患者,1:1 随机分配至 Pexidartinib 组(61 例)和安慰剂组( 59 例),主要疗效终点是治疗 25 周后总缓解率(ORR)。
数据显示,治疗第 25 周,口服 Pexidartinib 治疗组 ORR 为 39%,安慰剂组为 0%,达到了研究的主要终点。
临床试验结果
1、再鼎医药:DLL3 ADC 广泛期小细胞肺癌临床结果公布,ORR 高达 74%
10 月 25 日,再鼎医药在 2024 年 EORTC-NCI-AACR(ENA)大会上,以口头报告的形式,公布了ADC 新药 ZL-1310 全球 Ia 期临床研究数据,至少接受过一次治疗后评估的患者 ORR 为 74%。
ZL-1310 是一款靶向 Delta 样配体 3(DLL3)潜在的同类最优的新一代 ADC,其包含人源化抗 DLL3 单克隆抗体,该抗体与新型喜树碱衍生物(一种拓扑异构酶 1 抑制剂)连接作为其有效载荷。
本次会议上布了正在进行的 Ia 部分单药治疗剂量递增研究的数据,其中包括四个剂量组(0.8 mg/kg、1.6 mg/kg、2.0 mg/kg 和 2.4 mg/kg)中 25 位患者的研究结果。其中 19 例可评估患者中,至少接受过一次治疗后评估的患者 ORR 为 74%(95%CI, 48.8, 90.9)。
DLL3 H-Score 评分大于 5(范围:5-260)的患者均表现出肿瘤缓解。在 19 位患者中出现应答的 14 位患者中,有 13 位仍基线有脑转移且可评估疗效的六位患者,均获得部分缓解(PR)。
ZL-1310 在所有剂量水平下均具有良好的耐受性,大多数治疗出现的不良事件(TEAE)为 1 级或 2 级。在 2.4 mg/kg 剂量组观察到 DLT 。25 位患者中有 5 位(20%)发生了≥3 级以上的治疗相关不良事件;2 位患者(8%)发生了严重的治疗相关不良事件;3 位患者(12%)需要降低剂量,没有患者因 TEAE 而终止治疗。
19 位患者中,所有患者均在接受标准含铂化疗后出现进展,92% 的患者在接受免疫检查点抑制剂治疗后出现进展。56% 的患者此前至少接受过两种治疗但均失败。28% 的患者在基线时存在脑转移。
这些有潜力的研究数据支持对 ZL-1310 作为单药在正在进行的 1 期临床研究的剂量扩展阶段,以及在联合治疗中的继续评估。
2、兆科眼科:新型「儿童近视眼药水」中国 III 期临床成功
10 月 23 日,兆科眼科宣布,NVK002 为期两年的 III 期临床试验(China CHAMP)取得积极的顶线结果。
NVK002 是一种用于控制儿童及青少年近视加深的试验性新型外用眼部溶液。该药是一项专利配方,可成功解决低浓度阿托品的不稳性。NVK002 不含防腐剂,预计保存期至少 24 个月。NVK002 的目标患者覆盖 3 至 17 岁的儿童及青少年。
NVK002 的临床开发涉及两款不同浓度的阿托品,以便配合个别患者的需要,灵活达致最佳疗效与最少副作用。
China CHAMP 是一项随机、双盲、安慰剂平行对照、多中心、 III 期临床研究,其主要目标为评估 NVK002(0.01% 及 0.02% 的低剂量阿托品)对治疗中国儿童及青少年近视加深的疗效及安全性。该项试验涉及 18 家研究中心,入组 777 名患者。
经过两年的治疗,这项研究分析显示,NVK002 滴眼液组(0.01% 和 0.02% 剂量)对比安慰剂组在主要疗效指标上有统计学意义的显著性差异,NVK002 滴眼液组优于安慰剂组,且具有剂量依赖。两种剂量的 NVK002 安全性良好,患者使用依从性好。
启动 III 期临床
1、恒瑞医药:IL-5 单抗启动三期临床,治疗哮喘
10 月 22 日,恒瑞在 Clinicaltrials 网站登记一项 III 期临床,评价 SHR-1703 治疗嗜酸性粒细胞哮喘的疗效和安全性。
截图来源:Clinicaltrials 官网
该研究计划入组 360 人,主要终点为 48 周时哮喘的加重率。
SHR-1703 是恒瑞研发的一种新型、皮下注射用、人源化抗 IL-5 单克隆抗体(IgG1 亚型),可与 IL-5 结合,抑制 IL-5/IL-5R 信号通路,从而抑制嗜酸性粒细胞的增殖、活化和迁移,降低嗜酸性粒细胞型哮喘患者的哮喘发作次数,改善患者肺功能,提高患者生活质量。
今年 5 月份,恒瑞公布了 SHR-1703 在健康受试者中的 I 期研究结果,数据显示,接受 SHR-1703 后,外周血嗜酸性粒细胞 (EOS) 较基线大幅下降,而安慰剂组与基线相比没有显著变化。随着 SHR-1703 剂量的增加,EOS 减少的幅度和持续时间增加。在 400 mg 剂量下,单次给药后约 6 个月内仍能保持显著的降低 EOS 的效果。此外,SHR-1703 在健康受试者中表现出低免疫原性 (2.9%)、良好的安全性和耐受性。
除了用于哮喘外,SHR-1703 用于变应性肉芽肿血管炎也进展到临床 II/III 期,该研究在 2023 年 11 月份完成首例患者入组,预计会在 2027 年 Q2 完成。
目前全球已有三款针对 IL-5/IL-5R 的单克隆抗体获批上市,分别为葛兰素史克的美泊利珠单抗,优时比/Teva 的瑞替珠单抗和协和麒麟/阿斯利康公司的本瑞利珠单抗;其中只有美泊利珠单抗和本瑞利珠单抗在国内获批。虽然尚无国产 IL-5/IL-5R 单抗获批,但是已有 5 款国产进展到临床阶段,其中最快的就是恒瑞的 SHR-1703 和三生国建 SSGJ-610,都处于 III 期临床。
内容来源:药企官方发布新闻/资料、Insight 数据库
封面来源:站酷海洛 Plus
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
点击卡片进入 Insight 小程序
国内审评进度、全球新药开发…
随时随地查!
多样化功能、可溯源数据……
Insight 数据库网页版等你体验
点击阅读原文,立刻解锁!
临床3期疫苗上市批准信使RNA申请上市
100 项与 Changsha Dingxiangyuan Biotechnology Co., Ltd. 相关的药物交易
登录后查看更多信息
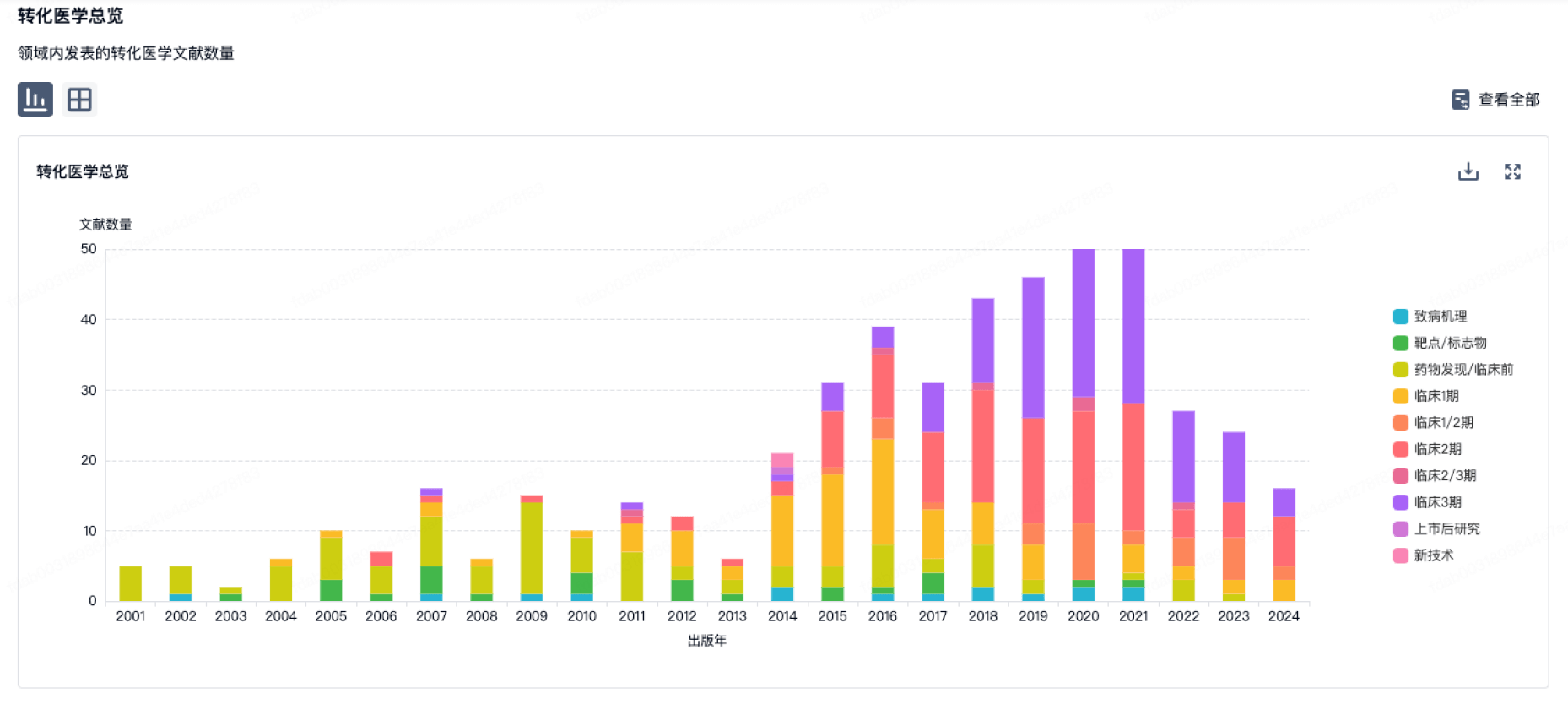
100 项与 Changsha Dingxiangyuan Biotechnology Co., Ltd. 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2024年11月17日管线快照
无数据报导
登录后保持更新
药物交易
使用我们的药物交易数据加速您的研究。
登录
或

转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或

投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或

融资
发掘融资趋势以验证和推进您的投资机会。
登录
或

标准版
¥16800
元/账号/年
新药情报库 | 省钱又好用!
立即使用
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用