预约演示
更新于:2025-05-07

Lianyungang Haosen Pharmaceutical Co., Ltd.
连云港豪森制药有限公司|合资公司 | 私营公司|1995|中国江苏省
连云港豪森制药有限公司|合资公司 | 私营公司|1995|中国江苏省
更新于:2025-05-07
概览
关联
100 项与 连云港豪森制药有限公司 相关的临床结果
登录后查看更多信息
0 项与 连云港豪森制药有限公司 相关的专利(医药)
登录后查看更多信息
18
项与 连云港豪森制药有限公司 相关的新闻(医药)2025-03-12
·药学进展
“
点击蓝字 关注我们
阿美乐®第三项适应症获批上市,用于Ⅲ期不可切NSCLC患者放化疗后的维持治疗PPS
2025年3月10日,翰森制药集团有限公司(以下简称“翰森制药”,03692.HK)宣布,阿美乐®(甲磺酸阿美替尼片)新适应症获批上市,用于含铂根治性放化疗后未出现疾病进展的不可切除的局部晚期表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的非小细胞肺癌(NSCLC)患者的治疗,此为阿美乐®上市5年来获批的第三项适应症。据此,阿美乐®成为目前唯一获批用于Ⅲ期不可切NSCLC患者放化疗后维持治疗的中国原研三代EGFR-TKI。
该次获批主要基于POLESTAR(HS-10296-304)研究,这是一项随机、双盲、对照、多中心的Ⅲ期临床研究,由山东省肿瘤医院于金明院士作为主要研究者牵头完成。研究结果曾入选2024年世界肺癌大会(WCLC)“最新突破摘要(Late Breaking Abstract,LBA)”名单,并以口头报告的形式在大会的主席论坛上呈现。
研究结果显示,阿美乐®将疾病进展风险降低了80%以上;接受阿美乐®治疗的患者中位无进展生存期(mPFS)为30.4个月,而接受安慰剂治疗的患者mPFS仅为3.8个月,且阿美乐®各预设亚组PFS获益一致,呈现全面获益人群的特征。此外,BICR评估的阿美乐®治疗组患者的客观缓解率(ORR)达57%,中位缓解持续时间(DoR)延长至16.59个月,中位总生存期(OS)尚未达到,CNS病变和远处转移发生率更低。放化疗后阿美乐®治疗组患者的总体耐受性良好且可管理,在不良事件(AE)中,≥3级放射性肺炎发生率为0,间质性肺炎发生率为0。
迄今为止,阿美乐®已有三项适应症获批上市,其中前两项于2024年11月续约纳入2024版国家医保目录;另有两项适应症上市申请(NDA)已获受理:
获批上市:二线治疗
既往经EGFR-TKI治疗进展,且T790M突变阳性的局部晚期或转移性NSCLC患者
获批时间:2020年3月
获批上市:一线治疗
具有EGFR外显子19缺失或外显子21(L858R)置换突变阳性的局部晚期或转移性NSCLC成人患者的一线治疗
获批时间:2021年12月
获批上市:维持治疗
含铂根治性放化疗后未出现疾病进展的不可切除的局部晚期表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的非小细胞肺癌(NSCLC)患者的治疗
获批时间:2025年3月
NDA获受理:术后辅助
具有EGFR外显子19缺失或外显子21(L858R)置换突变阳性的NSCLC成人患者肿瘤切除术后的辅助治疗
受理时间:2024年7月
NDA获受理:靶化联合
联合培美曲塞和铂类化疗药物适用于具有EGFR外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性NSCLC成人患者的一线治疗
受理时间:2024年11月
关于肺癌
肺癌在中国仍然是癌症发病率和死亡率的首要原因。根据2022年的统计数据,中国约有106万新肺癌病例,占所有恶性肿瘤的22.0%,有74万癌症相关死亡,占所有癌症死亡的28.5%[1]。其中,非小细胞肺癌(NSCLC)是最常见的类型,占所有诊断的85%[2]。EGFR突变的患者对EGFR酪氨酸激酶抑制剂(EGFR-TKIs)特别敏感,这是一类阻断促进肿瘤生长的特定信号通路的靶向疗法[3]。
关于阿美乐®
作为中国首个原研三代EGFR-TKI,阿美乐®(甲磺酸阿美替尼片)创新性地引入环丙基结构,具有良好的脂溶性和稳定性,能更好地透过血脑屏障,且不良反应发生率低。目前,阿美乐®已有三项适应症获批上市,分别是:二线治疗既往经EGFR-TKI治疗进展,且T790M突变阳性的局部晚期或转移性NSCLC患者,一线治疗具有EGFR外显子19缺失或外显子21(L858R)置换突变阳性的局部晚期或转移性NSCLC成人患者,以及含铂根治性放化疗后未出现疾病进展的不可切除的局部晚期EGFR外显子19缺失或外显子21(L858R)置换突变的NSCLC患者治疗。
关于翰森制药
翰森制药是中国领先的创新驱动型制药企业,以「持续创新,提高人类生命质量」为使命,重点关注抗肿瘤、抗感染、中枢神经系统、代谢及自身免疫等重大疾病治疗领域。截至目前,公司已上市7款创新药,形成了丰富的产品管线。翰森制药连续多年位居全球制药企业百强、中国医药研发产品线最佳工业企业前3强,是国家重点高新技术企业、国家技术创新示范企业。
参考文献:
[1] Liu, Y., Chen, H., & Zhou, Q. (2020). Targeted therapies for EGFR-mutant lung cancer: Advances and challenges. Journal of Thoracic Oncology, 15(5), 743-755. https://doi-org.libproxy1.nus.edu.sg/10.1016/j.jtho.2020.01.008
[2] Wang, X., & Li, Y. (2021). Non-small cell lung cancer: Advances in diagnosis and treatment. Chinese Medical Journal, 134(10), 1234-1242. https://doi-org.libproxy1.nus.edu.sg/10.1097/CM9.0000000000001511
[3] Zhang, L., Sun, Y., & Li, Q. (2022). Lung cancer statistics in China: Incidence and mortality. Cancer Research, 82(12), 2303-2310. https://doi-org.libproxy1.nus.edu.sg/10.1158/0008-5472.CAN-22-0453
文章来源:豪森制药
美编排版:覃冰冰
文章审核:杨美帆 覃冰冰 罗琪
【免责声明】以上内容来源于互联网,不代表本平台立场或观点;如有侵犯作者著作权,请及时与我们联系(Tel:025-83271227,或直接在微信平台留言),我们将及时更正或删除。
《药学进展》杂志由国家教育部主管、中国药科大学和中国药学会共同主办,中国科技核心期刊(中国科技论文统计源期刊)。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。
《药学进展》注重内容策划、加强组稿约稿、深度挖掘、分析药学信息资源、在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实战性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子1.216,具有较高的影响力。
《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委由新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、金融资本及知识产权相关机构近两百位极具影响力的专家组成。
联系《药学进展》↓↓↓
编辑部官网:pps.cpu.edu.cn;
邮箱:yxjz@163.com;
电话:025-83271227。
欢迎投稿、订阅!
往期推荐
聚焦“兴药为民·2023生物医药创新融合发展大会”“兴药为民·2023生物医药创新融合发展大会”盛大启幕!院士专家齐聚杭城,绘就生物医药前沿赛道新蓝图“兴药强刊”青年学者论坛暨《药学进展》第二届青年编委会议成功召开“兴药为民·2023生物医药创新融合发展大会”路演专场圆满收官!校企合作新旅程已启航
我知道你在看哟
上市批准临床3期临床结果
2025-02-28
·药学进展
“
点击蓝字 关注我们
豪森制药圣罗莱®长效促红细胞生成机制研究发表 PPS
研究表明,培莫沙肽作为聚乙二醇化的EPO模拟肽(EMP),是一种具有持续活性的长效促红细胞生成剂,其发挥长效抗贫血作用的原因,除了延长半衰期,还在于能够通过与EPO受体形成高度稳定的结合,使下游信号通路不断被激活,从而持续地促进红细胞生成[1]。
近日,翰森制药培莫沙肽(商品名:圣罗莱®)的长效作用机制研究于《转化医学杂志》(Journal of Translational Medicine)(web of science实时影响因子:6.8)发表。
作为一种长效制剂,培莫沙肽采用第三代分支型聚乙二醇(PEG)修饰技术,能够大大延长药物半衰期,其在慢性肾脏病(CKD)贫血患者中的消除半衰期(t1/2)为58.3~74.9h[2]。为了验证除半衰期延长以外,培莫沙肽得以实现每月1次给药的长效机制,研究者们开展了多项研究。
研究结果介绍
此次J Transl Med发表的长效促红细胞生成机制研究共涵盖一项体外试验、一项动物试验及两项分别针对透析和非透析CKD贫血患者Ⅱ期临床试验[1],以下为具体研究结果。
体外试验:培莫沙肽与EPO受体的结合更稳定且持久
表面等离子体共振(SPR)结果显示,与传统的短效ESAs和达依泊汀α相比,培莫沙肽与EPOR的结合更稳定,并且在EPOR上的滞留时间更长,约为rHuEPO (ESPO 3000)的6.4倍。体外细胞实验结果表明,培莫沙肽能够促进UT-7细胞增殖,维持细胞存活以及抑制细胞凋亡,且有助维持UT-7细胞表面EPOR表达,进而持续促成红细胞生成。
该体外研究首次验证了培莫沙肽在体外与EPO受体(EPOR)的结合更稳定且持久,并可通过维持细胞表面EPOR的表达,维持下游信号通路持续激活以生成红细胞,从而为培莫沙肽长效促红细胞生成作用提供了有力理论依据。
动物实验:小鼠单次给药后血红蛋白持续升高长达14天,为人体内每月1次给药提供依据
健康小鼠中单次皮下注射培莫沙肽后发现,外周网织红细胞在第4天显著增加,红细胞、血红蛋白和血比容在第6天呈剂量依赖性显著增加,并持续至第14天。由于培莫沙肽在啮齿类动物体内的清除速度要比在人体中快得多,因此,该实验结果为人体内每月1次给药提供了理论依据。研究还显示,与短效ESA(ESPO 3000)相比,培莫沙肽在小鼠体内表现出更为显著的促红效果。
Ⅱ期临床试验:培莫沙肽具有PK-PD双延长效应,且耐受性良好
在两项分别针对透析和非透析CKD贫血患者的II期临床试验中,患者接受了不同剂量(0.025 mg/kg、0.05 mg/kg、0.08 mg/kg)的培莫沙肽治疗,并进行每4周一次的6次给药。结果表明,培莫沙肽在透析和非透析CKD贫血患者中,均能有效地提高并维持血红蛋白(HGB)水平。培莫沙肽PK-PD双重延长的特性通过HGB和网织红细胞计数得以体现,支持其每月1次给药。HGB应答患者比例以及不良事件的报告进一步验证了培莫沙肽在研究人群中具有良好的疗效和安全性。
除上述长效机制研究外,2025年1月发布的《指导肾性贫血患者自我管理的中国共识(2024版)》中提到,目前肾性贫血患者用药依从性现状较差,可能与工作时间冲突、担心药物相互作用、药丸较大吞咽困难、注射频率高等原因相关。而包括EPO模拟肽(培莫沙肽)等在内的长效ESAs,可延长用药间隔、减少用药次数,提高患者治疗依从性[3]。因此,圣罗莱®的长效机制将有助于提高肾性贫血患者的依从性和自我管理水平,促进血红蛋白达标和改善患者预后。
关于圣罗莱®
圣罗莱®是翰森制药自主研发的全球唯一获批上市的EPO模拟肽,已于2023年6月获国家药品监督管理局(NMPA)批准上市,用于治疗透析和非透析慢性肾脏病(CKD)患者贫血,并于当年进入国家医保目录。
作为一种长效制剂,圣罗莱®仅需每月皮下注射给药1次,就能够实现不逊于传统短效ESAs的疗效及安全性[4,5],且相比短效ESAs需要频繁注射,每月给药1次能够大大提高患者的治疗依从性,帮助患者减少就医次数和花费,避免频繁注射带来的痛苦,有助于实现肾性贫血的长期稳定控制。
关于翰森制药
翰森制药是中国领先的创新驱动型制药企业,以「持续创新,提高人类生命质量」为使命,重点关注抗肿瘤、抗感染、中枢神经系统、代谢及自身免疫等重大疾病治疗领域。截至目前,公司已上市7款创新药,形成了丰富的产品管线。翰森制药连续多年位居全球制药企业百强、中国医药研发产品线最佳工业企业前3强,是国家重点高新技术企业、国家技术创新示范企业。翰森制药于2019年6月在香港联交所挂牌上市(股票代码:03692.HK)。
参考文献 :
[1]Xiaoying Ma, Zhen Li, Lu Zhang,et al. Pegmolesatide Exhibits Sustained Erythropoiesis Stimulating Activity via EPOR-Mediated Signal Transduction - An Overview of Preclinical and Phase II Clinical Studies. Journal of Translational Medicine.In press.
[2]培莫沙肽注射液说明书(修改日期:2024年4月3日)
[3]指导肾性贫血患者自我管理的中国专家共识工作组. 指导肾性贫血患者自我管理的中国专家共识(2024版)[J]. 中国血液净化, 2025, 24(01): 1-12.
[4]EClinicalMedicine. 2023 Oct 28;65:102273.
[5] Kidney International Reports. Available online 6 December 2024. In Press. https://doi-org.libproxy1.nus.edu.sg/10.1016/j.ekir.2024.12.002.
文章来源:豪森制药
美编排版:覃冰冰
文章审核:杨美帆 覃冰冰 罗琪
【免责声明】以上内容来源于互联网,不代表本平台立场或观点;如有侵犯作者著作权,请及时与我们联系(Tel:025-83271227,或直接在微信平台留言),我们将及时更正或删除。
《药学进展》杂志由国家教育部主管、中国药科大学和中国药学会共同主办,中国科技核心期刊(中国科技论文统计源期刊)。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。
《药学进展》注重内容策划、加强组稿约稿、深度挖掘、分析药学信息资源、在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实战性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子1.216,具有较高的影响力。
《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委由新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、金融资本及知识产权相关机构近两百位极具影响力的专家组成。
联系《药学进展》↓↓↓
编辑部官网:pps.cpu.edu.cn;
邮箱:yxjz@163.com;
电话:025-83271227。
欢迎投稿、订阅!
往期推荐
聚焦“兴药为民·2023生物医药创新融合发展大会”“兴药为民·2023生物医药创新融合发展大会”盛大启幕!院士专家齐聚杭城,绘就生物医药前沿赛道新蓝图“兴药强刊”青年学者论坛暨《药学进展》第二届青年编委会议成功召开“兴药为民·2023生物医药创新融合发展大会”路演专场圆满收官!校企合作新旅程已启航
我知道你在看哟
临床2期
2025-02-13
·摩熵医药
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需要得到授权。
髓系白血病(Myelodysplastic Syndromes,MDS)是一种起源于骨髓的恶性血液病,主要影响造血功能,导致白血球、红血球和血小板的异常生产。髓系白血病分为急性和慢性两种类型。急性髓系白血病(AML)是临床上较为常见且发展迅速的类型,通常需要及时治疗,慢性髓系白血病(CML)则常通过长期管理维持患者生活质量。随着分子靶向治疗的发展,治疗髓系白血病的药物日益多样化。
本文基于摩熵咨询最新发布的《白血病药物市场研究专题报告》,探讨了急性髓系白血病和慢性髓系白血病的最新诊疗指南以及药物市场的竞争格局,分析了各类药物的市场动态和前景。
01
急性髓系白血病诊疗指南
及药物市场竞争格局
01
急性髓系白血病诊疗指南
FMS样酪氨酸激酶3(FLT3)是一个在造血作用和淋巴细胞增殖过程中发挥重要作用的一个受体酪氨酸激酶,AML患者中约有1/3的人都存在FLT3异常激活的状态。IDH1/2的突变在AML患者中大致占15%~20%,IDH1/2 的突变会导致细胞功能紊乱。
对于复发难治性急性髓系白血病,诊疗指南推荐FLT3抑制剂、IDH抑制剂和BCL-2 抑制剂等,具体来说:
Ⅰ级推荐:FLT3-ITD及FLT3-TKD突变的AML患者,推荐吉瑞替尼(gilteritinib)靶向治疗或联用BCL-2抑制剂进行联合化疗,如维奈克拉(venetoclax)+FLAG-IDA。
Ⅱ级推荐:根据不同突变类型选择索拉非尼+去甲基化药物(针对FLT3-ITD突变)或艾伏尼布(ivosidenib)(针对IDHI突变)进行靶向治疗,此外还可以采用强烈化疗方案。
Ⅲ级推荐:推荐使用强烈化疗方案米托蒽醌脂质体+阿糖胞苷+VP16。
图片来源:摩熵咨询《白血病药物——市场研究专题报告》
02
FLT3抑制剂市场分析:索拉非尼、吉瑞替尼
FLT3抑制剂分为第1代(索拉非尼和midostaurin)和第2代FLT3抑制剂(如quizartinib和吉瑞替尼)。第1代FLT3抑制剂特异性较低,有较宽的激酶组特性和更多的脱靶效应。第2代FLT3抑制剂更具特异性和有效性。
索拉非尼2009年就已经在国内获批上市,适应症为肝癌、肾癌和甲状腺癌,并无AML。但诊疗指南依然推荐了。据摩熵医药销售数据统计,2019-2020年索拉非尼的销售额还稳定在16亿元左右,随着仿制药的陆续上市,竞争加剧,2023年整体销售额仅为2.47亿元。
富马酸吉瑞替尼片于2021年2月在国内批准上市,用于治疗携带FLT3突变的复发或难治性(耐药)的AML成人患者,目前仍处于市场导入期。年销售额尚未破亿,但仍然有稳步增长趋势。
数据来源:摩熵医药销售数据库
另有两款FDA已获批上市但在国内还未获批的FLT3抑制剂(截至2024年12月):米哚妥林(诺华、2017年FDA批准上市)、Quizartinib (第一三共、2023年FDA批准上市)。
03
IDH抑制剂市场分析:艾伏尼布尚处于市场导入期
艾伏尼布是一种针对异柠檬酸脱氢酶-1(IDH1)突变癌症的强效口服靶向抑制剂,用于治疗携带IDH1易感突变的成人复发或难治性急性髓系白血病(R/R AML)患者,最初由Agios Pharmaceuticals公司开发,2018年基石药业与Agios达成在大中华区开发及商业化的独家协议,并于2022年2月在国内获批上市,2023年销售额2000万元,仍处于市场导入期。
04
BCL-2抑制剂市场分析:维奈克拉销售额过3亿
维奈克拉,全球首款BCL-2(B淋巴细胞瘤-2基因)抑制剂,艾伯维研发的小分子靶向药物,2016年获得FDA批准上市,并于2020年在中国获批上市,用于急性髓细胞性白血病(AML),小淋巴细胞淋巴瘤(SLL),慢性淋巴细胞性白血病(CLL)。2023年销售额为3亿元。
02
慢性髓系白血病诊疗指南
及药物市场竞争格局
01
慢性髓系白血病诊疗指南
约90%的慢性粒细胞白血病患者都有一种叫做“费城染色体”的基因异常,这种染色体产生一种叫做BCR-ABL的蛋白质,可以促进患者恶性白细胞的增殖。酪氨酸激酶抑制剂(TKI)用于靶向BCR-ABL,已成为多数慢性粒细胞白血病患者的首选治疗药物。
2024年CSCO推荐慢性髓系白血病一线疗法为一代产品伊马替尼和国内获批上市的三款二代产品,一代产品耐药后使用二代产品或三代产品。
02
慢性髓系白血病上市药物分析
2001年,第一个酪氨酸激酶抑制剂(TKI)伊马替尼获批上市(我不是药神里的药物原型),将CML的十年生存率从以前的不到50%,增加到了现在的90%左右。2013年4月在中国的专利保护到期,仿制药陆续上市。
第二代Bcr-Abl抑制剂能更专一的与Bcr-Abl靶点结合,所以疗效都有一定的提升,且针对第一代耐药突变有效,达沙替尼和尼洛替尼专利均已到期。
第三代产品对BCR-ABL以及包括T315I突变在内的多个突变体有效,T315I 突变约占一代耐药患者突变比例的 12%,二代药耐药患者27%~34%。国内亚盛医药的奥雷巴替尼独占鳌头,武田的泊那替尼被FDA加了“黑框警告”,诺华的阿思尼布刚申报上市。
备注:费城染色体阳性( Ph+ );恶性胃肠道问质瘤(GIST);啫酸细胞过多综合征(HES)和慢性嗜酸粒细胞白血病(CEL);骨隐增殖异常综合征/骨髓增殖性疾病(MDS/MPD)。数据来源:摩熵医药全球药物研发数据库
03
慢性髓系白血病药物市场规模:BCR-ABL抑制剂崛起
一代产品虽然2013年专利到期,但销售额依然表现强势,据摩熵医药数据库统计,其2019年院端和药店零售合计销售额仍为38亿元,二代产品为11亿元。从趋势来看,一代产品由于只有伊马替尼一款,且使用多年,耐药性问题凸显,加上仿制药价格竞争激烈,2023年表现已弱于第二代产品,分别为21亿元和25亿元。第三代产品2021年底获批上市,2023年销售额达1.66亿元,仍处于市场导入期,未来可期。
04
慢性髓系白血病药物竞争格局:BCR-ABL抑制剂竞争激烈
伊马替尼仿制药厂家众多,从2023年竞争格局来看,原研企业诺华仍占据一半以上的份额(58%),其次豪森制药和正大天晴,各占10%以上的份额。
二代BCR-ABL抑制剂竞争格局呈现三足鼎立态势,豪森制药原研的氟马替尼2023年销售额10亿元,占据42%的份额,其次是诺华的尼洛替尼销售额9亿元,占据36%的份额。达沙替尼已被仿制药厂家正大天晴抢占绝大部分市场,占据二代产品总体18.5%的市场份额。
结语
髓系白血病的治疗领域在近年来取得了显著的进展,尤其是在靶向药物的研发和应用方面。然而,尽管市场上的治疗药物种类繁多,竞争激烈,疗效和耐药性问题仍然是治疗中需要解决的关键难题。随着科技的不断进步和更多新药的开发,未来髓系白血病的治疗前景将更加广阔,更多高效、安全的治疗方案的问世,将为广大患者带来更多福音。
END
本文为原创文章,转载请留言获取授权
白血病药物——市场研究专题报告
下期内容预告
目录
一、2024年白血病药物市场格局:伊布替尼专利临近,药企争先布局仿制药
近期将持续更新,敬请期待
近期热门资源获取
【摩熵咨询】市场研究专题报告一-非小细胞肺癌药物-202410
【摩熵咨询】市场研究专题报告二-胃癌药物-202410
【摩熵咨询】市场研究专题报告三-多发性骨髓瘤药物-202410
【摩熵咨询】市场研究专题报告四-淋巴瘤药物-202410
【摩熵咨询】市场研究专题报告五-乳腺癌药物-202410
【摩熵咨询】市场研究专题报告六-抗HIV药物-202410
【摩熵咨询】市场研究专题报告七-抗肝炎病毒药物-202410
【摩熵咨询】市场研究专题报告八-肝素药物-202410
近期更多摩熵咨询热门报告,识别下方二维码领取
联系我们,体验摩熵医药更多专业服务
会议
合作
园区
服务
数据库
咨询
定制
服务
媒体
合作
👆👆👆点击上方图片,即可开启摩熵化学数据查询
点击阅读原文,申请摩熵医药企业版免费试用!
上市批准核酸药物
100 项与 连云港豪森制药有限公司 相关的药物交易
登录后查看更多信息
100 项与 连云港豪森制药有限公司 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2025年06月13日管线快照
无数据报导
登录后保持更新
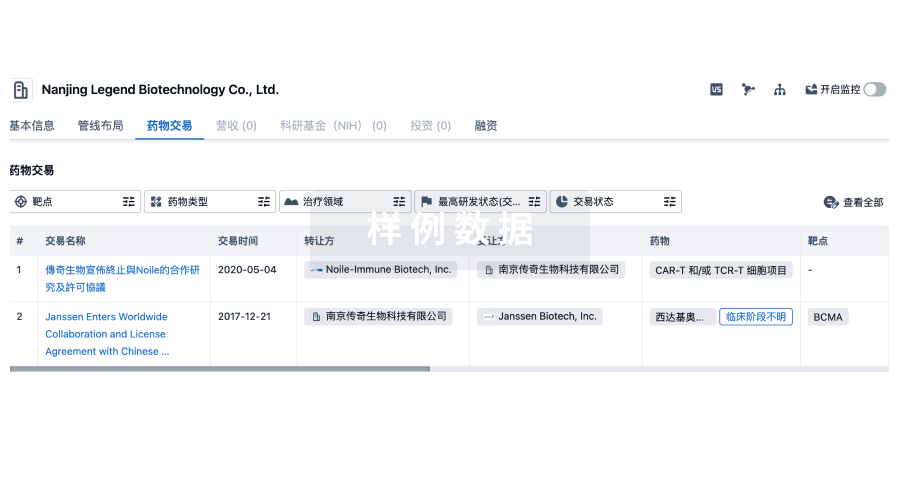
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
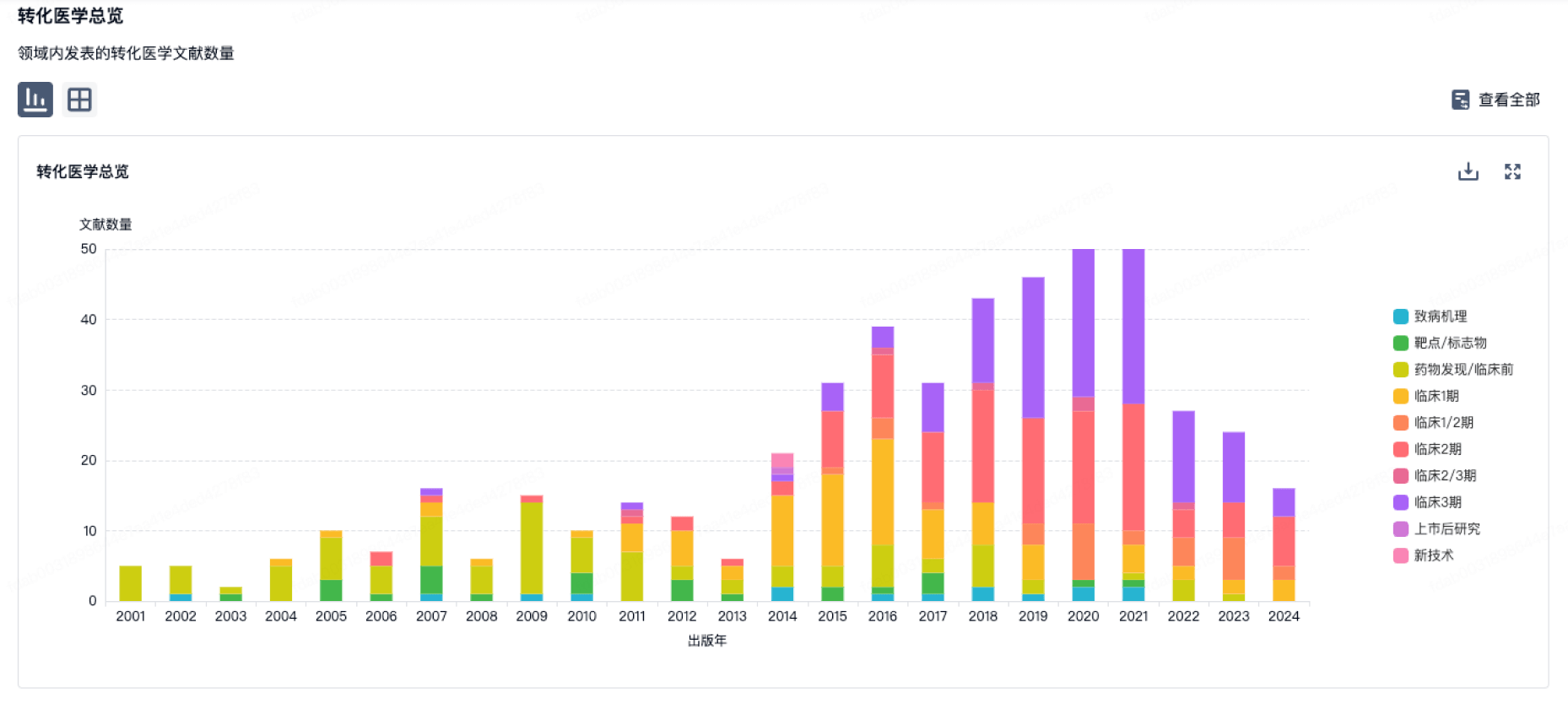
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或
科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或
投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或
融资
发掘融资趋势以验证和推进您的投资机会。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用