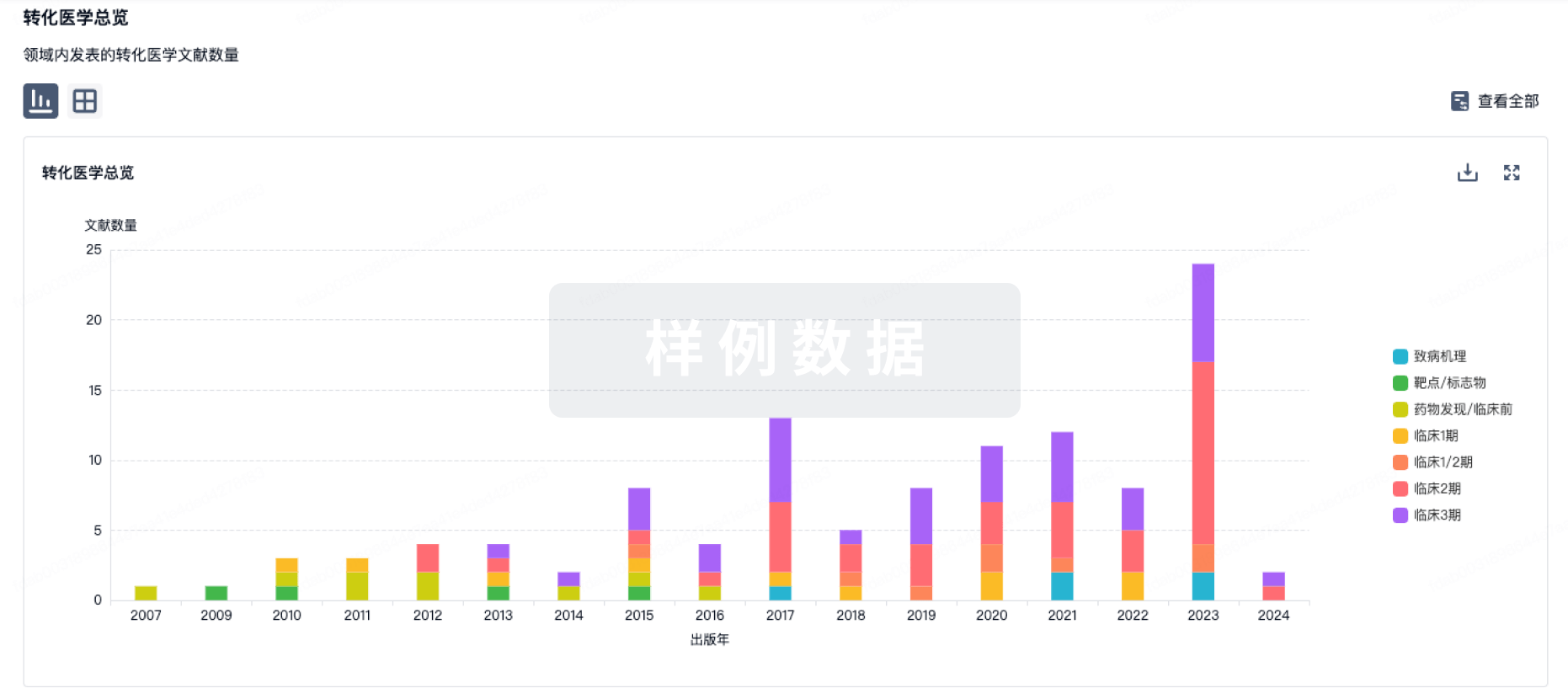
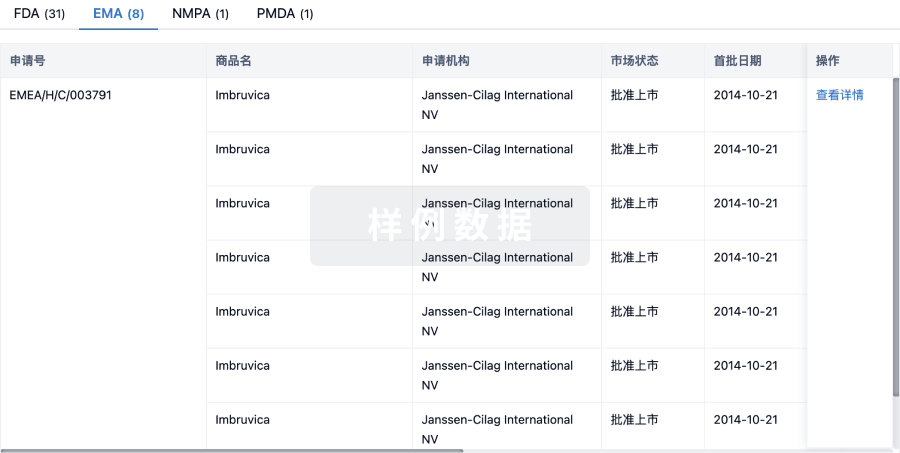
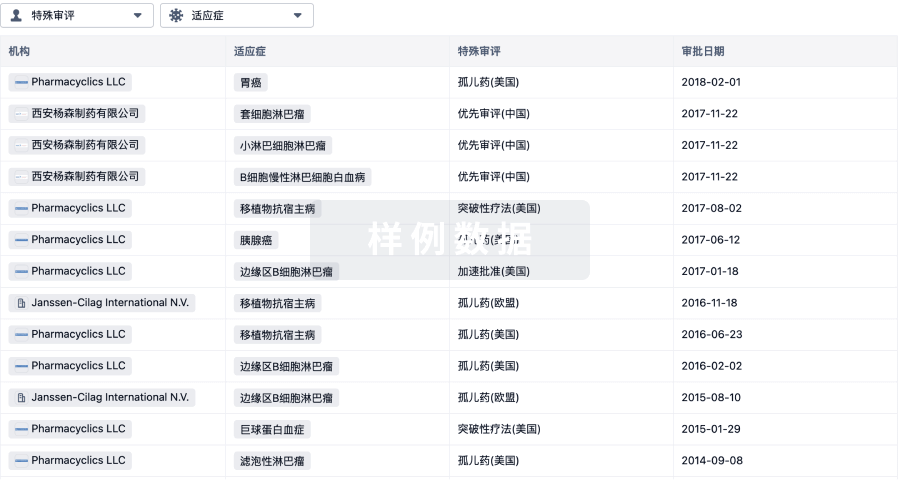
6 月28 日,据 CDE 官网显示,大冢制药特应性皮炎药 Difamilast 软膏在国内首次申报临床获受理(受理号:JXHL2200163、JXHL2200164、JXHL2200165)。来自:CDE 官网特应性皮炎(AD)是一种慢性炎症性皮肤病,其特征是皮肤红肿、破裂,伴有剧烈瘙痒。在世界范围内,高达 10% 的成人和 20% 的儿童患有特应性皮炎,而根据公开资料显示,轻中度 AD 患者占比 60% 以上。中国特应性皮炎的患病率在近 10 余年间不断升高,受累及的人群涉及各年龄段。中国特应性皮炎诊疗指南(2020 版)指出,我国 12 个城市数据显示 1-7 岁儿童特应性皮炎患病率达到 12.94%,1-12 月婴儿特应性皮炎患病率达 30.48%。Difamilast 是大冢发现的一款非甾体、局部抗炎磷酸二酯酶 4(PDE4)抑制剂,最早于 2021 年 9 月在日本获批上市,用于 2 岁以上儿童和成人的轻中度 AD 患者。Difamilast 全球研发进度甘特图来自:Insight 数据库 (http://db.dxy.cn/v5/home/)2016 年 2 月,大冢授予 Medimetriks 在美国市场开发、销售、生产 Difamilast 的权利,当前正在推进美国的开发进度。Difamilast 医药交易来自:Insight 数据库 (http://db.dxy.cn/v5/home/)此前,大冢制药公布了两项在日本开展的评估 Difamilast 治疗成人患者和儿童患者轻度至中度特应性皮炎的 III 期临床试验的顶线结果。研究主要终点为:研究者整体评估(IGA)评分为 0(皮损完全清除)或 1(几乎完全清除)、且相对基线水平至少改善 2 分的患者比例。治疗组用 Difamilast 乳膏剂每日涂抹 2 次,连续用药 4 周。结果显示,2 项试验均达到主要终点:与赋形剂组,Difamilast 治疗组 IGA 成功率更高,且差异具有统计学意义。而本次在国内申报临床,对于国内患者而言无疑是个好消息。据 Insight 数据库 显示,针对特应性皮炎,目前在全球共有 20 款 PDE4 抑制剂在研。其中,已获批上市的有 2 款,除大冢的 Difamilast 外,另有辉瑞的 Crisaborole 早于 2016 年 12 月获 FDA 批准上市。此外,Arcutis 生物制药的罗氟司特乳膏/Roflumilast/ARQ151 当前正处于 III 期试验阶段。PDE4 抑制剂在特应性皮炎领域全球在研情况(III 期临床及以上阶段)来自:Insight 数据库 (http://db.dxy.cn/v5/home/)在国内,据 Insight 数据库 显示,辉瑞的非甾体 PDE4 抑制剂克立硼罗/Crisaborole(商品名:Eucrisa) 已于 2020 年 7 月首次获批上市,用于 2 岁及以上轻度至中度特应性皮炎患者的局部外用治疗 ,成为中国首个非激素外用 PDE4 抑制剂。此外,恒翼生物的 HPP737 以及天津合美医药科技 的 Hemay028、Hemay005 等均已进入临床阶段。免责声明:本文仅作消息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。编辑:HebePR 稿对接:微信 insightxb投稿:微信 insightxb;邮箱 insight@dxy.cn点击卡片进入 Insight 小程序药品申报、临床、上市、一致性评价…随时随地查!↓↓ 点击解锁更多新功能