预约演示
更新于:2025-05-07
A-83-01
更新于:2025-05-07
概要
基本信息
药物类型 化学药 |
别名 |
作用方式 抑制剂 |
作用机制 ALK4抑制剂(activin A receptor type 1B inhibitors)、ALK5抑制剂(转化生长因子β受体1抑制剂)、ALK7抑制剂(activin A receptor type 1C inhibitors) |
治疗领域 |
在研适应症 |
非在研适应症- |
非在研机构- |
权益机构- |
最高研发阶段临床前 |
首次获批日期- |
最高研发阶段(中国)- |
特殊审评- |
关联
100 项与 A-83-01 相关的临床结果
登录后查看更多信息
100 项与 A-83-01 相关的转化医学
登录后查看更多信息
100 项与 A-83-01 相关的专利(医药)
登录后查看更多信息
105
项与 A-83-01 相关的文献(医药)2025-04-01·Journal of Biological Chemistry
Derivation of human trophoblast stem cells from placentas at birth
Article
作者: Jabeen, Mahe ; San Miguel, Adriana ; Rao, Balaji M ; Britt, John W ; Karakis, Victoria
2025-02-28·International Journal of Stem Cells
Lung Cancer Organoid System to Evaluate the Cytotoxicity of Natural Killer Cells
Article
作者: Jeong, Youngtae ; Kim, Jeongmin ; Oh, Byungmoo ; Kim, Namwoog
2025-01-15·Biology Open
Air–liquid interface culture combined with differentiation factors reproducing intestinal cell structure formation in vitro
Article
作者: Iwao, Takahiro ; Matsunaga, Tamihide ; Ogawa, Isamu ; Nakai, Takaaki
8
项与 A-83-01 相关的新闻(医药)2025-04-23
OTC2025论坛深度聚焦类器官与疾病建模、新药发现/研发、3D细胞培养、类器官培养及质控。展位咨询请联系:王晨 180 1628 8769。在《Nature》期刊上发表的这篇文章中,日本的科研团队探讨了通过激活Wnt和STAT3信号通路来实现人类成年肝细胞类器官的长期自我更新。这项研究解决了肝细胞在体外培养中扩增能力与功能保持之间的权衡问题。研究发现,YAP的激活促进了肝细胞的增殖,但会导致其向胆管导管谱系的分化。相反,OSM诱导的STAT3激活不仅促进了肝细胞的增殖,还抑制了导管化生,维持了肝细胞的特性。移植到小鼠体内的肝细胞类器官能够重新构建受体小鼠肝脏的代谢分区结构,并在去除培养基中的特定因子后形成具有胆管网络的绳索状结构,表现出与体内肝细胞相当的主要肝脏代谢功能。该研究为开发针对人类肝脏疾病的治疗策略提供了新的途径。01研究背景首先,肝脏是人体内一个关键的代谢器官,负责多种重要的生物化学过程,如葡萄糖生成、糖原合成、尿素循环、脂质生成、胆汁酸合成、蛋白质生产和药物代谢。这些功能的严重损害会导致肝功能衰竭,通常需要进行肝移植。近年来,随着抗病毒治疗的进步,肝功能衰竭的病因从病毒性肝炎转向与现代生活方式相关的代谢性肝病,特别是代谢功能障碍相关的脂肪性肝病。这种疾病如果不加以治疗,会进展为脂肪性肝炎、肝硬化和肝功能衰竭。然而,由于缺乏能够真实再现肝脏代谢功能的人类肝细胞模型,预防代谢性肝病的成功率有限。其次,体外分离的肝细胞在增殖能力上迅速下降,与其在体内的强大再生能力形成对比。现有的培养方法只能暂时维持初级人类肝细胞的功能性,但会影响其扩增能力。虽然一些研究尝试通过不同的策略来克服这一限制,如使用小分子抑制剂促进肝细胞的扩增,但这些方法往往导致胆管化生,即功能性细胞被重新编程为增殖能力较强的细胞。这种现象被称为“paligenosis”,使得在再生医学、药物发现和毒理学领域中使用人类肝细胞面临重大挑战。因此,开发一种能够长期扩增且保持功能性的人类肝细胞培养系统至关重要。02研究发现人类成年肝细胞类器官的长期扩增和功能保持:研究团队通过激活Wnt和STAT3信号通路,实现了人类成年肝细胞类器官的长期自我更新。YAP信号的激活促进了肝细胞的增殖,但会导致其向胆管细胞谱系分化。相反,Oncostatin M通过激活STAT3信号,促进了肝细胞的增殖,同时抑制了胆管化生,保持了肝细胞的特性。研究表明,这种类器官在移植到小鼠体内后,能够重建受体小鼠肝脏的代谢分区结构,并在去除特定培养因子后,形成具有胆小管网络的肝索样结构,表现出与体内肝细胞相当的主要肝脏代谢功能。类器官在基因编辑和疾病建模中的应用潜力:研究表明,这些肝细胞类器官可以进行基因编辑,从而为代谢性肝病的功能建模提供了可能性。新开发的培养系统为人类肝病的治疗策略开发提供了一个有前景的途径。通过优化的培养条件,研究团队成功地在体外模拟了肝细胞的代谢功能,这标志着功能性类器官医学的新时代。03临床意义肝移植的替代方案:HHOs可能成为肝移植的替代方案,特别是在供体短缺或无法进行肝移植的情况下。 药物筛选和毒性测试:HHOs展示的药物代谢能力与体内肝细胞相似,使其成为药物筛选和毒性测试的理想模型。这可以加速新药的开发和安全性评估。 代谢性肝病的研究和治疗开发:HHOs提供了一个真实反映人类肝脏代谢功能的平台,有助于深入研究代谢性肝病的病理机制,并开发针对这些疾病的治疗策略。 再生医学的应用:由于HHOs能够进行基因编辑,它们可用于研究遗传性肝病并探索基因治疗的可行性。 总之,该研究不仅为肝细胞的体外长时间培养提供了新的策略,还为肝脏相关疾病的基础研究和临床应用开辟了新的方向。04实验策略1. 信号通路激活与抑制: 通过激活Wnt和STAT3信号通路,实现人类成年肝细胞类器官的长期自我更新。 YAP激活促进肝细胞增殖,但同时导致其向胆管导向分化。 通过抑制TGFβ信号和使用Oncostatin M激活STAT3,促进肝细胞增殖并抑制导管化生,从而保持肝细胞特性。2. 类器官培养体系的优化: 在培养基中添加EGF、HGF、FGF-10、Wnt/R-spondin、TGFβ抑制剂(A83-01和Noggin)、IL-6和PKA激活剂(Forskolin),支持小囊状类器官的形成。 通过去除某些培养因子(如Noggin和forskolin),并补充激素(如生长激素、催乳素和皮质醇),促进肝细胞类器官的线索状结构形成及胆小管网络的建立。3. 体内移植实验: 将类器官移植到经过药物处理以去除肝细胞的小鼠体内,评估其在小鼠肝脏中的再生能力和代谢分区结构的重建。4. 基因编辑与功能建模: 类器官易于进行基因编辑,从而用于代谢性肝病的功能建模。05数据解读图1:人类成人肝细胞类器官在特定因子下的扩增Figure 1 展示了人类成人肝细胞类器官(HHOs)在特定培养条件下的扩增情况,包括使用不同因子如IL-6和OSM对类器官的影响。 A. 为了观察PHH来源的类器官在扩增培养基(加IL-6)中的表达情况,作者进行了免疫荧光染色。结果显示,HHOs表达白蛋白,而ICOs则显示CK19和EpCAM的表达。此结果在三个供体中获得一致性。 B. 为了研究HHOs在扩增培养基中添加OSM或IL-6后的扩增情况,作者通过传代比率和基于ATP的细胞计数估算了细胞数量。每个点代表一次传代事件,三个类器官系在初始3个月内大约每2周传代一次,传代比率为3-12倍,‘x’表示传代失败。供体分别为39岁、53岁和61岁。 C. 为了观察OSM对单个PHH来源类器官生长的影响,作者拍摄了时间推移图像。相同的类器官在相同放大倍率下显示。此结果在两个供体中获得一致性。 D. 为了研究OSM对HHOs基底极性的影响,作者进行了代表性明场和整体免疫染色,标记了CDH1(蓝色)、ZO-1(红色)、整合素β4(绿色)和细胞核(白色)。此结果在四个供体中获得一致性。 E. 为了分析胆管细胞相关转录因子、YAP靶基因和TGFβ信号相关基因的转录组,作者对PHHs、ICOs和HHOs在有无OSM和LATSi(TRULI,5 μM)条件下进行了分析。供体分别为11个月和16个月。 F. 为了观察HHOs在±OSM和±LATSi(5 μM)培养14天后的情况,作者进行了Alb和CK19的免疫染色(左)。细胞核用Hoechst 33342标记。结果显示,CK19+类器官仅在无OSM和有LATSi的条件下观察到(右)。 结论:人类成人肝细胞类器官在特定因子如IL-6和OSM的影响下能够有效扩增,并且不同因子组合对类器官的极性和表型有显著影响。图2:小鼠肝脏用人类肝类器官(HHO)再生Figure 2 展示了通过异种移植方法,将人类肝类器官(HHO)移植到小鼠肝脏中,观察其在小鼠肝脏中的再生情况。 a. 为了研究HHO在小鼠肝脏中的再生能力,作者设计了异种移植实验流程。TK-NOG小鼠在接受ValGCV处理以消融肝细胞后,被移植了HHO或人类原代肝细胞(PHH)。每周采集血液样本,并在8周后收集肝脏样本。 b. 通过苏木精-伊红染色(H&E)和STEM121染色,展示了HHO移植物的代表性图像。结果显示,移植的小鼠和人类肝细胞之间有明显的界限。类似结果在21个PHH移植物(来自五个供体)和104个HHO移植物(来自八个供体)中获得。 c–h. 研究了PHH或HHO(来自两个供体)在小鼠肝脏中的再生情况。通过测量血清中人类白蛋白(hALB)的浓度随时间的变化来评估再生效果。不同的HHO传代次数用不同颜色表示;‘x’表示小鼠死亡。STEM121染色显示了PY53和PY30 HHO移植物。再生效率通过人类肝细胞面积相对于总肝脏面积的比例计算。每个点代表一只小鼠。统计分析显示,与对照组PHH相比,HHO组的再生效率显著提高。 i. 对HHO移植物进行了hALB(红色)、闭合蛋白(绿色)和人类MRP2(蓝色)的染色。结果显示,来自PHH(一个供体)和eHHO(三个供体)的数据具有相似的结果。 j. 在HHO移植物中对分区标记物进行染色,HAL(红色;顶部)位于门静脉附近,CYP2E1(红色;底部)位于中央静脉附近。细胞核用Hoechst 33342(白色)染色;移植细胞为STEM121+(绿色)。门静脉和中央静脉的腔用虚线标出(*表示门静脉)。来自PHH(两个供体)和eHHO(HAL为六个供体,CYP2E1为八个供体)的代表性数据显示了相似的结果。 k,l. 分别显示了在STEM121+区域内HAL+(k)或CYP2E1+(l)面积的比例。每个点代表一只小鼠的一个切片;每种条件下来自两到三只小鼠的平均比例。使用Welch双侧t检验进行统计分析。 结论:HHO能够在小鼠肝脏中有效再生,并表现出与人类肝细胞相似的功能特性。图3:建立具有代谢功能的dHHOs(分化后的人体肝细胞类器官)Figure 3 展示了文章中的一项关键实验,即分化后的人体肝细胞类器官(dHHO)建立及其代谢功能的评估。 形态变化: dHHOs从上皮样结构转变为肝细胞样结构,显示出成熟的形态特征。 胆汁酸代谢: 实验证明dHHOs可以合成胆汁酸,并在胆汁小管中运输荧光标记的胆汁酸衍生物,表明其具有生理功能。 胆汁酸的合成和分泌: LC–MS/MS分析显示,与体外培养的人体肝细胞相比,dHHOs产生更高浓度的胆汁酸。 甘油三酯生产: dHHOs能够合成甘油三酯,并在存在微粒体甘油三酯传输蛋白抑制剂时被阻断,验证了其代谢活性。 结论: 这些成功的分化实验及其结果表明,通过优化培养条件,dHHOs不仅展示了典型的胆汁酸代谢功能,还具备了潜在的药物发现和毒理学研究的应用能力。这为将来利用类器官模型进行更深层次的人类肝脏代谢研究奠定了基础。图4:建立门静脉肝细胞类器官Figure 4 展示了对分化后的人体肝细胞类器官(dHHOs)的功能评估,特别是在再现肝脏门静脉区域特定功能方面的能力。 葡萄糖合成与糖异生: dHHOs在饥饿后展示了较高的葡萄糖生成能力,并成功追踪到13C标记的葡萄糖合成路径,证实了其有效的糖异生能力。 尿素合成: 使用15N标记氯化铵进行追踪,发现dHHOs能够转变氨为尿素,验证了其尿素循环的完整性。 线粒体功能活性: dHHOs显示出高于eHHOs的最大呼吸能力,提示其具有更活跃的氧化磷酸化水平。 白蛋白和凝血因子生产: dHHOs能够合成接近人体生理水平的白蛋白,并在维生素K存在下增加凝血因子的活性。 结论: 通过一系列功能性实验,Figure 4展示了dHHOs在多种重要肝脏代谢功能方面的恢复能力,特别是与门静脉区域相关的功能。这包括葡萄糖生成、尿素合成及相应代谢途径的活跃性,表明dHHOs可以作为体外研究人类肝脏功能和代谢疾病的有效模型。图5:生成基因敲除的肝细胞类器官Figure 5 展示了通过基因编辑技术生成基因敲除的人体肝细胞类器官(HHOs)的过程和结果。 基因敲除成功: 成功通过sgRNA实现了对G6PC和OTC基因的敲除,Sanger测序和免疫检测确认了对应蛋白的缺失。 形态和功能保持: 尽管基因敲除,G6PC和OTC缺失的HHOs仍然保持了正常的类器官形态,并能够合成一定水平的白蛋白。 功能影响: G6PC敲除使得糖异生功能降低,而OTC敲除导致瓜氨酸生成的缺失,验证了各基因在其代谢途径中的关键角色。 培养条件优化: 通过使用LATSi和人血小板裂解物,促进了基因编辑HHOs的扩增,而没有引起生长停滞或管道分化。 结论: Figure 5描述了一种有效的流程来对成人肝细胞类器官进行基因敲除,从而提供一种稳定的模型来研究肝脏代谢疾病。这一进展为通过基因编辑技术探索肝脏功能、发现疾病机理和开发治疗策略提供了可能性。06主要结论这项研究展示了一种新的培养系统,该系统能够在体外长期扩增人类成体肝细胞类器官(HHOs),并保持其代谢功能。通过激活Wnt和STAT3信号通路,研究人员成功实现了HHOs的自我更新,并避免了导管化生的发生。HHOs能够重新构建受体小鼠肝脏的代谢分区结构,并在体外展示出与体内肝细胞相当的主要肝脏代谢功能。这种文化系统为肝脏疾病的治疗策略开发提供了新的途径。07讨论总结研究强调了HHOs技术在解决人类成体肝细胞体外扩增与功能性之间权衡的潜力。通过基因组学分析,关键的培养因子如EHF、Wnt/R-spondin、Noggin、TGFβ抑制剂、OSM和福司可林被确定为促进肝细胞扩增的必要因素。特别地,OSM-STAT3激活不仅促进了肝细胞的增殖,还保留了肝脏谱系的完整性,防止了导管化生和上皮-间质转化。 研究指出,HHOs技术代表了一种新的类器官培养系统,兼具肝细胞的扩增性和功能性。其优点包括提供了一个稳定、可重复且成本效益高的平台,用于探索人类肝脏代谢,超越了传统的人类肝细胞模型的局限性。此外,HHOs在再生医学中的潜在应用为解决肝衰竭问题打开了新的视野。END免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。OTC2025论坛深度聚焦类器官与疾病建模、新药发现/研发、3D细胞培养、类器官培养及质控。展位咨询请联系:王晨 180 1628 8769。戳“阅读原文”立即领取OTC2025免费参会名额!
临床1期
2025-03-31
OTC2025论坛深度聚焦类器官与疾病建模、新药发现/研发、3D细胞培养、类器官培养及质控。展位咨询请联系:王晨 180 1628 8769。胃癌类器官:研究进展、现存问题与未来展望文|浠灵一、引言1.1 研究背景与意义胃癌作为全球范围内严重威胁人类健康的恶性肿瘤之一,其发病率和死亡率均位居前列。据 2022 年全球癌症统计数据显示,胃癌新发病例数为 96.84 万例,占所有新增癌症病例的 4.9%,位居全球癌症发病率第五位 ;死亡病例数达 65.99 万例,占比 6.8%,位列全球癌症死亡原因第五。在中国,胃癌同样是癌症防治的重点,2022 年新发胃癌病例数达到 35.87 万例,占全国新增癌症病例数的 7.4%,位居国内新发癌症第五位,死亡人数高达 26.04 万例,占全国癌症死亡病例数的 10.1%,排名癌症死亡原因第三位。胃癌的治疗面临诸多挑战。传统的治疗手段包括手术、化疗、放疗等,但由于胃癌患者对这些治疗方案的反应存在显著差异,导致治疗效果参差不齐。手术切除联合围手术期化疗是局部晚期胃癌患者的一线治疗选择,然而,患者对常见化疗药物如氟尿嘧啶和铂类化合物的反应差异很大,原因尚不明确。这使得开发能够准确预测胃癌患者治疗疗效的方法成为亟待解决的问题。在这样的背景下,患者来源的胃癌类器官(patient-derived gastric organoids)研究应运而生,为胃癌的研究和治疗带来了新的希望。类器官是一种在实验室中培养的三维细胞聚集体,能够高度模拟体内器官的结构和功能。患者来源的胃癌类器官,更是直接来源于患者的肿瘤组织,保留了肿瘤的基因图谱和组织病理学特征,这使其在胃癌研究中具有独特的优势。通过构建胃癌类器官生物样本库,研究人员可以深入研究胃癌的发病机制,探索肿瘤细胞的生物学特性。利用胃癌类器官进行药物筛选,能够更准确地预测患者对不同化疗药物的反应,为个性化治疗方案的制定提供有力依据,有助于提高化疗的疗效和临床结局,减少无效治疗,减轻患者的经济负担和副作用风险。对胃癌类器官的研究,也为开发新的治疗靶点和治疗方法提供了可能,有望推动胃癌治疗领域的发展,改善患者的生存质量和预后。1.2 胃癌类器官的概念与特点胃癌类器官是一种通过体外培养技术,从胃癌患者的肿瘤组织中获得的三维细胞聚集体。它能够高度模拟体内胃癌组织的结构和功能,包含了多种与胃癌相关的细胞类型,如胃癌细胞、癌相关成纤维细胞、免疫细胞等,这些细胞在类器官中相互作用,共同构建出类似胃癌组织的微环境。在细胞组成方面,胃癌类器官中的胃癌细胞保留了原发肿瘤细胞的特性,具有增殖、侵袭和转移等能力。癌相关成纤维细胞则可以分泌多种细胞因子和生长因子,影响胃癌细胞的生长、存活和迁移。免疫细胞的存在,使得胃癌类器官能够在一定程度上模拟肿瘤免疫微环境,研究肿瘤细胞与免疫细胞之间的相互作用。从组织结构来看,胃癌类器官呈现出与胃癌组织相似的形态和结构特征。它具有腺腔样结构,类似于胃腺的形态,细胞之间紧密排列,形成了具有一定极性的细胞群体。这种组织结构的相似性,使得胃癌类器官在研究胃癌的发生、发展机制以及药物筛选等方面具有重要的价值。胃癌类器官在功能特性上也与胃癌高度相似。它能够表达胃癌相关的标志物,如癌胚抗原(CEA)、糖类抗原 19-9(CA19-9)等,这些标志物的表达水平与原发肿瘤组织中的表达水平相近。胃癌类器官还能够对化疗药物、靶向药物等产生不同的反应,反映出患者个体对药物的敏感性差异,为个性化治疗提供了有力的工具。1.3 研究目的和方法本研究旨在全面梳理患者来源的胃癌类器官在胃癌研究领域的进展,深入剖析当前研究中存在的问题,并对未来发展方向进行前瞻性探讨,为胃癌的基础研究和临床治疗提供理论支持和研究思路。在研究过程中,采用了多种研究方法。文献研究法是重要的手段之一,通过广泛查阅 Web of Science、PubMed、中国知网等数据库中关于胃癌类器官的相关文献,全面了解胃癌类器官的研究现状,包括其培养技术、生物学特性、在药物筛选和疾病建模等方面的应用,以及相关的分子机制研究等内容,梳理出该领域的研究脉络和发展趋势。案例分析法也贯穿于研究始终。通过对中山大学李晓星研究员团队构建胃癌类器官生物样本库用于个性化药物筛选的案例分析,详细了解了胃癌类器官在实际应用中的具体情况。该团队从 73 例胃癌患者中成功建立 57 例胃癌患者来源的类器官,成功率达 78% ,这些类器官保留了原发胃癌组织的组织学特征,对不同化疗药物表现出不同反应,且药物反应结果与 91.7%(11/12)的胃癌患者实际临床反应一致,有力地证明了胃癌类器官在预测患者对化疗药物治疗反应方面的应用价值。对上海交通大学医学院附属瑞金医院于颖彦团队利用患者来源类器官筛选小分子激酶抑制剂,发现弥漫型胃癌对极光激酶抑制剂产生药物性肿瘤细胞衰老改变及新型免疫抑制机制的案例进行分析,深入探讨了胃癌类器官在研究肿瘤耐药机制方面的作用。还运用了归纳总结法,对收集到的文献资料和案例分析结果进行系统归纳和总结。将胃癌类器官的培养技术、应用领域、面临问题等方面的内容进行分类整理,提炼出关键信息和核心观点,从而全面呈现患者来源的胃癌类器官的研究进展、问题及未来发展方向,为后续的讨论和结论提供坚实的基础 。二、病人来源的胃癌类器官研究进展2.1 胃癌类器官的建立与培养技术2.1.1 建立方法概述建立病人来源的胃癌类器官,首要步骤是从胃癌患者的肿瘤组织获取细胞。目前常用的获取细胞方法主要包括机械解离法和酶消化法。机械解离法操作相对简单,主要通过物理手段如剪碎、研磨等方式,将胃癌组织分散成单个细胞或细胞团块。这种方法的优点在于操作简便、成本较低,且能在一定程度上保持细胞的完整性 ,减少对细胞表面分子和内部结构的损伤。其缺点也较为明显,由于是纯物理操作,很难将组织完全解离成单个细胞,得到的细胞团块大小不一,这可能会影响后续类器官的均一性和生长效率。在解离过程中,细胞受到的机械应力较大,可能会导致部分细胞受损,影响细胞的活性和增殖能力。酶消化法则是利用各种消化酶,如胰蛋白酶、胶原酶等,将胃癌组织中的细胞间连接和细胞外基质分解,从而获得单个细胞。以型胶原酶为例,在胃癌类器官培养中,常使用其对胃癌组织进行消化处理。这种方法能够较为彻底地将组织解离成单个细胞,得到的细胞数量较多,且细胞团块较小,有利于后续类器官的形成和生长。酶消化法也存在一些不足,消化酶的浓度和作用时间难以精确控制。如果消化酶浓度过高或作用时间过长,会对细胞造成损伤,影响细胞的活性和功能;反之,若消化酶浓度过低或作用时间过短,则无法充分解离组织,导致细胞获取量不足。酶消化法的成本相对较高,需要使用特定的消化酶和相关试剂。除了细胞获取方法,接种和培养方式也对胃癌类器官的建立有着重要影响。常见的接种方式包括直接接种法和基质胶包埋接种法。直接接种法是将获取的细胞直接接种到培养板中进行培养,操作简单快捷,但细胞在培养板表面的附着和生长情况可能不太理想,类器官的形成效率相对较低。基质胶包埋接种法则是将细胞与基质胶混合后,接种到培养板中,待基质胶凝固后,细胞被包裹在其中,形成三维的培养环境。这种接种方式能够更好地模拟体内细胞的生长环境,促进细胞间的相互作用和信号传导,从而提高类器官的形成效率和质量 。在培养方式上,可分为静态培养和动态培养。静态培养是将培养板放置在培养箱中,不进行额外的搅拌或振荡,操作简单,成本低,但存在营养物质分布不均、代谢产物积累等问题,可能会影响类器官的生长和发育。动态培养则通过旋转培养瓶、搅拌式生物反应器等设备,使培养基处于流动状态,能够更均匀地提供营养物质,及时去除代谢产物,有利于类器官的生长和功能维持,但设备成本较高,操作相对复杂 。2.1.2 培养体系与关键因素胃癌类器官的培养体系是一个复杂的系统,其中包含多种关键因素,这些因素相互作用,共同影响着胃癌类器官的生长和发育。基质胶是培养体系中的重要组成部分,它主要来源于小鼠肉瘤细胞提取物,富含多种细胞外基质成分,如层粘连蛋白、胶原蛋白等。基质胶能够为胃癌细胞提供三维的生长支架,模拟体内细胞外基质的环境,促进细胞的黏附、增殖和分化。在胃癌类器官培养中,基质胶的质量和浓度对类器官的形成和生长有着显著影响。高质量的基质胶能够提供更接近体内的微环境,有利于类器官的生长和维持其生物学特性。合适的基质胶浓度也至关重要,浓度过低,无法形成稳定的三维结构,不利于细胞的生长和类器官的形成;浓度过高,则可能会影响营养物质和氧气的扩散,抑制类器官的生长。研究表明,在胃癌类器官培养中,使用浓度为 10 - 20mg/mL 的基质胶,能够较好地支持类器官的生长和发育 。生长因子在胃癌类器官培养中也起着不可或缺的作用。表皮生长因子(EGF)能够刺激胃癌细胞的增殖和迁移,促进类器官的生长。成纤维细胞生长因子(FGF)家族成员,如 FGF7、FGF10 等,可调节细胞的生长、分化和存活,对维持胃癌类器官的结构和功能具有重要意义。FGF7 能够促进胃上皮细胞的增殖和分化,在胃癌类器官培养中,添加适量的 FGF7 可提高类器官的形成效率和质量。Wnt 信号通路相关的生长因子,如 Wnt3A、R - Spondin1 等,对维持干细胞的干性和促进类器官的自我更新至关重要。在胃癌类器官培养中,这些生长因子的组合和浓度优化是关键。不同类型的胃癌细胞对生长因子的需求可能存在差异,因此需要根据具体情况进行调整。通过实验优化,确定合适的生长因子组合和浓度,能够显著提高胃癌类器官的培养效果 。培养基成分也是影响胃癌类器官培养的关键因素之一。常用的基础培养基包括 Advanced DMEM/F12 等,这些培养基为细胞提供了基本的营养物质,如氨基酸、维生素、糖类等。除了基础培养基,还需要添加一些补充成分,如 N2 添加剂、B27 添加剂等,它们含有多种生长因子、激素和微量元素,能够促进细胞的生长和维持细胞的功能。在胃癌类器官培养基中,还会添加一些特殊成分,如 Nicotinamide、A83 - 01 等。Nicotinamide 可调节细胞的代谢和增殖,A83 - 01 是一种 TGF - β 受体抑制剂,能够抑制 TGF - β 信号通路,促进类器官的生长和维持其干性。培养基的 pH 值和渗透压也需要精确控制,一般来说,胃癌类器官培养基的 pH 值维持在 7.0 - 7.4 之间,渗透压控制在 280 - 320mOsm/kg,这样的条件有利于细胞的生长和代谢 。2.1.3 成功案例分析中山大学的李晓星研究员、于君教授和许丽霞副研究员团队在胃癌类器官研究方面取得了显著成果,为该领域的发展提供了重要的参考和借鉴。该团队致力于构建胃癌患者来源的类器官(PDO)库,从 73 例胃癌患者的癌组织中成功建立了 57 例胃癌类器官,成功率高达 78%。这一高成功率的取得,得益于团队对胃癌类器官建立与培养技术的深入研究和优化。在细胞获取方面,团队可能综合考虑了机械解离法和酶消化法的优缺点,根据不同患者的肿瘤组织特点,选择了最合适的方法,以确保获取高质量的细胞。在接种和培养方式上,团队通过不断尝试和优化,确定了最适合胃癌类器官生长的条件,如采用基质胶包埋接种法,为细胞提供良好的三维生长环境,同时合理控制培养条件,包括温度、湿度、CO2 浓度等,为类器官的生长创造了适宜的环境。这些成功建立的胃癌类器官在组织学上高度保持了原始肿瘤的特征。通过组织学分析,发现类器官的组织结构、细胞形态和细胞间相互作用等方面与原发肿瘤组织非常相似,这表明类器官能够准确地模拟原始肿瘤的生物学特性。在基因表达水平上,RNA 测序结果显示,这些 PDO 的基因表达模式与相应的原发性肿瘤组织高度相似,进一步证明了类器官在分子层面上对原始肿瘤的忠实再现。这一成果具有重要意义,为后续利用胃癌类器官进行深入研究提供了可靠的模型。利用构建的 PDO 库,团队对六种常用化疗药物进行了药物敏感性测试。实验结果显示,不同分型的胃癌患者来源的 PDO 对化疗药物的反应存在明显差异。弥漫浸润型胃癌来源的 PDO 对 5 - 氟尿嘧啶(5 - FU)和紫杉醇更为敏感,而其他分型的胃癌类器官对不同药物的敏感性也各有不同。这一发现充分体现了胃癌类器官在药物筛选方面的重要价值,能够为临床医生提供个性化的用药指导,帮助医生根据患者的具体情况选择最有效的化疗药物,提高治疗效果,减少无效治疗,降低患者的痛苦和经济负担 。团队通过建立患者来源 PDO 异种移植(PDOX)模型,对 PDO 药敏检测结果进行了验证。实验结果表明,小鼠的药物反应与 PDO 药敏检测结果一致,这有力地证明了 PDO 药敏检测在预测临床药物反应方面具有较高的准确性。团队还对 12 名根据 PDO 药敏检测结果进行治疗的患者进行了疗效跟踪,结果显示,91.7% 的患者对药物的反应与其 PDO 药敏检测结果相符,进一步验证了 PDO 药敏检测与临床治疗效果之间的密切相关性。这一系列验证实验,为胃癌类器官在临床治疗中的应用提供了坚实的证据,使其有望成为指导胃癌个性化治疗的重要工具 。2.2 胃癌类器官在肿瘤研究中的应用2.2.1 肿瘤发生发展机制研究胃癌类器官为深入研究肿瘤的发生发展机制提供了独特的视角。通过对胃癌类器官的研究,能够剖析基因突变、信号通路异常以及细胞 - 细胞相互作用等关键因素在肿瘤发生发展过程中的作用。在基因突变方面,胃癌类器官保留了患者肿瘤组织的基因突变信息,这使得研究人员能够直接观察特定基因突变对肿瘤细胞生物学行为的影响。KRAS 基因突变在胃癌的发生发展中具有重要作用,通过对携带 KRAS 基因突变的胃癌类器官进行研究,发现该突变可导致细胞增殖能力增强、侵袭性增加以及对化疗药物的耐药性提高。进一步研究揭示,KRAS 基因突变通过激活下游的 MAPK 信号通路,促进细胞的增殖和存活,从而推动肿瘤的发展。信号通路异常也是肿瘤发生发展的重要机制之一。胃癌类器官能够模拟体内肿瘤细胞的信号通路状态,有助于研究人员深入了解信号通路的异常激活或抑制对肿瘤细胞的影响。Wnt 信号通路在胃癌的发生发展中起着关键作用,正常情况下,Wnt 信号通路受到严格调控,维持细胞的正常增殖和分化。在胃癌类器官中,研究发现 Wnt 信号通路的异常激活,导致 β - catenin 蛋白在细胞内积累,进而激活一系列下游靶基因的表达,促进肿瘤细胞的增殖、迁移和侵袭。通过抑制 Wnt 信号通路,能够显著抑制胃癌类器官的生长和增殖,为胃癌的治疗提供了新的靶点和思路。细胞 - 细胞相互作用在肿瘤的发生发展中同样不可或缺。胃癌类器官包含多种细胞类型,如胃癌细胞、癌相关成纤维细胞、免疫细胞等,这些细胞之间存在着复杂的相互作用。癌相关成纤维细胞能够分泌多种细胞因子和生长因子,如转化生长因子 - β(TGF - β)、血小板衍生生长因子(PDGF)等,这些因子可以调节胃癌细胞的生长、存活和迁移。TGF - β 能够促进胃癌细胞的上皮 - 间质转化(EMT),使其获得更强的侵袭和转移能力。免疫细胞与胃癌细胞之间的相互作用也对肿瘤的发展产生重要影响,肿瘤相关巨噬细胞(TAM)在肿瘤微环境中具有免疫抑制作用,能够促进肿瘤细胞的生长和转移,通过调节 TAM 的功能,有望增强机体对肿瘤的免疫监视和杀伤能力 。2.2.2 药物筛选与药敏试验利用胃癌类器官进行药物筛选和药敏试验,为临床个性化治疗提供了有力的支持。通过在体外培养胃癌类器官,将其暴露于不同的化疗药物和靶向药物中,观察类器官的生长、增殖和凋亡等反应,能够准确评估药物的疗效和敏感性,为患者选择最有效的治疗方案。中山大学李晓星研究员团队构建的胃癌类器官生物样本库,为药物筛选和药敏试验提供了良好的平台。该团队从 73 例胃癌患者中成功建立 57 例胃癌患者来源的类器官,利用这些类器官对六种常用化疗药物进行了药物敏感性测试。实验结果显示,不同分型的胃癌患者来源的 PDO 对化疗药物的反应存在明显差异。弥漫浸润型胃癌来源的 PDO 对 5 - 氟尿嘧啶(5 - FU)和紫杉醇更为敏感,而其他分型的胃癌类器官对不同药物的敏感性也各有不同。这一发现为临床医生根据患者的胃癌分型选择合适的化疗药物提供了重要依据,有助于提高化疗的疗效,减少无效治疗。在实际应用中,利用胃癌类器官进行药物筛选和药敏试验具有诸多优势。与传统的细胞系和动物模型相比,胃癌类器官更能真实地反映患者肿瘤的生物学特性,因为它保留了原发肿瘤的基因图谱和组织病理学特征。这使得药物筛选的结果更具可靠性和临床相关性,能够更准确地预测患者对药物的反应。利用胃癌类器官进行药物筛选和药敏试验可以在短时间内完成,大大缩短了药物研发和临床试验的周期,为患者争取更多的治疗时间。这种方法还可以减少动物实验的使用,降低实验成本和伦理风险。2.2.3 肿瘤耐药机制探索肿瘤耐药是胃癌治疗面临的一大难题,深入探索肿瘤耐药机制对于提高治疗效果至关重要。胃癌类器官在揭示肿瘤耐药机制方面具有独特的优势,能够为开发新的治疗策略提供重要的理论依据。上海交通大学医学院附属瑞金医院于颖彦团队的研究为肿瘤耐药机制的探索提供了新的思路。该团队利用患者来源类器官(PDO)对一组小分子激酶抑制剂进行筛选,尤其关注不同亚型胃癌的敏感性差异。研究发现,肠型胃癌(IGC)对多种激酶抑制剂敏感,而弥漫型胃癌(DGC)显示耐药,并在极光激酶抑制剂(AURKi)巴拉塞替(Barasertib)和达努塞替(Danusertib)治疗后出现药物性肿瘤细胞衰老改变。肿瘤细胞衰老后,并未死亡,而是分泌大量的炎症趋化因子 MCP - 1/CCL2,诱导单核巨噬细胞聚集并发生 M2 极化,导致原本来杀伤肿瘤的机体天然免疫卫士巨噬细胞失去战斗力,形成了新型免疫抑制机制。基于这一发现,研究团队提出对于弥漫型胃癌可采用 AURKi + 清除衰老肿瘤细胞的序贯治疗策略。先使用 AURKi 诱导肿瘤细胞衰老,然后再使用清除衰老肿瘤细胞的药物,以打破免疫抑制微环境,增强机体对肿瘤的免疫杀伤能力。这一策略为弥漫型胃癌的治疗提供了新的方向,有望提高治疗效果,改善患者的预后。通过对胃癌类器官的研究,还可以进一步深入研究肿瘤耐药的分子机制,寻找新的治疗靶点和药物,为解决肿瘤耐药问题提供更多的可能性 。三、病人来源的胃癌类器官研究存在的问题3.1 技术层面的挑战3.1.1 培养稳定性与重复性问题在胃癌类器官的培养过程中,细胞生长的稳定性和实验结果的重复性是亟待解决的关键问题。从细胞生长稳定性来看,胃癌类器官的培养受到多种因素的影响,使得其生长状态难以保持稳定。培养过程中,细胞对营养物质的需求十分复杂且精确。基础培养基中的氨基酸、维生素、糖类等营养成分,以及添加的各种生长因子、添加剂等,任何一种成分的细微变化都可能对细胞的生长产生影响。若生长因子的浓度波动,可能导致细胞增殖速度不稳定,进而影响类器官的形成和发育。培养环境的物理因素也至关重要,温度、湿度、CO2 浓度等的微小变化都可能干扰细胞的正常代谢和生理功能。温度过高或过低,会影响细胞内酶的活性,从而阻碍细胞的生长和分裂;CO2 浓度不合适,则会影响培养基的 pH 值,对细胞的生存环境造成破坏。不同实验室之间在培养技术和操作流程上的差异,也使得胃癌类器官培养的实验结果难以重复。在细胞获取环节,机械解离法和酶消化法的操作细节不同,会导致获取的细胞质量和数量存在差异。不同实验室使用的酶消化时间、温度和酶浓度不同,会使细胞受到的损伤程度不同,进而影响后续类器官的培养。接种和培养方式的差异同样显著,基质胶的品牌、质量和使用浓度不同,会影响类器官的三维生长环境;培养箱的品牌和型号不同,其内部的温度、湿度和气体分布均匀性也会有所不同,这些因素都会对实验结果产生影响,导致不同实验室之间的实验结果缺乏可比性。培养稳定性与重复性问题对胃癌类器官研究产生了诸多不利影响。在肿瘤发生发展机制研究中,不稳定的培养条件和不可重复的实验结果,会使研究人员难以准确地观察和分析基因突变、信号通路异常以及细胞 - 细胞相互作用等在肿瘤发生发展过程中的作用,从而得出错误的结论。在药物筛选和药敏试验中,由于实验结果的不可靠,无法准确评估药物的疗效和敏感性,这将直接影响临床个性化治疗方案的制定,可能导致患者接受不恰当的治疗,延误病情。3.1.2 高通量检测的限制高通量检测技术在胃癌类器官研究中具有重要的应用前景,然而目前该技术仍面临诸多限制,制约了其在胃癌类器官研究中的广泛应用。从成本角度来看,高通量检测技术通常需要昂贵的仪器设备,如基因测序仪、蛋白质组学分析仪器等,这些设备的购置成本高昂,一般实验室难以承担。检测过程中需要使用大量的试剂和耗材,进一步增加了实验成本。在基因测序检测中,需要使用高质量的 DNA 提取试剂盒、测序试剂等,这些试剂的价格相对较高,使得每次检测的成本居高不下。对于大规模的胃癌类器官研究,需要进行多次高通量检测,这将带来巨大的经济负担,限制了研究的规模和范围。技术复杂性也是高通量检测面临的一大挑战。高通量检测技术涉及多个学科领域的知识和技术,如生物学、化学、物理学、计算机科学等,操作过程复杂,需要专业的技术人员进行操作和维护。在基因测序过程中,需要对样本进行处理、文库构建、测序反应等多个步骤,每个步骤都需要严格控制实验条件和操作规范,否则容易出现误差和错误。数据处理和分析也是高通量检测的难点之一,高通量检测会产生海量的数据,如何对这些数据进行有效的处理、分析和解读,提取有价值的信息,是目前面临的重要问题。需要运用复杂的生物信息学算法和数据分析软件,对数据进行比对、注释、统计分析等,这对研究人员的专业知识和技能要求较高。检测指标的有限性也限制了高通量检测技术在胃癌类器官研究中的应用。目前的高通量检测技术虽然能够检测多种生物分子,但对于一些与胃癌密切相关的生物标志物和细胞功能指标,仍存在检测能力不足的问题。在胃癌类器官研究中,一些关键的细胞信号通路分子、肿瘤微环境相关因子等,现有的高通量检测技术可能无法准确检测其表达水平和活性变化。对于一些低丰度的生物分子,由于检测灵敏度的限制,也难以进行有效的检测和分析。这使得研究人员无法全面、深入地了解胃癌类器官的生物学特性和分子机制,限制了高通量检测技术在胃癌类器官研究中的应用价值。为了解决高通量检测的限制问题,需要采取一系列措施。加大对高通量检测技术研发的投入,鼓励科研人员开发低成本、高灵敏度、高特异性的检测技术和方法,降低检测成本,提高检测效率。加强对技术人员的培训,提高其专业技能和操作水平,确保高通量检测技术的准确应用。建立完善的数据处理和分析平台,开发更加智能化、高效的数据处理和分析软件,提高数据处理和分析的能力。不断拓展检测指标的范围,开发新的检测技术和方法,提高对胃癌相关生物标志物和细胞功能指标的检测能力,为胃癌类器官研究提供更全面、准确的信息。3.1.3 模拟肿瘤微环境的不足肿瘤微环境是一个复杂的系统,包含多种细胞类型、细胞外基质以及各种信号分子,这些成分之间相互作用,共同影响肿瘤的发生、发展和转移。虽然胃癌类器官在一定程度上能够模拟肿瘤的部分特征,但在模拟肿瘤微环境方面仍存在明显的不足。在细胞组成方面,胃癌类器官虽然包含了胃癌细胞、癌相关成纤维细胞、免疫细胞等多种细胞类型,但与真实的肿瘤微环境相比,细胞的比例和分布可能存在差异。在真实的肿瘤组织中,免疫细胞的种类和数量众多,包括 T 细胞、B 细胞、自然杀伤细胞、巨噬细胞等,它们在肿瘤免疫监视和免疫逃逸中发挥着重要作用。在胃癌类器官中,免疫细胞的组成和功能可能无法完全模拟体内情况,这会影响对肿瘤免疫微环境的研究。巨噬细胞在肿瘤微环境中具有多种功能,包括吞噬肿瘤细胞、分泌细胞因子等,但在胃癌类器官中,巨噬细胞的功能可能受到限制,无法准确反映其在体内的作用。细胞外基质是肿瘤微环境的重要组成部分,它不仅为细胞提供物理支持,还参与细胞的信号传导、增殖、分化等过程。目前的胃癌类器官培养体系中,使用的基质胶虽然能够提供一定的三维生长支架,但与体内的细胞外基质相比,其成分和结构仍存在较大差异。体内的细胞外基质由多种蛋白质、多糖等成分组成,具有复杂的三维结构,能够与细胞表面的受体相互作用,调节细胞的行为。而基质胶主要来源于小鼠肉瘤细胞提取物,成分相对单一,无法完全模拟体内细胞外基质的复杂性和功能。这可能导致胃癌类器官中的细胞与细胞外基质之间的相互作用发生改变,影响细胞的生物学特性和功能。信号传导在肿瘤微环境中起着关键作用,肿瘤细胞与周围细胞之间通过各种信号分子进行通讯,调节细胞的生长、增殖、凋亡等过程。在胃癌类器官中,由于缺乏完整的肿瘤微环境,信号传导通路可能受到影响,无法准确模拟体内的信号传导机制。肿瘤细胞与免疫细胞之间的相互作用依赖于多种信号分子的传递,如细胞因子、趋化因子等,但在胃癌类器官中,这些信号分子的分泌和传递可能与体内不同,导致无法准确研究肿瘤细胞与免疫细胞之间的相互作用。一些生长因子和激素在肿瘤微环境中对肿瘤细胞的生长和转移具有重要影响,但在胃癌类器官中,这些信号分子的浓度和作用方式可能与体内存在差异,影响对肿瘤生长和转移机制的研究。三、病人来源的胃癌类器官研究存在的问题3.2 临床应用面临的障碍3.2.1 与临床实践的衔接困难尽管胃癌类器官在基础研究领域取得了一定的进展,但其研究成果向临床治疗方案的转化过程中仍面临诸多阻碍。在临床实践中,医生需要的是能够直接应用于患者治疗决策的有效工具,而目前胃癌类器官的研究成果与临床实际需求之间存在明显的差距。在药物筛选方面,虽然利用胃癌类器官进行药物筛选能够提供一定的药物敏感性信息,但这些信息如何准确地转化为临床用药方案,仍然是一个亟待解决的问题。不同实验室的胃癌类器官培养条件和药物筛选方法存在差异,导致实验结果缺乏一致性和可比性。这使得临床医生难以根据这些结果来确定患者的最佳治疗药物和剂量,增加了临床决策的难度。目前的药物筛选研究主要集中在单一药物的测试上,而在临床治疗中,往往需要采用联合用药的方案。如何利用胃癌类器官研究联合用药的效果,以及药物之间的相互作用,还需要进一步的探索和研究 。在疾病模型的应用方面,胃癌类器官作为疾病模型,虽然能够模拟肿瘤的一些生物学特性,但与真实的临床病例相比,仍然存在一定的局限性。胃癌类器官无法完全再现患者体内的肿瘤微环境,包括免疫系统、血管系统等因素的影响。这使得基于胃癌类器官的疾病模型在预测肿瘤的发展和治疗反应时,可能存在一定的偏差。在临床实践中,医生需要综合考虑患者的个体差异、病情进展、并发症等多种因素来制定治疗方案,而目前的胃癌类器官研究成果难以全面涵盖这些因素,限制了其在临床实践中的应用 。3.2.2 缺乏统一的标准与规范在胃癌类器官的研究和临床应用中,缺乏统一的标准与规范是一个突出的问题。目前,不同实验室在胃癌类器官的培养、鉴定、药物筛选等方面采用的方法和技术各不相同,这导致研究结果的重复性和可比性较差,严重影响了胃癌类器官研究的发展和临床应用的推广。在培养方面,基质胶的选择、生长因子的组合和浓度、培养基的配方等关键因素在不同实验室之间存在较大差异。这些差异会导致胃癌类器官的生长速度、形态结构、生物学特性等方面出现变化,使得不同实验室的研究结果难以进行比较和验证。在鉴定方面,对于胃癌类器官的鉴定方法也缺乏统一的标准,常用的鉴定方法包括形态学观察、免疫组化、基因表达分析等,但不同实验室在具体操作和判断标准上存在差异,容易导致鉴定结果的不准确。在药物筛选方面,药物的种类、浓度、作用时间等实验条件也没有统一的标准,这使得不同实验室的药物筛选结果难以相互印证,无法为临床治疗提供可靠的依据。缺乏统一的标准与规范还会影响胃癌类器官生物样本库的建设和应用。不同来源的胃癌类器官在质量和特性上存在差异,难以进行有效的整合和分析,限制了生物样本库的功能和价值。建立统一的标准与规范对于胃癌类器官的研究和临床应用至关重要。统一的标准与规范可以确保研究结果的可靠性和可比性,促进不同实验室之间的交流与合作,加速胃癌类器官研究的进展。统一的标准与规范也有助于将胃癌类器官研究成果转化为临床应用,提高临床治疗的效果和安全性。需要学术界、科研机构、临床医生等各方共同努力,制定出一套科学、合理、可行的标准与规范,推动胃癌类器官研究和临床应用的健康发展 。3.2.3 伦理与法律问题探讨胃癌类器官研究涉及一系列伦理和法律问题,这些问题不仅关系到患者的权益和福祉,也影响着研究的合法性和可持续性。在样本获取方面,需要确保获取过程的合法性和合规性,充分尊重患者的知情权和隐私权。患者在提供肿瘤组织样本时,应当充分了解样本的用途、可能的风险和受益,并签署知情同意书。然而,在实际操作中,可能存在患者对知情同意书内容理解不充分,或者知情同意过程不规范的情况。在一些紧急情况下,可能无法及时获得患者的知情同意,这就需要在伦理和法律的框架内,寻找合理的解决方案,以确保样本获取的合法性和伦理合理性。隐私保护也是胃癌类器官研究中不容忽视的问题。患者的肿瘤组织样本包含大量的个人信息和生物信息,这些信息一旦泄露,可能会对患者的隐私和权益造成损害。在研究过程中,需要采取严格的措施来保护患者的隐私,对样本进行匿名化处理,使用加密技术保护数据的安全,建立完善的信息管理制度,确保患者的隐私得到充分的保护。知识产权问题在胃癌类器官研究中也日益凸显。随着研究的深入和成果的不断涌现,涉及胃癌类器官的知识产权纠纷也逐渐增多。研究成果的归属、专利的申请和保护等问题需要明确的法律规定和合理的解决方案。在研究过程中,不同研究团队之间可能存在合作和交流,如何确定合作成果的知识产权归属,避免知识产权纠纷,也是需要关注的问题。还需要加强对知识产权的保护意识,鼓励研究人员积极申请专利,保护自己的研究成果,促进胃癌类器官研究领域的创新和发展 。四、病人来源的胃癌类器官未来发展方向4.1 技术创新与突破4.1.1 新型培养技术与材料的研发微流控技术在胃癌类器官培养中展现出巨大的应用前景。该技术基于微机电系统(MEMS)技术,通过在微芯片上构建微通道网络,实现对微小体积流体的精确控制。在胃癌类器官培养中,微流控芯片能够为细胞提供更加精确和稳定的微环境。它可以精确控制营养物质的浓度和流速,使营养物质能够均匀地分布到类器官的各个部位,满足细胞生长和代谢的需求,避免因营养物质分布不均导致的细胞生长差异。微流控芯片还能够实时监测和调控培养环境中的氧气、二氧化碳等气体浓度,为类器官的生长提供适宜的气体环境。通过在微流控芯片中设置不同的微通道和培养区域,可以实现对多个类器官样本的并行培养和检测,大大提高了实验效率,有利于大规模的药物筛选和机制研究。3D 打印技术也为胃癌类器官培养带来了新的机遇。该技术能够根据设计的三维模型,通过层层堆积材料的方式构建出具有特定结构和功能的物体。在胃癌类器官培养中,利用 3D 打印技术可以定制具有精确结构和成分的支架材料。可以打印出与胃组织细胞外基质相似的三维结构支架,为胃癌细胞提供更接近体内环境的生长支撑。这种支架不仅能够提供物理支撑,还可以通过在材料中添加特定的生长因子和信号分子,调节细胞的生长、分化和迁移。3D 打印技术还可以实现个性化的培养,根据患者的具体情况和需求,打印出适合其胃癌类器官生长的独特支架,提高类器官的培养质量和稳定性 。新型生物材料的研发也是胃癌类器官培养技术创新的重要方向。理想的新型生物材料应具备良好的生物相容性、生物可降解性和生物活性。一些基于天然高分子材料的新型生物材料,如胶原蛋白、壳聚糖、海藻酸钠等,因其具有良好的生物相容性和生物活性,在胃癌类器官培养中受到了广泛关注。胶原蛋白是一种天然的细胞外基质成分,能够为细胞提供良好的黏附位点和生长环境,促进细胞的增殖和分化。通过对胶原蛋白进行改性和修饰,可以调节其降解速度和力学性能,使其更适合胃癌类器官的培养。一些合成高分子材料,如聚乳酸 - 羟基乙酸共聚物(PLGA)、聚己内酯(PCL)等,也因其具有可控的降解速度和良好的力学性能,在胃癌类器官培养中具有潜在的应用价值。这些合成高分子材料可以通过与天然高分子材料复合,制备出具有更好性能的生物材料,为胃癌类器官的培养提供更多的选择 。4.1.2 多组学技术的整合应用多组学技术整合分析在胃癌类器官研究中具有重要作用,能够深入挖掘胃癌的分子标志物和治疗靶点,为胃癌的精准治疗提供理论依据。基因组学是研究生物体基因组的组成、结构和功能的学科。在胃癌类器官研究中,通过全基因组测序、外显子测序等技术,可以全面了解胃癌类器官的基因突变情况。研究发现,在胃癌类器官中,存在多种与肿瘤发生发展相关的基因突变,如 TP53、KRAS、PIK3CA 等基因的突变。这些基因突变可以影响细胞的增殖、凋亡、迁移等生物学过程,从而推动肿瘤的发展。通过对这些基因突变的分析,可以筛选出与胃癌发生发展密切相关的关键基因,为肿瘤的早期诊断和治疗提供潜在的分子标志物 。转录组学是研究生物体转录本的组成、结构和功能的学科。利用 RNA 测序技术对胃癌类器官进行转录组分析,可以全面了解基因的表达情况,揭示基因的转录调控网络。在转录组分析中,发现胃癌类器官中存在许多差异表达的基因,这些基因参与了多种生物学过程,如细胞周期调控、信号传导、代谢等。通过对差异表达基因的功能分析,可以深入了解胃癌的发病机制,寻找潜在的治疗靶点。研究发现,一些与细胞周期调控相关的基因在胃癌类器官中表达异常,通过调节这些基因的表达,可以抑制胃癌细胞的增殖,为胃癌的治疗提供新的思路 。蛋白质组学是研究生物体蛋白质的组成、结构和功能的学科。采用质谱技术对胃癌类器官进行蛋白质组分析,可以全面了解蛋白质的表达和修饰情况,揭示蛋白质 - 蛋白质相互作用网络。在蛋白质组分析中,能够发现许多与胃癌相关的差异表达蛋白质,这些蛋白质参与了肿瘤的发生、发展和转移等过程。通过对这些差异表达蛋白质的功能研究,可以深入了解胃癌的生物学特性,寻找新的治疗靶点和生物标志物。研究发现,一些与肿瘤转移相关的蛋白质在胃癌类器官中表达上调,通过抑制这些蛋白质的功能,可以降低胃癌细胞的转移能力,为胃癌的治疗提供新的策略 。代谢组学是研究生物体代谢产物的组成、结构和功能的学科。利用核磁共振(NMR)、质谱(MS)等技术对胃癌类器官进行代谢组分析,可以全面了解代谢产物的变化情况,揭示肿瘤细胞的代谢特征和代谢途径。在代谢组分析中,能够发现胃癌类器官中存在许多差异代谢物,这些代谢物参与了肿瘤细胞的能量代谢、脂质代谢、氨基酸代谢等过程。通过对这些差异代谢物的分析,可以深入了解胃癌的代谢机制,寻找潜在的治疗靶点和生物标志物。研究发现,一些与能量代谢相关的代谢物在胃癌类器官中水平异常,通过调节这些代谢物的水平,可以影响肿瘤细胞的生长和存活,为胃癌的治疗提供新的方向 。将基因组学、转录组学、蛋白质组学和代谢组学等多组学技术进行整合分析,能够从多个层面全面了解胃癌类器官的分子特征和生物学行为。通过整合多组学数据,可以构建更加全面和准确的胃癌分子调控网络,深入揭示胃癌的发病机制和耐药机制,为胃癌的精准治疗提供更多的靶点和策略。通过整合基因组学和转录组学数据,可以发现基因突变与基因表达之间的关联,进一步了解肿瘤的发生发展机制。整合蛋白质组学和代谢组学数据,可以揭示蛋白质与代谢产物之间的相互作用,为肿瘤的治疗提供新的思路 。4.1.3 构建更复杂的肿瘤模型构建包含多种细胞类型和模拟肿瘤微环境的胃癌类器官模型,是胃癌研究领域的重要发展方向,对于深入理解肿瘤的发生、发展和转移机制具有重要意义。在细胞类型方面,除了胃癌细胞,还应纳入癌相关成纤维细胞、免疫细胞、血管内皮细胞等多种细胞类型。癌相关成纤维细胞在肿瘤微环境中起着重要作用,它可以分泌多种细胞因子和生长因子,如转化生长因子 - β(TGF - β)、血小板衍生生长因子(PDGF)等,这些因子可以调节胃癌细胞的生长、存活和迁移。免疫细胞在肿瘤免疫监视和免疫逃逸中发挥着关键作用,T 细胞、B 细胞、巨噬细胞等免疫细胞与胃癌细胞之间存在复杂的相互作用。血管内皮细胞则参与肿瘤血管的生成,为肿瘤细胞提供营养和氧气,促进肿瘤的生长和转移。通过将这些细胞类型共同培养在胃癌类器官模型中,可以更真实地模拟肿瘤微环境中细胞间的相互作用,深入研究肿瘤的生物学行为 。为了更好地模拟肿瘤微环境,需要优化细胞外基质和信号传导通路。在细胞外基质方面,除了现有的基质胶,还应探索开发更接近体内细胞外基质成分和结构的材料。可以利用生物工程技术,合成含有多种细胞外基质成分的复合材料,如将胶原蛋白、层粘连蛋白、纤连蛋白等成分按一定比例组合,制备出更适合细胞生长和相互作用的基质材料。还可以在基质材料中添加一些生物活性分子,如生长因子、细胞因子等,进一步调节细胞的行为。在信号传导通路方面,需要深入研究肿瘤微环境中各种信号通路的激活和抑制机制,通过添加特定的信号通路调节剂,如小分子抑制剂、激动剂等,精确调控信号传导,使胃癌类器官模型更准确地模拟体内肿瘤微环境的信号传导状态 。构建更复杂的胃癌类器官模型具有多方面的意义。它能够更真实地反映肿瘤的生物学特性,为肿瘤发生发展机制的研究提供更可靠的模型。通过在模型中研究不同细胞类型之间的相互作用和信号传导,有助于揭示肿瘤的发生、发展和转移的分子机制,为开发新的治疗靶点和治疗方法提供理论基础。更复杂的胃癌类器官模型在药物筛选和药敏试验中具有更高的准确性和可靠性。由于模型更接近体内肿瘤微环境,能够更准确地预测药物对肿瘤细胞的作用效果,为临床个性化治疗方案的制定提供更有力的支持。这种模型还有助于研究肿瘤免疫治疗的机制和效果,通过模拟肿瘤免疫微环境,探索如何增强机体对肿瘤的免疫监视和杀伤能力,为肿瘤免疫治疗的发展提供新的思路和方法 。4.2 临床应用的拓展与深化4.2.1 个性化治疗方案的制定胃癌类器官在个性化治疗方案的制定中具有重要作用,能够为临床医生提供精准的用药指导,提高治疗效果。利用胃癌类器官进行药物筛选,是制定个性化治疗方案的关键步骤。通过将患者来源的胃癌类器官暴露于不同的化疗药物和靶向药物中,观察类器官的生长、增殖和凋亡等反应,能够准确评估患者对不同药物的敏感性。中山大学李晓星研究员团队构建的胃癌类器官生物样本库,从 73 例胃癌患者中成功建立 57 例胃癌患者来源的类器官,并对六种常用化疗药物进行了药物敏感性测试。实验结果显示,不同分型的胃癌患者来源的 PDO 对化疗药物的反应存在明显差异,弥漫浸润型胃癌来源的 PDO 对 5 - 氟尿嘧啶(5 - FU)和紫杉醇更为敏感 。这些结果为临床医生根据患者的胃癌分型选择合适的化疗药物提供了重要依据,有助于提高化疗的疗效,减少无效治疗。在实际临床应用中,根据胃癌类器官药物筛选结果制定个性化治疗方案的流程通常包括以下几个环节。在患者确诊为胃癌后,获取患者的肿瘤组织,建立胃癌类器官。将胃癌类器官分别与不同的化疗药物和靶向药物进行孵育,设置合适的药物浓度梯度和作用时间。通过检测类器官的细胞活力、增殖能力、凋亡情况等指标,评估类器官对不同药物的反应。根据药物筛选结果,结合患者的身体状况、病情进展等因素,制定个性化的治疗方案,选择最适合患者的药物和治疗剂量。在治疗过程中,还可以根据患者的治疗反应和病情变化,利用胃癌类器官进行动态监测和调整治疗方案,以确保治疗的有效性和安全性 。除了药物筛选,胃癌类器官还可以用于预测患者对其他治疗方法的反应,如放疗、免疫治疗等。通过模拟放疗过程,观察胃癌类器官在辐射后的生物学变化,能够预测患者对放疗的敏感性和耐受性。将胃癌类器官与免疫细胞共培养,研究肿瘤细胞与免疫细胞之间的相互作用,有助于评估患者对免疫治疗的反应,为免疫治疗方案的制定提供参考。通过对胃癌类器官的研究,还可以深入了解肿瘤的耐药机制,为克服肿瘤耐药提供新的策略,进一步优化个性化治疗方案 。4.2.2 临床试验的开展与推进胃癌类器官相关临床试验的开展,为验证胃癌类器官在临床应用中的有效性和安全性提供了重要途径,有助于推动胃癌类器官技术从实验室研究走向临床实践。目前,胃癌类器官相关临床试验正在逐步推进,一些研究已经取得了初步成果。在药物研发方面,利用胃癌类器官进行药物筛选和药敏试验,能够更准确地评估药物的疗效和安全性,为新药的研发和临床试验提供有力支持。一些研究通过对胃癌类器官进行药物筛选,发现了一些潜在的治疗靶点和药物,为胃癌的治疗提供了新的选择 。在临床治疗方面,一些临床试验尝试将胃癌类器官技术应用于患者的个性化治疗。通过建立患者来源的胃癌类器官,进行药物敏感性测试,为患者制定个性化的治疗方案,并观察治疗效果。这些临床试验的结果表明,胃癌类器官技术在指导个性化治疗方面具有一定的潜力,能够提高治疗的针对性和有效性 。开展胃癌类器官相关临床试验也面临着诸多挑战。技术标准的统一是一个关键问题,目前不同实验室在胃癌类器官的培养、鉴定、药物筛选等方面采用的方法和技术各不相同,这导致研究结果的重复性和可比性较差,难以进行有效的临床试验。临床试验的设计和实施也需要进一步优化,需要考虑到胃癌类器官技术的特点和临床实际需求,制定合理的试验方案和评价指标。临床试验的样本量相对较小,这限制了研究结果的普遍性和可靠性,需要进一步扩大样本量,进行多中心、大规模的临床试验 。为了克服这些挑战,未来需要加强学术界、科研机构、临床医生等各方的合作,共同制定统一的技术标准和规范,确保临床试验的质量和可靠性。需要优化临床试验的设计和实施,充分考虑胃癌类器官技术的优势和局限性,制定科学合理的试验方案和评价指标。还需要加大对临床试验的投入,扩大样本量,进行多中心、大规模的临床试验,以验证胃癌类器官技术在临床应用中的有效性和安全性 。随着技术的不断进步和临床试验的深入开展,胃癌类器官相关临床试验有望取得更多的突破。未来,胃癌类器官技术可能会成为胃癌治疗的重要手段之一,为患者提供更加精准、有效的治疗方案。通过与其他新兴技术的结合,如人工智能、基因编辑等,胃癌类器官技术在临床试验中的应用前景将更加广阔,有望推动胃癌治疗领域的重大变革 。4.2.3 与其他治疗手段的联合应用胃癌类器官与免疫治疗、靶向治疗和手术治疗等其他治疗手段联合应用,具有广阔的前景和优势,能够为胃癌患者提供更加综合、有效的治疗方案。在与免疫治疗联合应用方面,胃癌类器官可以作为研究肿瘤免疫微环境和免疫治疗机制的重要工具。通过将胃癌类器官与免疫细胞共培养,能够深入研究肿瘤细胞与免疫细胞之间的相互作用,揭示肿瘤免疫逃逸的机制,为开发新的免疫治疗策略提供理论基础。在免疫治疗过程中,利用胃癌类器官进行药物筛选和药敏试验,能够评估免疫治疗药物的疗效和敏感性,为患者选择最适合的免疫治疗方案。将免疫治疗药物与其他治疗手段如化疗、靶向治疗等联合应用时,胃癌类器官可以用于研究药物之间的协同作用和相互影响,优化联合治疗方案。研究发现,免疫检查点抑制剂联合化疗在胃癌治疗中具有较好的疗效,通过胃癌类器官模型可以进一步研究其作用机制和最佳治疗组合 。与靶向治疗联合应用时,胃癌类器官能够为靶向治疗药物的筛选和研发提供有力支持。由于胃癌类器官保留了原发肿瘤的基因图谱和生物学特性,能够准确反映肿瘤细胞对靶向治疗药物的敏感性。通过对胃癌类器官进行靶向治疗药物的筛选,可以发现潜在的治疗靶点和敏感药物,为临床靶向治疗提供指导。在靶向治疗过程中,利用胃癌类器官监测肿瘤细胞对靶向药物的反应,及时调整治疗方案,有助于提高靶向治疗的效果,克服肿瘤耐药问题。一些研究利用胃癌类器官筛选出对特定靶向药物敏感的患者群体,为个性化靶向治疗提供了依据 。在与手术治疗联合应用方面,胃癌类器官可以为手术治疗提供术前评估和术后监测的支持。在术前,通过建立患者来源的胃癌类器官,进行药物敏感性测试和基因检测,能够了解肿瘤的生物学特性和对治疗的反应,为手术方案的制定提供参考。根据胃癌类器官的药敏结果,选择合适的术前辅助治疗方案,能够缩小肿瘤体积,降低手术难度,提高手术切除率。在术后,利用胃癌类器官对患者的肿瘤复发和转移风险进行评估,及时发现潜在的复发和转移迹象,采取相应的治疗措施。通过检测胃癌类器官中的肿瘤标志物和基因表达变化,监测肿瘤的复发和转移情况,为患者的后续治疗提供指导 。胃癌类器官与其他治疗手段的联合应用,能够充分发挥各种治疗手段的优势,实现优势互补,提高胃癌的治疗效果。未来,随着研究的不断深入和技术的不断发展,胃癌类器官在联合治疗中的应用将更加广泛和深入,为胃癌患者带来更多的治疗选择和生存希望 。4.3 跨学科合作与国际交流4.3.1 跨学科合作的重要性胃癌类器官研究的深入发展离不开跨学科合作,它能够整合多个学科的知识和技术,为胃癌类器官研究提供更全面、深入的视角和方法。在胃癌类器官培养技术方面,生物学与工程学的结合为其带来了新的突破。生物学为类器官培养提供了理论基础,明确了细胞生长所需的营养物质、生长因子以及适宜的培养环境等。工程学则通过微流控技术和 3D 打印技术等,为类器官培养提供了更先进的手段。微流控技术基于微机电系统(MEMS)技术,能够精确控制微小体积流体的流动和分布。在胃癌类器官培养中,微流控芯片可以精确控制营养物质的浓度和流速,使营养物质能够均匀地输送到类器官的各个部位,满足细胞生长和代谢的需求。通过微流控芯片,还可以实时监测和调控培养环境中的氧气、二氧化碳等气体浓度,为类器官的生长提供稳定的气体环境。3D 打印技术则能够根据设计的三维模型,定制具有精确结构和成分的支架材料。这些支架材料可以模拟胃组织细胞外基质的结构和功能,为胃癌细胞提供更接近体内环境的生长支撑。通过在支架材料中添加特定的生长因子和信号分子,还可以调节细胞的生长、分化和迁移。医学与计算机科学的合作在胃癌类器官的数据分析和临床应用中发挥着关键作用。医学为研究提供了临床样本和疾病相关的知识,计算机科学则利用大数据分析和人工智能技术,对胃癌类器官的多组学数据进行深入挖掘和分析。在多组学数据分析中,计算机科学能够处理和分析海量的数据,挖掘其中隐藏的信息和规律。通过大数据分析,可以对胃癌类器官的基因组学、转录组学、蛋白质组学和代谢组学等数据进行整合分析,构建更加全面和准确的胃癌分子调控网络,深入揭示胃癌的发病机制和耐药机制。人工智能技术还可以用于预测胃癌类器官对药物的反应,通过训练机器学习模型,利用大量的类器官药物筛选数据和临床病例数据,建立药物反应预测模型,为临床个性化治疗方案的制定提供更准确的依据。跨学科合作在胃癌类器官研究中具有多方面的优势。它能够促进知识和技术的融合,为解决复杂的科学问题提供更多的思路和方法。通过跨学科合作,可以开发出更先进的胃癌类器官培养技术和检测方法,提高类器官的培养质量和稳定性,增强对类器官生物学特性的研究能力。跨学科合作还能够加强不同领域研究人员之间的交流与合作,培养具有跨学科背景的复合型人才,推动胃癌类器官研究领域的创新和发展 。4.3.2 国际交流与合作的展望国际交流与合作在胃癌类器官研究中具有重要意义,能够促进全球范围内的资源共享、经验交流和共同发展,推动胃癌类器官研究取得更大的突破。在资源共享方面,国际合作可以整合全球范围内的胃癌类器官生物样本库资源。不同国家和地区的研究机构拥有各自的胃癌类器官样本,通过国际合作,建立共享平台,能够使研究人员获取更丰富、多样化的样本资源。这有助于开展大规模的研究,深入探讨胃癌的发病机制、分子标志物和治疗靶点等。共享样本资源还可以避免重复劳动,提高研究效率,降低研究成本。通过共享样本库,研究人员可以对不同地区、不同种族的胃癌类器官进行比较研究,了解胃癌的地域和种族差异,为制定个性化的治疗方案提供更全面的依据。在经验交流方面,国际会议和学术交流活动为全球的研究人员提供了重要的平台。在这些活动中,研究人员可以分享各自在胃癌类器官研究中的最新成果和经验。来自不同国家的研究团队可以展示他们在胃癌类器官培养技术、应用研究和临床转化等方面的创新方法和研究进展。通过交流,研究人员可以学习到其他团队的先进技术和研究思路,拓宽自己的研究视野。国际合作还可以促进不同实验室之间的合作研究,共同攻克胃癌类器官研究中的难题。不同实验室在技术、设备和人才等方面具有各自的优势,通过合作研究,可以实现优势互补,提高研究水平。在共同解决问题方面,国际合作能够整合全球的科研力量,共同应对胃癌类器官研究中的挑战。在技术创新方面,各国研究人员可以共同研发新型的培养技术和材料,解决培养稳定性与重复性问题、高通量检测的限制以及模拟肿瘤微环境的不足等技术难题。在临床应用方面,国际合作可以推动胃癌类器官相关临床试验的开展,制定统一的标准与规范,解决与临床实践的衔接困难、伦理与法律问题等。通过国际合作,还可以促进胃癌类器官技术在全球范围内的推广和应用,使更多的患者受益于这一技术。未来,国际交流与合作在胃癌类器官研究中有望取得更多的成果。随着全球化的发展,国际合作将更加紧密和深入。通过建立国际合作联盟、开展联合研究项目等方式,全球的研究人员将能够更有效地整合资源,共同推进胃癌类器官研究的发展。国际交流与合作也将促进胃癌类器官技术与其他新兴技术的融合,如人工智能、基因编辑等,为胃癌的研究和治疗带来更多的创新和突破,为全球胃癌患者的健康福祉做出更大的贡献 。五、结论5.1 研究成果总结本研究系统地探讨了病人来源的胃癌类器官在研究进展、面临问题及未来发展方向等方面的内容。在研究进展上,胃癌类器官的建立与培养技术不断优化,如中山大学李晓星研究员团队成功建立高成功率的胃癌类器官生物样本库,为后续研究奠定了坚实基础。在肿瘤研究应用中,胃癌类器官在肿瘤发生发展机制研究、药物筛选与药敏试验、肿瘤耐药机制探索等方面发挥了重要作用,为深入了解胃癌的生物学特性和临床治疗提供了有力支持。不可否认,病人来源的胃癌类器官研究仍存在诸多问题。技术层面,培养稳定性与重复性问题、高通量检测的限制以及模拟肿瘤微环境的不足,制约了研究的进一步深入和应用。临床应用方面,与临床实践的衔接困难、缺乏统一的标准与规范以及伦理与法律问题,阻碍了胃癌类器官技术在临床治疗中的推广和应用。展望未来,胃癌类器官研究具有广阔的发展前景。在技术创新与突破方面,新型培养技术与材料的研发、多组学技术的整合应用以及构建更复杂的肿瘤模型,将为胃癌类器官研究提供更强大的技术支持和更全面的研究视角。在临床应用拓展与深化方面,个性化治疗方案的制定、临床试验的开展与推进以及与其他治疗手段的联合应用,将使胃癌类器官技术更好地服务于临床治疗,为胃癌患者带来更多的治疗选择和生存希望。跨学科合作与国际交流也将为胃癌类器官研究注入新的活力,促进全球范围内的资源共享、经验交流和共同发展。5.2 研究的局限性与展望尽管病人来源的胃癌类器官研究取得了显著进展,在肿瘤研究和临床应用中展现出巨大潜力,但当前研究仍存在一定局限性。技术层面上,培养稳定性与重复性问题亟待解决,不同实验室在培养条件和操作流程上的差异,导致实验结果难以重复,这限制了研究的可靠性和可推广性。高通量检测的高成本、技术复杂性以及检测指标的有限性,也制约了其在大规模研究中的应用。胃癌类器官在模拟肿瘤微环境方面还存在不足,细胞组成、细胞外基质和信号传导等方面与真实肿瘤微环境存在差异,影响了对肿瘤生物学行为的准确研究。临床应用方面,胃癌类器官研究成果向临床治疗方案的转化面临诸多障碍。与临床实践的衔接困难,研究成果难以直接应用于临床决策;缺乏统一的标准与规范,导致不同研究结果之间缺乏可比性,不利于临床应用的推广;伦理与法律问题也需要进一步探讨和规范,以确保研究的合法性和患者的权益。展望未来,胃癌类器官研究前景广阔。随着技术的不断创新与突破,新型培养技术与材料的研发将为胃癌类器官培养提供更稳定、高效的方法。多组学技术的整合应用将深入挖掘胃癌的分子标志物和治疗靶点,为精准治疗提供更有力的支持。构建更复杂的肿瘤模型,能够更真实地模拟肿瘤微环境,有助于深入研究肿瘤的发生、发展和转移机制。在临床应用方面,胃癌类器官将在个性化治疗方案的制定中发挥更重要的作用,为患者提供更精准的治疗选择。临床试验的开展与推进,将进一步验证胃癌类器官在临床应用中的有效性和安全性,加速其从实验室到临床的转化。与其他治疗手段的联合应用,将实现优势互补,提高胃癌的治疗效果。跨学科合作与国际交流也将为胃癌类器官研究注入新的活力。通过跨学科合作,整合生物学、工程学、医学、计算机科学等多个学科的知识和技术,能够为胃癌类器官研究提供更全面、深入的视角和方法。国际交流与合作将促进全球范围内的资源共享、经验交流和共同发展,推动胃癌类器官研究取得更大的突破,为全球胃癌患者带来更多的希望。END免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。OTC2025论坛深度聚焦类器官与疾病建模、新药发现/研发、3D细胞培养、类器官培养及质控。展位咨询请联系:王晨 180 1628 8769。戳“阅读原文”立即领取OTC2025免费参会名额!
免疫疗法
2024-11-27
OTC2024类器官前沿应用与3D细胞培养论坛圆满落幕,点击图片可查看会后报告,咨询OTC2025类器官论坛请联系:王晨 180 1628 8769。
文章来源:华夏源类器官
文章题目:Patient-Derived Upper Tract Urothelial Carcinoma Organoids as a Platform for Drug Screening
发表期刊:Advanced Science(IF:14.3)
发表日期:2021年12月17日
作者及单位:北京大学第一医院泌尿外科周利群教授团队、李学松教授团队以及深圳市第二人民医院黄卫人教授团队
关键词:#Upper tract urothelial carcinoma #Drug Screening #Personalized medicine
研究内容:上尿路上皮癌(UTUC)是一种罕见的泌尿系统肿瘤,起源于输尿管及肾盂的尿路上皮细胞。该疾病在诊断发现时多发展至晚期,临床治疗效果差,易复发且死亡率高。目前由于缺乏精准反映疾病性质和异质性的模型,UTUC 的病理学研究进展不大。本文所建立的类器官体系成功培养了UTUC 患者来源的类器官,这些类器官保留了患者肿瘤的组织学特征和基因表达谱。进一步的研究表明,通过测试 UTUC 类器官对不同抗癌药物的敏感性,可以为患者筛选有效的治疗药物。总之,本研究提出了一种新的培养方案来生成患者来源的UTUC 类器官,有助于分析不同 UTUC 患者的病理学特性,并针对性的给予个性化药物治疗建议。
1
研究背景
上尿路上皮癌(Upper tract urothelial carcinoma, UTUC)是一种罕见的泌尿生殖系统癌症,占所有尿路上皮癌的 5-10%。虽然发病率低,但患者的复发率和死亡率高。UTUC 标准治疗方法是根治性肾输尿管切除术联合膀胱切除术,对晚期 UTUC 患者进行全身化疗。然而,由于肿瘤的异质性,UTUC患者对不同化疗药物的敏感性不尽相同。个体化精准治疗是改善UTUC患者预后的理想治疗手段,但当前针对UTUC的个体化精准医疗缺乏合适的临床前药物评价模型。
2
研究结果
2.1 患者来源的 UTUC 类器官培养体系的建立
研究团队建立了UTUC类器官的培养方案。文章首先测试了常见的类器官添加剂和生长因子对UTUC样本的作用。通过测试筛选发现,R-spondin1、Noggin、FGF10和SB202190等培养基添加剂对UTUC类器官是非必需的;A83-01则对UTUC类器官的形成至关重要;EGF则降低了大多数UTUC类器官的形成效率。通过对UTUC培养体系的优化,最终从32个临床UTUC样本中生成了25个UTUC类器官。此外,本文还从10个癌旁正常组织中产生6个正常组织类器官作为后续研究的对照组。
△ 建立患者来源的UTUC类器官
2.2 UTUC类器官的组织病理学特征
H&E染色发现,UTUC 组织衍生的类器官为致密的球状结构,内部细胞排列紊乱。正常组织衍生的类器官呈泡状结构,细胞排列整齐。免疫荧光染色结果显示,不同患者来源的UTUC类器官的蛋白表达具有个体化差异,而来自同一患者的肿瘤组织与其衍生的类器官则具有相似的蛋白表达。
全外显子组测序结果也显示,UTUC类器官复现了大多数亲本肿瘤组织中存在的体细胞突变。上述结果均表明,患者来源的 UTUC 类器官保留了亲本肿瘤的组织病理学特征。
△ 患者来源的UTUC类器官保留了亲本肿瘤的组织病理学特征
2.3 基于UTUC类器官的抗肿瘤药物的筛选
接下来,本文对12个UTUC类器官进行了药物敏感性筛选。结果显示,不同UTUC患者来源的肿瘤类器官对于抗肿瘤药物的敏感性存在巨大差异,这表明UTUC类器官可以作为个体化治疗的平台。此外,通过UTUC类器官筛选出的敏感药物,其在不同类器官代数之间依旧敏感,这表明类器官的药物敏感反应是稳定的。
△ 患者来源的UTUC类器官的抗肿瘤药物筛选
2.4 scRNA-seq揭示了UTUC类器官对吉西他滨反应的细胞异质性
UTUC的一线化疗方案是吉西他滨加顺铂,然而肿瘤细胞对吉西他滨的耐药性降低了该方案的治疗效果。本文使用scRNA-seq来研究UTUC治疗中吉西他滨耐药的机制。结果显示,耐药特征基因在吉西他滨处理前已经存在,表明UTUC的耐药性来自已有耐药细胞的增殖。qPCR进一步揭示,间质上皮转换因子c-Met在吉西他滨处理后的耐药细胞中表达上升,而吉西他滨联合c-Met抑制剂卡博替尼可以有效逆转吉西他滨耐药,从而彻底杀死肿瘤细胞。
△ 吉西他滨处理前后UTUC类器官细胞亚群的转变
3
研究结论
本文建立了UTUC类器官的培养体系,能够作为UTUC患者的药物筛选模型。此外,利用UTUC类器官模型,证实UTUC的耐药性来源于已有耐药细胞的增殖;研究进一步发现,c-Met是导致细胞耐药的关键,为UTUC提供了治疗策略的理论和实验依据。
4
研究亮点
● 建立UTUC类器官培养体系:UTUC类器官在组织结构、基因突变、生物标记物和基因表达谱方面保留了亲本肿瘤的特征,可以作为可靠的体外模型,以探究UTUC的病理生理学机制。
● 发现吉西他滨耐药性的机制:发现吉西他滨耐药的细胞亚群在UTUC类器官中始终存在,耐药性的增加源于已有耐药细胞的增殖;吉西他滨处理后会导致细胞中的c-Met表达上升,将c-Met抑制剂与吉西他滨联合使用后,会降低耐药并提高治疗效果。
5
研究路线图
参考文献:
Li Z, Xu H, Gong Y, Zhou L, Huang W. et,al.Patient-Derived Upper Tract Urothelial Carcinoma Organoids as a Platform for Drug Screening. Adv Sci (Weinh). 2022 Feb;9(4):e2103999. doi: 10.1002/advs.202103999. Epub 2021 Dec 16. PMID: 34914855; PMCID: PMC8811809.
END
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
OTC2024类器官前沿应用与3D细胞培养论坛圆满落幕,点击图片可查看会后报告,咨询OTC2025类器官论坛请联系:王晨 180 1628 8769
临床研究
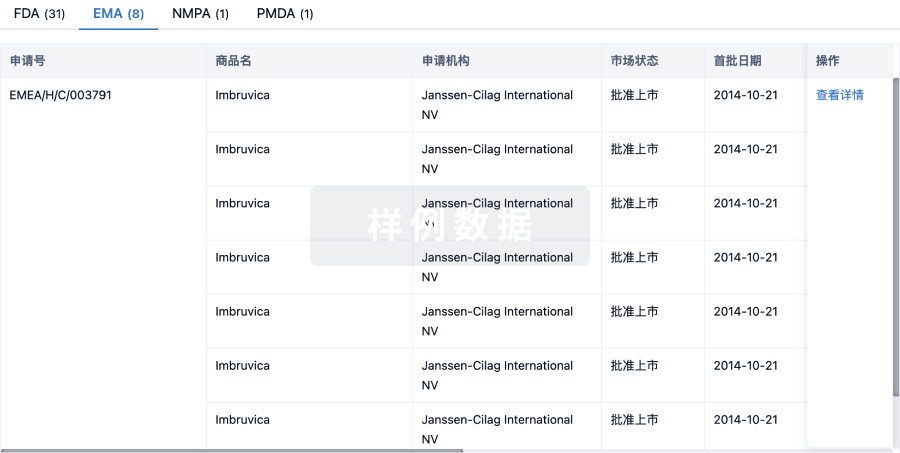
100 项与 A-83-01 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| 肿瘤 | 临床前 | 日本 | 2005-10-14 |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
No Data | |||||||
登录后查看更多信息
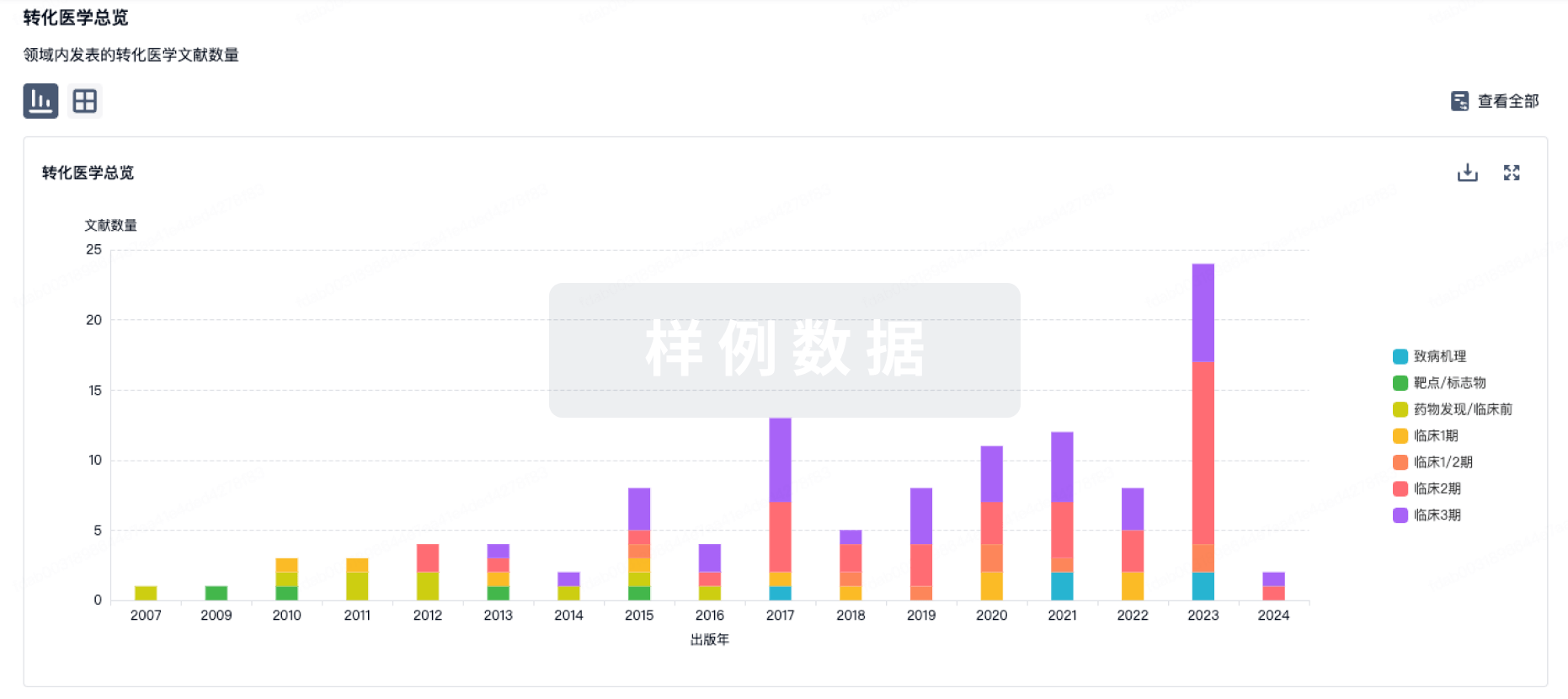
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或
批准
利用最新的监管批准信息加速您的研究。
登录
或
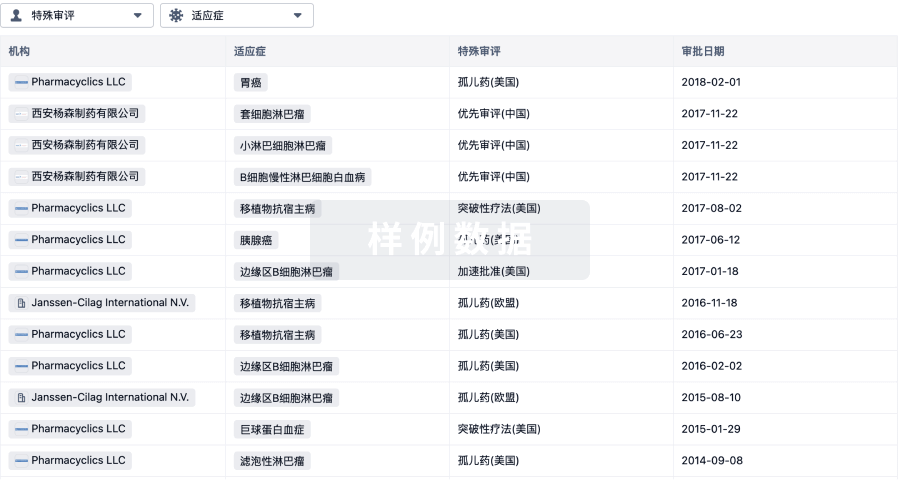
特殊审评
只需点击几下即可了解关键药物信息。
登录
或
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用
