预约演示
更新于:2025-08-06
Clesitamig
更新于:2025-08-06
概要
基本信息
权益机构- |
最高研发阶段临床1期 |
首次获批日期- |
最高研发阶段(中国)- |
特殊审评- |
登录后查看时间轴
结构/序列
Sequence Code 524000976

来源: *****
Sequence Code 802013022

来源: *****
Sequence Code 802013024

来源: *****
Sequence Code 802013026

来源: *****
关联
2
项与 Clesitamig 相关的临床试验NCT07107490
AN OPEN-LABEL, MULTICENTER PHASE I STUDY TO EVALUATE THE SAFETY, TOLERABILITY, PHARMACOKINETICS, PHARMACODYNAMICS, AND PRELIMINARY ANTI-TUMOR ACTIVITY OF ALPS12 IN PATIENTS WITH EXTENSIVE STAGE SMALL CELL LUNG CANCER
This study is a phase I, open-label, multicenter trial designed to evaluate the safety, tolerability, pharmacokinetics, immunogenicity, and antitumor activity of ALPS12 in patients with extensive-stage small cell lung cancer. The study consists of two parts: a dose-escalation part and an expansion part.
开始日期2025-09-01 |
NCT05619744
An Open-Label, Multicenter Phase I Study to Evaluate the Safety, Tolerability, Pharmacokinetics, Pharmacodynamics, and Preliminary Anti-Tumor Activity of RO7616789 in Participants With Advanced Small Cell Lung Cancer and Other Neuroendocrine Carcinomas
The purpose of this study is to evaluate the safety, tolerability, pharmacokinetics (PK), pharmacodynamics (PD) and preliminary anti-tumor activity of RO7616789. The study will have 3 parts: Dose Escalation (Parts 1 and 2) and Dose Expansion (Part 3). Participants with advanced stage small cell lung cancer (SCLC) and neuroendocrine carcinoma (NEC) will be enrolled in the study.
开始日期2023-01-23 |
申办/合作机构 |
100 项与 Clesitamig 相关的临床结果
登录后查看更多信息
100 项与 Clesitamig 相关的转化医学
登录后查看更多信息
100 项与 Clesitamig 相关的专利(医药)
登录后查看更多信息
7
项与 Clesitamig 相关的新闻(医药)2025-06-19
·氨基观察
氨基观察-创新药组原创出品作者 | 沙晓微围绕DLL3(Delta样配体3)靶点的竞争,日趋激烈,已经从双抗进入到三抗时代。罗氏的RO7616789、默沙东的MK-6070,都是已进入临床阶段的靶向DLL3的三抗。如今,国内企业也在加入这场竞争。在今年的ASCO大会上,泽璟制药的DLL3三特异性抗体药物ZG006引发了市场关注。ZG006能否成功尚不得而知,但它仍然预示着,随着市场对DLL3靶点兴趣度的增加,对技术和理念的要求也将变得更高。/ 01 /三抗的野心DLL3靶点的热度,是由双抗带动起来的,其中的主角是安进的Tarlatamab。2024年5月16日,FDA加速批准了Tarlatamab用于治疗广泛期小细胞肺癌(ES-SCLC)患者。相比TCE,三抗则通过“共刺激”或“多价结合”的设计,试图在稳定安全性的前提下提高抗肿瘤疗效。从分子结构上看,ZG006是一种靶向CD3与两个不同DLL3表位的三特异性抗体。其设计理念在于,通过不同DLL3表位的识别实现双位点识别。在此基础上,抗CD3结合T细胞,将T细胞拉近肿瘤细胞,并利用T细胞特异性杀伤肿瘤细胞。这样的药物设计使得在低表达肿瘤背景下也能形成稳定的整合。ZG006的“双重靶向+单点激活”设计在稳定安全性的前提下提高疗效,同时降低非特异性T细胞活化风险。除了泽璟制药的ZG006,罗氏的RO7616789以及默沙东的MK-6070都是已进入临床阶段的靶向DLL3的三特异性抗体。其中,MK-6070是默沙东斥资6.8亿美金收购Harpoon Therapeutics,所获得的一款靶向DLL3/CD3/Ablumin的三抗。与ZG006不同的是,其靶向DLL3的抗体为纳米抗体,结合CD3的抗体为scFv形式,而Ablumin的加入目的是为了延长半衰期。/ 02 /未来谁能脱颖而出三抗能否脱颖而出还不得而知,但充分说明了市场对于DLL3的期待。DLL3作为一种Notch抑制配体,其过表达可促进小细胞肺癌细胞的生长及迁移侵袭能力,还参与影响肿瘤对铂类化疗的耐药性。超过80%的SCLC和其他高级神经内分泌癌(NEC)细胞表面过表达DLL3蛋白,这种与正常细胞差异表达及定位特征使其成为SCLC的重要治疗靶点。考虑到SCLC当前有效疗法稀缺,自然也会吸引药企不断入局。在DLL3靶点上,不仅有TCE的竞争, ADC的表现同样不可忽视。提到DLL3的ADC药物,都会想到艾伯维的Rova-T。早期临床研究结果出色,使其直接跳过二期临床开展大规模的三期实验,但最终未能成功闯关。艾伯维58亿美元的教训,并没有阻挡DLL3在ADC领域的前进。就在今年5月16日,恒瑞医药登记了一项DLL3 ADC药物SHR-4849,并宣布启动一项联合其他抗肿瘤药物在恶性实体瘤患者的多中心、开放标签的二期临床研究。在早期临床试验中,11位可评估的SCLC患者中,SHR-4849取得73%的客观缓解率(ORR),且安全性较好。再鼎医药的DLL3 ADC药物ZL-1310同样表现喜人。刚刚落幕的ASCO 2025大会上,再鼎医药公布了ZL-1310治疗ES-SCLC全球1a/1b期临床数据。在74例可评估患者中,ORR达67%,并在22例存在脑转移患者中观察到68%的ORR。可以说,在DLL3这个“老”靶点上,技术迭代带来的惊喜会一直存在。当然,对于部分入局者来说,如果实力不够,也可能意味着被淘汰。PS:欢迎扫描下方二维码,添加氨基君微信号交流。
抗体药物偶联物ASCO会议临床2期免疫疗法加速审批
2025-01-20
·动脉网
双抗正值风口,三抗已初露苗头。
2025年1月13日,先声药业旗下抗肿瘤创新药公司先声再明宣布,已与全球制药公司艾伯维(AbbVie)就其处于中国和美国进行临床1期研究阶段的,GPRC5DxBCMAxCD3的TCE三抗管线SIM0500达成许可选择协议,艾伯维将支付给先声再明一定的预付款以及最高10.55亿美元的选择性权益付款和里程碑付款,以及大中华区以外地区的销售分成。
尽管单克隆抗体和双特异性抗体在临床治疗上都发挥了至关重要的作用,但对于恶性肿瘤的治疗疗效仍然有限。随着抗体药物的发展,同时靶向三个特异性抗原结合位点的三特异性抗体,在肿瘤治疗领域展现了非凡的应用前景。
与双特异性抗体相比,三特异性抗体还能够与肿瘤细胞或免疫细胞表面的另一个靶点相结合,或桥接免疫细胞并阻断双信号通路等作用,更有利于将药物或免疫细胞重定向至肿瘤部位,增强结合特异性,提高靶向性,降低脱靶毒性,从而提升抗肿瘤能力。
因此,虽然当下全球暂时没有三抗药物获批,可是已经有不少中国Biotech布局其中。同时,MNC也从2024年开始布局,或许我们将在2025年的BD交易中看到越来越多的三抗管线。
01
MNC悄然入局
2024年三抗的交易数量超过了过去3年的总和且总额近80亿美元。
与双抗的双靶点相比,三抗的抗体组合更加丰富多样,也为抗体药物的研发提供了更多的空间。因此,MNC开始通过并购、许可交易以及股权投资等方式入局三抗/多抗赛道。
近几年三抗交易情况,据公开信息收集整理
可以看到,包括辉瑞、艾伯维、GSK、吉利德以及默沙东这些MNC在2024年都已出手,特别是默沙东一年内就花了近40亿美元并购两家专注于三抗药物开发的公司,可见其对三抗的态度。
其中,以30亿美元卖给默沙东的EyeBio值得一说。EyeBio成立于2021年,迄今为止融资1.3亿美元,而默沙东早在A轮就参与其中。2024年2月,EyeBio公布了其核心管线EYE103的1b/2a期临床积极数据,随后在5月,默沙东便出手并购,到了8月,Clinicaltrials网站便出现了EYE103临床2/3期试验的信息,可谓是惟快不破。
默沙东在2024年1月并购Harpoon的交易则更凸显默沙东对三抗的看好。此次交易除了收获临床中颇具前景的DLL3/CD3抗体管线外(MK6070),还得到了Harpoon多个三特异抗体平台,其中包括在肿瘤微环境中特异性激活的ProTriTAC和TriTAC-XR三特异抗体平台这一前瞻性技术平台。
值得注意的是,据Insight数据库信息,MK6070和罗氏的RO7616789以及泽璟生物的ZG006是全球范围内仅有的三款进入临床阶段的靶向DLL3的三抗管线。到了8月份,第一三共与默沙东签订MK6070的全球共同开发和商业化协议(默沙东保留该药在日本的独家权力),第一三共将付出1.7亿美元的首付款。
有意思的是Harpoon也曾出现在艾伯维的故事里,早在2019年,艾伯维以3000万美元+5000万美元的里程碑付款获得了Harpoon旗下一条三抗管线的全球独家授权。只是后来艾伯维对其重视不够,将权益退回。
此次艾伯维花大价钱收购先声再明的三抗管线,很有可能是受到竞争对手的影响。例如强生旗下就拥有CD38单抗、BCMA-CAR-T、BCMAxCD3双抗、甚至GPRC5DxCD3双抗等多个多发性骨髓瘤(MM)领域产品,而艾伯维自身仅有一款BCMAxCD3双抗似乎显得势单力薄。
先声再明的GPRC5D/BCMA/CD3三抗在前期研究中表现出了针对MM细胞的强大T细胞毒性效应,肿瘤杀伤效果显著,耐受性好,起效剂量低,停药后肿瘤不复发等多重优势。对艾伯维而言,既然错过了GPRC5D/CD3双抗,直接入局BCMA/GPRC5D/CD3三抗也不失为一种选择。
从这些并购事件不难看出,进入临床阶段的三抗管线拥有较高的交易价值。此外,涉及热门靶点的三抗管线,也极具BD潜力。目前,全球的三抗管线已经开始向肿瘤和自免这两大市场推进。
02
超100条管线在研,默沙东靠并购领先
三抗的多样性带来的更多可能性,让药企趋之若鹜。
尽管目前尚未有三抗药物获批,但已有多家生物医药企业布局三特异性抗体,并研发设计出具有迭代优势的靶点组合药物。据不完全统计,目前全球三抗药物管线已超百条,其中约有一半已进入临床阶段,只是大多数尚处于临床早期阶段。
部分在研三抗管线,据公开信息整理
MNC中,赛诺菲布局较多,如靶向Anti-CD3/CD38/CD28的SAR442257,其介导了强烈的肿瘤细胞杀伤作用,与抗CD38单抗相比,SAR442257在体外对CD38高表达和CD38低表达的MM细胞均表现出高3~4个数量级的杀伤效力。SAR443579(NKp46/CD16/CD123)则有可能成为血液瘤患者的新选择。辉瑞开发的Anti-IL-13/IL-4/TSLP(PF-07275315),属于三功能融合蛋白,针对特应性皮炎已进入临床2期。
从时间上来看,全球的三抗/多抗管线从2021年开始大幅增长,国内同样也是从这一年开始出现增长。到了2024年,已经有多家中国Biotech布局三抗赛道,仅这一年,国内就有超过10条三抗1类新药管线首次在国内获批IND,进展较快的包括天广实、百利天恒、神州细胞、信达生物、嘉和生物、泽璟生物、恩沐生物、博锐生物以及普米斯等。
从适应症分布来看,三抗延续了单抗和双抗类药物类似的思路,最热门的领域依然是肿瘤,整体管线占比超过50%,毕竟抗肿瘤药物市场需求大、医保覆盖范围广,企业有推动创新的动力。
03
国产三抗百花齐放
国内药企正悄然加速三抗赛道的研发。
如基石药业在2024年底宣布旗下用于治疗多种实体瘤的管线CS2009(PD-1/VEGF/CTLA-4三特异性抗体)已在澳大利亚递交临床试验申请。受此消息影响,公司股价一度上涨7%。
市场之所以如此热情,既有康方双抗在2024年的铺垫,也有市场对于后续三抗爆发的期待。
从作用机制来看,PD-1/VEGF/CTLA-4三特异性抗体相对于康方PD-1/VEGF双抗,anti-CTLA-4能促进更多初始T细胞激活、迁移浸润至肿瘤组织。在第39届癌症免疫治疗学会年会上基石药业公布的临床前数据显示,CS2009展示出优于潜在竞品(包括PD-1/CTLA-4双抗、PD-1/VEGFA双抗以及抗PD-1/抗CTLA-4联合疗法)的抗肿瘤活性。
此外,阿斯利康的PD-1/CTLA-4双抗目前也有4项适应症(非小细胞肺癌、胸膜间皮瘤、宫颈癌和头颈鳞癌)处于临床3期阶段,且从前期数据来推断成功概率较高。并且这些靶点都是成熟靶点,组合之下能覆盖包括非小细胞肺癌、卵巢癌、肾细胞癌、宫颈癌、肝细胞癌、胃癌等多个肿瘤适应症。同时对于PD-(L)1疗法响应不佳的PD-L1低表达或PD-L1阴性的群体也能进一步获益。
如果说康方的PD-1/VEGF双抗有希望向K药发起冲击,那么基石药业和宏成药业都有布局的PD-1/CTLA-4/VEGF三抗是否也有进一步的空间呢?
三特异性抗体按照作用机制的不同主要分为:T细胞接合器、免疫检查点抑制剂、NK 细胞接合器、靶向三个肿瘤相关抗原、延长半衰期的TCE以及三功能融合蛋白等。目前的国产三抗管线类型相对全面。
恩沐生物的CMG1A46药物为靶向CD3/CD19/CD20的三特异性抗体,其适应症为急性淋巴细胞白血病、血液肿瘤、滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤。CMG1A46同时靶向 T细胞表面的CD3以及B细胞上的两个抗原表位CD20和CD19,通过募集CD3+T细胞增强T细胞功能,介导B细胞耗竭并杀死表达CD19/CD20的B细胞。
基石药业的CS2006是靶向4-1BB/PD-L1/HSA的三特异性抗体,它是一款免疫检查点抑制剂,同时靶向肿瘤免疫抑制性PD-1/PD-L1通路和肿瘤免疫刺激性4-1BB通路,发挥PD-L1阻断作用以及4-1BB激活的协同效应,仅局部激活肿瘤定向的特异性免疫应答。
嘉和生物的GB263(Anti-EGFR/cMET/cMET)则走了靶向三个TAA的路径。通过靶向EGFR和两种不同的cMET表位,阻断cMET及EGFR的信号通路,下调cMET和EGFR的蛋白水平。拓创生物的TAVO-412也选择了类似思路。
普米斯生物的PM-8003是靶向PD-L1/TGF-β/VEGF的三功能融合蛋白,通过阻断TGF-β通路可以减少Treg细胞的数量,增加效应T细胞的活性,从而恢复对抗PD-L1治疗的敏感性。
有意思的是,国产三抗才刚加速,四抗就已经起步。
2024年12月20日,百利药业GNC-038四特异性抗体注射液的临床试验申请获得NMPA默示许可。9月20日,百利药业GNC-077多特异性抗体注射液临床试验也获得国家药品监督管理局药品审评中心(CDE)批准。
基于GNC平台,百利天恒开发了多款候选药物。其中,除未披露的GNC-077外,还有3款四特异性抗体已处于临床开发阶段,包括GNC-038(CD3 × 4-1BB × PD-L1 × CD19)、GNC-035(CD3 × 4-1BB × PD-L1 × ROR1)和GNC-039(CD3× 4-1BB × PD-L1 × EGFRvIII)。
可以看到国产多抗在肿瘤领域布局较为全面,考虑到近来MNC频繁收购双抗资产,并着手将肿瘤双抗管线拿去做自免临床,未来三抗在自免市场同样极具想象空间。
04
自免开始卷三抗
TCE的热浪终究开始扑向了自免。
2024年TCE双抗出尽了风头,如CD19/CD3,CD20/CD3等。2024年的交易显示未来三抗TCE将是一个重要的发展方向。2024年10月,GSK宣布以8.5亿美金收购中国恩沐生物的三特异抗体CMG1A46,根据协议,GSK将向恩沐生物支付3亿美金的首付款。
值得注意的是,新闻显示GSK计划开发和商业化CMG1A46,并将重点放在B细胞驱动的自身免疫疾病上,如系统性红斑狼疮(SLE)和狼疮性肾炎(LN),并有可能扩展到相关的自身免疫疾病。
据之前披露的信息,CMG1A46不仅可以杀伤CD19、CD20双阳性的B细胞,还可以清除CD19或者CD20单阳性的细胞,同时在体外的半数效应浓度仅为0.3pM,与传统的1+1型CD20 TCE相比,具有更好的安全性和更强的活性。在体内,CMG1A46可以在24小时内快速的清除B细胞,与传统CD20 TCE双抗相比可以给到更高的剂量,在1mpk的剂量下对B细胞的清除持续了28天。
艾伯维此次收购先声药业的SIM0500三抗,在血液瘤之外,BCMA和GPRC5D靶点在某些自免疾病的B细胞上也有表达,现有靶向BCMA的药物已经在干燥综合症、NMOSD、系统性硬化症、类风湿关节炎等自免疾病中展现出疗效。未来SIM0500在自免领域同样具有开发潜力。
有意思的是,NewCo的风也开始吹到国产多抗上。
2025年1月,药明生物与Candid Therapeutics达成研究服务合作协议,Candid将拥有一款基于药明生物通用型多特异性抗体专利技术平台WuXiBody发现的,处于临床前开发阶段的三特异性抗体的全球权益。就在20多天前,Candid还一口气宣布了三笔关于TCE与中国Biotech的研发合作交易。
2024年11月,维立志博与风险投资公司Aditum Bio就一款三抗药物达成了一项产品的独家选择权及许可协议,双方将基于维立志博CD19/BCMA/CD3三特异性T细胞衔接器(TCE)LBL-051,成立新药研发公司Oblenio。
三特异性抗体管线有望成为2025年靓丽的风口。
*封面图片来源:123rf
如果您认同文章中的观点、信息,或想进一步讨论,请与我们联系;也可加入动脉网行业社群,结交更多志同道合的好友。
近
期
推
荐
声明:动脉网所刊载内容之知识产权为动脉网及相关权利人专属所有或持有。未经许可,禁止进行转载、摘编、复制及建立镜像等任何使用。
动脉网,未来医疗服务平台
引进/卖出临床1期并购临床2期
2025-01-07
·抗体密码
2025年1月2日,信达生物宣布与罗氏达成全球独家合作与许可协议,以推进DLL3-ADC IBI3009产品的开发,旨在为晚期小细胞肺癌(SCLC)患者提供全新的治疗选择。根据协议,信达生物将获得8000万美金的首付款,和最高达10亿美金的开发和商业化潜在里程碑付款,以及未来基于全球年度销售净额的梯度式销售提成。那么问题来了,作为MNC,罗氏为什么要引进一款治疗SCLC的ADC呢?
一直以来,MNC引进管线无非主要是一下几个方面的原因:1)切入新的赛道进行相关管线的布局;2)对现有管线进行补充或者更新,以巩固自己在相关领域的地位;3)与自身相关管线联合,进一步提升相关药物的疗效。
无论是何种原因,主要还是要从适应症分析。DLL3作为一个有潜力的靶点已经有药物获批上市——安进的DLL3/CD3双抗。作为第一个靶向实体瘤的TCE双抗,tarlatamab于2024年5月17日,被 FDA加速批准上市,用于治疗广泛期小细胞肺癌(ES-SCLC)成人患者。tarlatamab的获批的获批上市,意味着靶向激活T细胞(TCE)双抗在实体瘤实现了突破,同时也证明了DLL3靶点的成药性《突破:首个实体瘤TCE双抗获批上市》。
然后看一下罗氏在SCLC领域的布局,纵观罗氏的管线,目前有两个药物用于SCLC的治疗,PD-L1单抗和靶向DLL3/4-1BB/CD3的三特异抗体。
首先是PD-L1单抗:2019年3月19日,罗氏宣布,FDA已批准Tecentriq联合化疗,用于成人广泛期小细胞肺癌(ES-SCLC)的初始(一线)治疗。这是20多年来首个被FDA批准用于ES-SCLC患者初始治疗的新方案,是首个也是之前唯一一个被批准用于ES-SCLC初始治疗的癌症免疫疗法。目前,该疗法不仅在美国获批,而且于2020年在国内获批上市
在一项名为IMpower133的多中心、随机双盲、含安慰剂对照的3期临床研究中,403名ES-SCLC患者接受了Tecentriq与化疗联用的组合疗法,或者安慰剂与化疗联用的组合疗法的治疗。试验结果表明,Tecentriq与化疗的组合疗法达到了试验的共同主要终点。在意向治疗患者群中,显著提高患者的总生存期(OS为12.3个月,对照组为10.3个月;HR=0.70, 95% CI: 0.54-0.91; p=0.0069)。Tecentriq加化疗的组合疗法同时显著减少患者疾病进展和死亡的风险。患者无进展生存期(PFS)为5.2个月,对照组为4.3个月(HR=0.77; 95% CI: 0.62-0.96; p=0.017)。
我们再来看看DLL3/4-1BB/CD3的三特异抗体RG6524的情况《中外制药发表CD3/4-1BB/DLL3三抗文章》,RG6524的开发基于中外制药的新一代双特异抗体平台Dual/LINC-Ig™,Dual/LINC-Ig™含有两个可以结合CD3/CD 137的Fab,并且这两个Fab通过二硫键固定即LINC-Ig技术(下一个平台介绍),因此其可以进一步增强抗体对T细胞的激活,在体外实验中,Dual/LINC-Ig™用药后IFN-γ的释放量是Dual-Ig的10倍以上。
在小鼠肿瘤模型中,常规的双特异抗体对几乎没有T细胞浸润的肿瘤基本无效;在促进T细胞浸润方面,常规的双抗仅能有限的促进T细胞进入肿瘤。而Dual/LINC-Ig™双特异抗体平台,无论是在治疗效果还是在促进T细胞浸润方面都优于常规双抗和第一代的Dual-Ig抗体。
在交易披露出来后,有人问,安进的DLL3双抗已经上市,罗氏为啥不买一款双抗而选择ADC呢。从罗氏的管线来看,其三抗RG6524其实是双抗的升级版,因此如果引入双抗,两款双抗存在一定的重复性,不仅靶点相同,作用机制也基本相同。而引进ADC可能有以下几个方面的考量:1)虽然DLL3-ADC IBI3009和RG6524在靶点上相同,但是两者的作用机制完全不同,即便后续RG6524在临床中获得成功,其都可以和PD-L1抗体联合,算是两套治疗方案;2)DLL3的靶点已经得到验证,虽然之前艾伯维的DLL3-ADC已经失败,但是其原因主要是当时对毒素以及ADC的理解不够,而信达的IBI3009毒素采用了信达专有的新型拓扑异构酶I抑制剂(TOPO1i)平台设计开发,从目前的临床看,TOPO1i毒素是相对一个比较理想的毒素,毒性小且有旁观者效应,因此其成药性更强。3)罗氏自己的三抗RG6524虽然是双抗的升级版,并且在临床前研究中与双抗相比具有较好的疗效,但是对于TCE抗体,疗效越大可能具有更大的毒性,还是具有很大的风险的,因此即使后续RG6524临床失败,IBI3009也是一个备份,不至于在DLL3靶点上颗粒无收。
另外,在ADC和免疫疗法联合大热的背景下,罗氏后续必定会开展PD-L1和DLL3-ADC的联合临床研究。不然后续其不仅要面对安进TCE双抗Tecentriq向一线疗法挺进的竞争,而且还要面对默沙东和第一三公B7-H3-ADC和DLL3/CD3联合疗法的竞争。
我们已经建立抗体密码读者交流群,有兴趣的可以扫描下方二维码添加微信进群,请主动备注姓名-公司-职位(高校-专业),非诚勿扰!
往期精彩回顾
抗体密码文章合集
双特异抗体平台
靶点相关
双特异抗体作用机制
综述,行业概览
抗体筛选技术
相关公司技术汇总
医药资讯
因为你的分享、点赞、在看
我足足的精气神儿!
声明
本公众号所发表文章以宣传知识为目的,因此不构成投资,病人用药等建议。如果文章侵您的权益及时联系小编进行删除!
欢迎扫码交流/咨询/合作=
参考文献:
相关信息披露
免疫疗法抗体药物偶联物临床3期临床2期引进/卖出
100 项与 Clesitamig 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| 广泛期小细胞肺癌 | 临床1期 | 美国 | 2023-01-23 | |
| 广泛期小细胞肺癌 | 临床1期 | 日本 | 2023-01-23 | |
| 广泛期小细胞肺癌 | 临床1期 | 丹麦 | 2023-01-23 | |
| 广泛期小细胞肺癌 | 临床1期 | 波兰 | 2023-01-23 | |
| 广泛期小细胞肺癌 | 临床1期 | 西班牙 | 2023-01-23 | |
| 神经内分泌癌 | 临床1期 | 美国 | 2023-01-23 | |
| 神经内分泌癌 | 临床1期 | 日本 | 2023-01-23 | |
| 神经内分泌癌 | 临床1期 | 丹麦 | 2023-01-23 | |
| 神经内分泌癌 | 临床1期 | 波兰 | 2023-01-23 | |
| 神经内分泌癌 | 临床1期 | 西班牙 | 2023-01-23 |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
No Data | |||||||
登录后查看更多信息
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或

批准
利用最新的监管批准信息加速您的研究。
登录
或
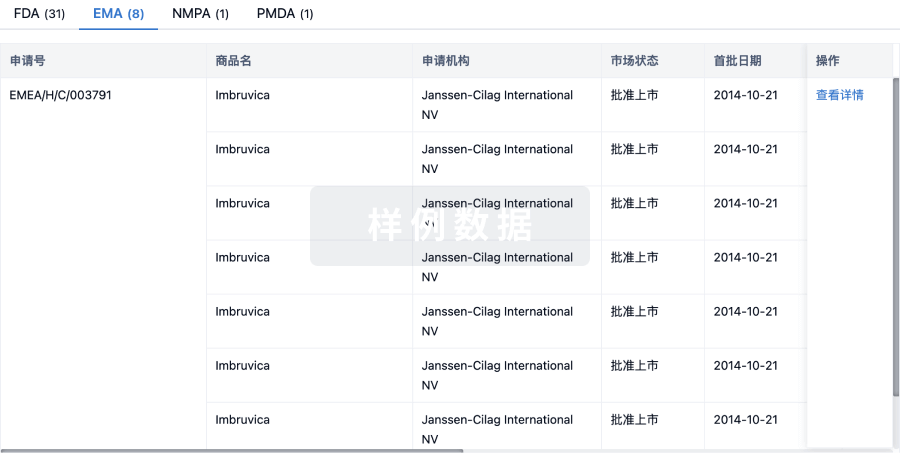
生物类似药
生物类似药在不同国家/地区的竞争态势。请注意临床1/2期并入临床2期,临床2/3期并入临床3期
登录
或
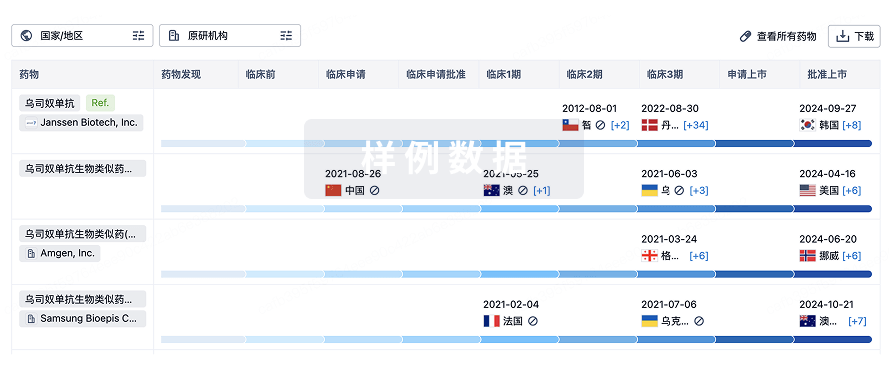
特殊审评
只需点击几下即可了解关键药物信息。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用