更新于:2024-11-07
TQB-3617
更新于:2024-11-07
概要
基本信息
原研机构 |
在研机构 |
非在研机构- |
最高研发阶段临床1/2期 |
首次获批日期- |
最高研发阶段(中国)临床1/2期 |
特殊审评- |
登录后查看时间轴
关联
5
项与 TQB-3617 相关的临床试验A Phase Ib/II Clinical Trial of TQ05105 Tablets Combined With TQB3617 Capsules in the Treatment of Intermediate- and High-risk Myelofibrosis
This is an open, single-arm, multi-center clinical study designed to evaluate the efficacy and safety of TQ05105 Tablets combined with TQB3617 Capsules in patients with intermediate- and high-risk Myelofibrosis.
开始日期2023-12-12 |
申办/合作机构 |
TQ05105片联合TQB3617胶囊治疗中高危骨髓纤维化的Ib/II期临床研究
主要目的:评价TQ05105片联合TQB3617胶囊治疗中高危骨髓纤维化(MF)的有效性。
次要目的:评价TQ05105片联合TQB3617胶囊治疗中高危MF受试者中的安全性、相关症状改善情况等。
开始日期2023-11-21 |
申办/合作机构 |
Phase Ib Clinical Trial to Evaluate the Safety and Efficacy of TQB2618 Injection Combined Therapy in Patients With Advanced Esophageal Squamous Cell Carcinoma
To investigate the efficacy and safety of TQB2618 injection combined Penpulimab and chemotherapy in the first-line treatment of recurrent/metastatic esophageal squamous cell carcinoma compared with Penpulimab combined chemotherapy.
The primary efficacy outcomes are progression free survival (PFS) and objective response rate (ORR).
The primary efficacy outcomes are progression free survival (PFS) and objective response rate (ORR).
开始日期2023-05-26 |
申办/合作机构 |
100 项与 TQB-3617 相关的临床结果
登录后查看更多信息
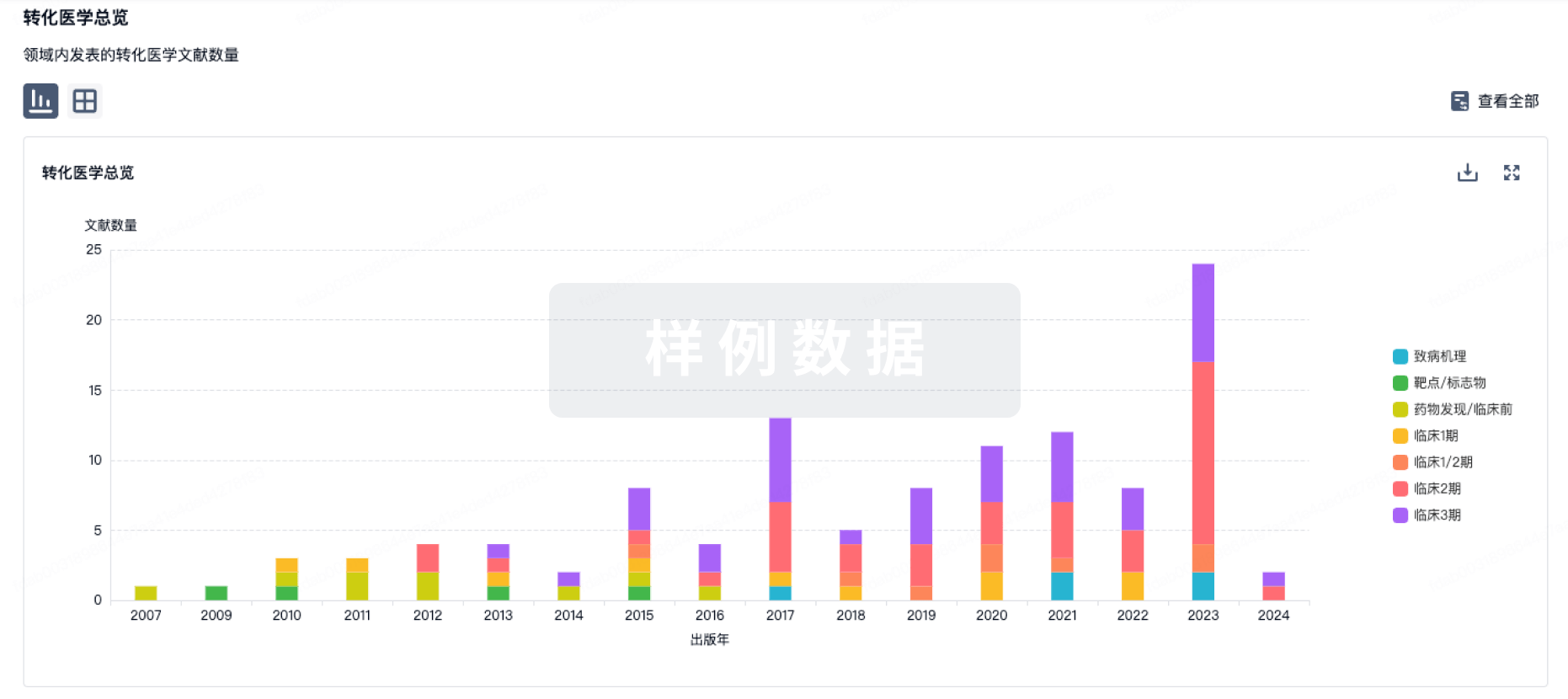
100 项与 TQB-3617 相关的转化医学
登录后查看更多信息
100 项与 TQB-3617 相关的专利(医药)
登录后查看更多信息
7
项与 TQB-3617 相关的新闻(医药)2024-10-30
关注并星标CPHI制药在线
近日,中国国家药监局药品审评中心(CDE)官网公示,晶锐医药1类新药JRD-018片获批临床,拟开发治疗晚期恶性肿瘤。
JRD-018是一款可入脑的BET抑制剂,今年4月已经获美国FDA批准开展1期临床研究。晶锐医药拟开启1期临床试验并将针对晚期实体瘤患者进行招募,继而扩展到血液瘤、脑转移或原发性脑瘤,旨在探索JRD-018在患者中的安全性、耐受性、药代动力学以及初步抗肿瘤活性。
体内药效研究结果表明,JRD-018单独使用在脑胶质瘤模型、小细胞肺癌模型、非小细胞肺癌模型、髓性单核细胞白血病模型以及乳腺癌模型中均表现出良好的抗肿瘤活性。在临床前动物模型研究中,JRD-018已显示出良好的对脑转移或原发性脑瘤、恶性脑肿瘤的抑制效果。
表观遗传学靶点之BET
溴结构域和超末端结构域(bromodomain and extra terminal domain,BET)属于溴结构域蛋白家族,BET蛋白家族包含四个异构体BRD2、BRD3、BRD4、BRDT,它们的结构相似,在N端有2个串联的溴结构域(BD1和BD2)以及一个超末端结构域(ET)。BD1和BD2识别并结合乙酰化赖氨酸残基,与染色质重塑和基因转录的调控过程相关;ET结构域与多种转录因子相互作用。BET蛋白家族通过溴结构域与乙酰化的染色质结合,从而实现在表观遗传学水平上对基因表达进行调控。
BET蛋白家族在人体内表达广泛,与多种实体瘤和恶性血液性肿瘤、炎症、肥胖、肺纤维化等多种疾病的发生和发展密切相关。如原癌基因Myc在超过一半的肿瘤中过表达,BET抑制剂通过竞争性结合阻止BRD4与染色质结合,进而抑制Myc的转录,从而实现抑制肿瘤的目的。
BET抑制剂是一类新型抗癌药,这类药物在治疗血液癌症如白血病和淋巴瘤方面具有良好的前景。BET抑制剂能够通过阻断BET蛋白的功能从而抑制肿瘤生长。研发BET蛋白选择性抑制剂是目前的新方向。目前,一系列BET抑制剂正在临床试验中检验它们治疗包括白血病、淋巴瘤、脑瘤和骨髓瘤在内的多种癌症的疗效。
BET抑制剂:诺华高调购入,加思科、正大天晴加速推进
BET被认为是抗肿瘤药物研发潜力靶点。目前,全球药企针对该靶点已开发出多款药物,详见下表。在研BET抑制剂大多为小分子化学药,此外还包括蛋白水解靶向嵌合体(PROTACs)。适应症上,BET抑制剂主要被开发用于实体瘤和血液性肿瘤,其中部分还被开发用于治疗炎症性疾病如白癜风等。全球至今还尚无BET抑制剂获批,进度最快的就是MorphoSys的Pelabresib,是首个三期临床试验取得成功的BET抑制剂。MorphoSys围绕该药物布局了骨髓纤维化、恶性外周神经鞘瘤、多发性骨髓瘤等多项适应症。
Pelabrisib是由MorphoSys AG公司研制的first-in-class BET抑制剂,近期Pelabrisib治疗骨髓纤维化III期达到了主要研究终点SVR35(脾脏缩小超过35%),从214例患者的临床数据来看, Pelabrisib与JAK抑制剂芦可替尼联用24周,有65.9%的患者脾脏缩小超过35%,而对照组(芦可替尼与安慰剂)仅有35.2%的患者达到SVR35,实验组的疗效比对照组高30.4%。今年年初,诺华以29亿美元收购MorphoSys AG从而拥有了pelabresib这款BET抑制剂。诺华将基于III期MANIFEST-2研究的积极数据在今年下半年向FDA和EMA提交pelabresib联合芦可替尼治疗骨髓纤维化的上市申请。
ZEN-3694是一种领先的差异化BET抑制剂,被开发联合免疫检查点抑制剂、PARP抑制剂、MEK抑制剂、CDK4/6抑制剂、HDAC抑制剂治疗多种肿瘤。ZEN-3694可以降低BRCA1/2和RAD51等蛋白的DNA修复活性,以提高肿瘤细胞对PARP抑制的敏感性,当前用以治疗转移性去势抵抗性前列腺癌II期临床正在开展中。2019年8月,Zenith Epigenetics 与恒翼生物就该药签订超7800万美元的许可协议,授权恒翼生物获得ZEN-3694在中国(包括中国香港、中国台湾和中国澳门地区)的权益。
JAB-8263是加科思自主研发、具有全球知识产权的小分子BET抑制剂,临床前研究显示其对多种实体瘤和血液瘤均能发挥抗肿瘤作用。从公开数据来看,JAB-8263是同类临床项目中活性最强的BET抑制剂,有望在极低剂量下有效抑制多种肿瘤生长,和Pelabrisib相比具有巨大的差异化优势。目前,加科思正在中美两地开展JAB-8263的多中心、开放性I/IIa期临床研究,适应症涉及白血病及实体瘤。
TQB3617是正大天晴自主研发的一款具有全新化学结构的BET抑制剂,能够通过抑制BET蛋白功能减少c-Myc、NF-κB、Aurora B和BCL-2等致癌基因的异常表达,进而发挥抗肿瘤作用。临床前研究结果显示,TQB3617对BET家族的BRD2、BRD3、BRD4、BRDT蛋白均具有较强的抑制活性。TQB3617用于晚期恶性肿瘤的I期临床试验显示,2例骨髓纤维化患者在治疗第12周结束时,脾 脏体积较基线分别缩小13%和30%,展现出潜在的抗骨髓纤维化疗效。在28例接受疗效评估的淋巴瘤中,总缓解率(ORR)为39.3%(11/28),其中4例CR,7例PR。
Trotabresib(CC-90010)是一种新型、口服、可逆性、小分子BET抑制剂,可穿透高级别胶质瘤患者的脑肿瘤组织,临床前研究显示其可增强替莫唑胺(TMZ)的抗肿瘤作用。已公布的1b/2期开放标签、剂量探索研究结果显示:在长期随访中,新诊断胶质母细胞瘤(GBM)患者接受Trotabresib+TMZ辅助治疗或Trotabresib+TMZ+RT(放疗)同步治疗耐受性良好,未出现新的不良反应。
结语
整体来看,BET是进展相对较慢的一个表观遗传学药物靶点。BET蛋白家族在人体内表达广泛,与多种实体瘤和恶性血液性肿瘤、炎症、肥胖、肺纤维化等多种疾病的发生和发展密切相关,是非常有潜力的药物靶点,全球首个BET抑制剂pelabresib III期临床试验的成功宣告了该靶点的成效性,目前全球围绕BET靶点研发火热,值得一提的是,随着科学技术的发展,BET抑制剂的研发不再局限于小分子化药,已有多家企业、机构研发出BET靶向PROTACs。目前国内药企也积极布局BET靶点,而布局方式除了自主研发,还从外部企业引进,如恒翼生物。期待在药企的不懈努力下,BET靶点可以早日迎来重大突破。
参考来源
1.Raajit Rampal, Sebastian Grosicki, Dominik Chraniuk et al.Updated safety and efficacy data from the phase 3 MANIFEST-2 study of pelabresib in combination with ruxolitinib for JAK inhibitor treatment-na?ve patients with myelofibrosis.?JCO?42,?6502-6502(2024).DOI:10.1200/JCO.2024.42.16_suppl.6502
2.2024 ASCO. Abstract?#6502: Updated safety and efficacy data from the phase 3 MANIFEST-2 study of pelabresib in combination with ruxolitinib for JAK inhibitor treatment-na?ve patients with myelofibrosis.
END
来源:CPHI制药在线
声明:本文仅代表作者观点,并不代表制药在线立场。本网站内容仅出于传递更多信息之目的。如需转载,请务必注明文章来源和作者。
投稿邮箱:Kelly.Xiao@imsinoexpo.com
▼更多制药资讯,请关注CPHI制药在线▼
点击阅读原文,进入智药研习社~
临床1期临床3期蛋白降解靶向嵌合体临床2期临床结果
2024-06-03
·医药魔方
2024年美国临床肿瘤学会年会(ASCO)正在芝加哥火热召开。作为全球最重要的肿瘤学盛会之一,来自全球的大小企业都会聚集于此对外展示最前沿的临床肿瘤学产品进展。今年ASCO大会,共有5800+项研究入选,426项研究入选了口头汇报环节,其中有55项来自中国,这一数值较5年前翻了近两倍(19项),充分展现了中国创新实力的不断崛起。而携着first-in-class光环的新药更能体现这份实力的重量,今年众多国产FIC新药正通过一项项临床数据展示着创新果实。
药物:GT201
公司:沙砾生物
GT201是全球首款膜结合IL-15复合物下一代基因编辑型肿瘤浸润淋巴细胞(TIL)疗法,在体内外均表现出较传统TIL更强的增殖能力、肿瘤杀伤、细胞因子释放和更好的存续性,并可以降低对于IL-2的依赖性,潜在降低临床应用中IL-2的使用剂量,从而克服传统TIL药物所面临的挑战。
本次ASCO年会,沙砾生物以海报形式公布了GT201用于晚期实体瘤的I期最新临床数据。截至2024年01月22日,这项研究入组了7例恶性程度高、多线治疗失败的实体瘤患者,包括非小细胞肺癌、黑色素瘤、宫颈癌和卵巢癌。这些患者完成淋巴细胞清除化疗标准方案后,回输GT201的TIL细胞,其中有5例患者随后注射了IL-2。
疗效结果显示,多例患者的肿瘤明显缩小且病情缓解,其中1例患者接受GT201治疗后,肿瘤相比治疗前减少了69%。在所有非小细胞肺癌患者中,GT201的疾病控制(肿瘤部分消除或病情稳定超过24周)率达到100%。此外,GT201安全性良好,未观察到与GT201 TIL细胞直接相关的SAE,所有不良反应在14天内消失、或降为2级或更低。
另外在细胞存续方面,输注GT201的TIL后,T细胞在所有患者中稳定扩增。并且,GT201细胞在患者体内扩增并存续的时间超过6个月。
药物:TQB3617
公司:正大天晴
TQB3617胶囊是正大天晴自主研发的一款具有全新化学结构的BET抑制剂,能够通过抑制BET蛋白功能减少c-Myc、NF-κB、Aurora B和BCL-2等致癌基因的异常表达,进而发挥抗肿瘤作用。
临床前研究结果显示,TQB3617对BET家族的BRD2、BRD3、BRD4、BRDT蛋白均具有较强的抑制活性。
本次公布了TQB3617胶囊用于晚期恶性肿瘤的I期临床试验,以评估该产品的耐受性和药代动力学。截至2023年11月9日,该研究共纳入36例恶性血液疾病患者,其中32例淋巴瘤,2例骨髓纤维化,2例为其他恶性血液疾病。28例患者ECOG体力状态评分(ECOG PS)为1分,既往治疗线数中位数为3。
结果显示,TQB3617总体上安全性和耐受性良好,并且在淋巴瘤和骨髓纤维化患者中展现出鼓舞人心的疗效。具体来看,该研究最常见治疗不良事件(TEAE)是血小板计数下降(73.4%)、贫血(40%)、高甘油三酯血症(28.6%)、高血糖(25.7%),TEAE多为1-2级。
疗效数据显示,2例骨髓纤维化患者在治疗第12周结束时,脾脏体积较基线分别缩小13%和30%,展现出潜在的抗骨髓纤维化疗效。在28例接受疗效评估的淋巴瘤中,ORR为39.3%(11/28),其中4例CR,7例PR。
淋巴瘤患者肿瘤靶病灶较基线最佳缩小情况(n=28,图片来源:正大天晴)
除了单药治疗,正大天晴还在开展JAK/ROCK抑制剂TQ05105片联合TQB3617胶囊治疗中高危骨髓纤维化的Ib/II期临床研究。
药物:CMG901(AZD0901)
公司:康诺亚/乐普生物/阿斯利康
AZD0901(CMG901)为康诺亚与乐普生物共同开发的CLDN18.2 ADC,由CLDN18.2特异性抗体、可裂解连接子及毒性载荷甲基澳瑞他汀E(MMAE)组成。
2023年2月,阿斯利康与KYM Biosciences(康诺亚拥有70%权益)签署了全球独家许可协议,获得了AZD0901研究、开发、注册、生产及商业化的全球权益。KYM将收取6300万美元预付款、最多11.25亿美元的额外潜在付款,以及分级特许权使用费。
本年度ASCO大会公布的是AZD0901治疗晚期胃癌/胃食管结合部腺癌的I期临床研究最新数据。结果显示,AZD0901具有良好的安全性和耐受性,在治疗晚期Claudin 18.2高表达胃癌/胃食管结合部腺癌受试者中表现出了优秀的疗效。
89例可评估的Claudin 18.2高表达(定义为≥20%肿瘤细胞中Claudin 18.2染色强度≥2+)胃癌/胃食管结合部腺癌受试者在三个剂量组经确认的ORR为35%,疾病控制率(DCR)为70%。2.2mg/kg剂量组ORR为48%。所有93例Claudin 18.2高表达胃癌/胃食管结合部腺癌受试者的中位无进展生存期(mPFS)为4.8个月,中位总生存期(mOS)为11.8个月。
安全性方面,在三个剂量组的113例胃癌/胃食管结合部腺癌受试者中,与药物相关的≥3级治疗期不良事件的发生率为55%,与药物相关的严重不良事件发生率为32%,8%的受试者因与药物相关的不良事件停止用药。
2024年3月,阿斯利康已经启动AZD0901治疗Claudin 18.2阳性胃癌或胃食管交界处腺癌的III期临床研究。
药物:IBI363
公司:信达生物
IBI363是一款全球首创PD-1/IL-2α双特异性抗体融合蛋白,其IL-2臂经过设计改造,保留了CD25(IL-2Rɑ)活性以最大化疗效和高选择性,减少了对IL-2Rβγ 结合以降低系统毒性,而PD-1结合臂可以实现对PD-1的阻断和IL-2的选择性递送。因此,IBI363具备同时阻断PD-1/PD-L1通路和激活IL-2通路两项功能,可以更有效地激活肿瘤特异性T细胞。
2024ASCO年会上,信达生物公布了IBI363治疗晚期黑色素瘤、结直肠癌等肿瘤的I期临床研究结果。其中,黑色素瘤队列显示,截至2024年1月11日,57例至少有1次基线后肿瘤评估患者中,1例患者达到完全缓解(CR),15例患者达到部分缓解(PR),ORR为28.1%,DCR为71.9%;既往接受过免疫治疗的52例患者中,25例接受1mg/kg Q2W IBI363治疗,ORR为32%,DCR为80.0%。
肠癌队列显示,截至2023年12月22日,中位随访时间为5.3个月,1例受试者达到CR,7例受试者达到PR。总体ORR为12.7%,1mg/kg剂量组的ORR为15.0%;PD-L1 CPS≥1的13例受试者ORR为30.8%,DCR为76.9%。
其他肿瘤队列显示,截至2024年1月26日,13例胆道肿瘤、3例头颈鳞癌、4例宫颈癌以及4例卵巢癌受试者接受了IBI363单药治疗。其中,11例可评估的胆道癌患者中,1例获得PR,9例SD;2例可评估头颈鳞癌患者中,1例未经过免疫治疗、PD-L1表达阴性的受试者获得PR;3例可评估宫颈癌患者中,1例达到PR,1例SD;2例可评估卵巢癌患者中,1例铂耐药患者获得PR。
药物:CBP-1018
公司:同宜医药
CBP-1018是基于同宜医药Bi-XDC技术平台开发的一款双配体药物偶联药物,两个配体分别靶向叶酸受体α(FRα)和前列腺特异性膜抗原(PSMA)。
本次ASCO年会上公布的是一项CBP-1018治疗晚期恶性实体瘤患者的I期临床试验。截至2023年12月31日,共有59例患者,其中57例为转移性去势抵抗性前列腺癌(mCRPC),1例膀胱癌,1例输尿管癌。
7例可评估的mCRPC患者,在0.14mg/kg或者更高剂量水平下,最佳总体疗效(BOR)为3例PR,4例SD,ORR为42.9%,DCR为100%;28例可评估转移性CRPC患者,中位放射影像学无进展生存期(mrPFS)为9.2个月(95%CI,5.0个月-NA)。
安全性方面,研究未观察到剂量限制性毒性(DLT),也未出现与药物相关的死亡。大多数与治疗相关的不良事件(TRAEs)为1~2级,3级以上TRAEs主要包括中性粒细胞减少(29.5%)、白细胞减少(19.7%)、淋巴细胞减少(11.5%)。
药物:RC88
公司:荣昌生物
RC88是一款新型间皮素(MSLN)靶向ADC,采用了荣昌生物自主研发的创新桥接技术进行抗体、药物连接,结构包括MSLN靶向抗体、可裂解连接子以及小分子细胞毒素(MMAE),可通过靶向结合MSLN阳性的肿瘤细胞,介导抗体的内吞,从而有效地将细胞毒素定向传递给癌细胞,实现较好的肿瘤杀灭效果。
在2024ASCO上,荣昌生物披露了RC88用于卵巢癌、非鳞状NSCLC、宫颈癌的I/II期临床研究数据。截至2023年12月19日,164例晚期实体瘤患者入组,既往全身性治疗线数为2-7线。在至少有一次基线后肿瘤评估卵巢癌患者中,ORR为37.2%(16/43);在接受过2-4线治疗患者中,2.0mg/kg组ORR为45.5%(10/22),2.5mg/kg组ORR为33.3%(2/6)。
在非鳞NSCLC患者中,26例经过全身治疗后疾病进展,其中23例接受过至少2线以上治疗,至少一次基线后肿瘤评估患者ORR为21.7%(5/23)。在没有驱动基因突变的15例患者中,11例既往接受过含铂双药化疗和PD(L)-1抑制剂,ORR为33.3%(5/15),1例CR。在18例既往接受过全身治疗疾病进展的宫颈癌患者中,ORR为35.3%(6/17)。
安全性方面,161例患者报告了TEAE,其中40.2%为3级,23例患者发生与治疗相关的SAE。最常见的TRAEs事白细胞计数下降(42.1%)、贫血(34.1%)、恶心(32.3%)和天冬氨酸转氨酶升高(31.1%)。
药物:CBP-1008
公司:同宜医药
CBP-1008是同宜医药开发的另一款同时靶向FRα和TRPV6(一种钙离子通道蛋白)受体的双抗ADC,毒素部分为MMAE。
本次公布了CBP-1008用于实体瘤的I期研究数据。截至2023年12月8日,240例患者入组(Ia期40例,Ib期200例),其中136例高级别浆液性卵巢癌(HGSOC),卵巢透明细胞癌(OCCC),24例三阴性乳腺癌(TNBC),63例为其他癌种。
结果显示,0.15mg/kg CBP-1008治疗组展现出明确的卵巢癌治疗活性,特别是在铂类耐药的HGSOC患者中,无论FRα表达如何,CBP-1008都有望为患者带来更好的治疗选择。
其中,在既往接受过3线及以上治疗的41例HGSOC患者中(无论患者FRα表达如何),CBP-1008 0.15mg/kg剂量组13例达到PR,29例达到SD,ORR为31.7%,DCR为70.7%;FRα表达水平为0-49%的19例患者中,6例达到PR,ORR为31.6%。安全性方面,研究大多不良事件为轻度至中度,常见的TRAEs(50%)为中性粒细胞减少、白细胞减少、AST升高、发热、ALT升高和恶心。
Copyright © 2024 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。
精彩预告
线上直播
↑点击扫码,直达直播间↑
ASCO会议临床1期临床结果
2024-06-03
2024 年度 ASCO 年会正在如火如荼进行中,其中不乏国内企业的身影,信达、康方、科伦、乐普生物、君实生物等多家企业带来最新进展。
有哪些进展值得关注?本文作简单介绍和梳理。
信达生物
信达在本次会上公布约 20 项最新临床研究数据,涉及单抗、双抗及 ADC 在研管线,包括信迪利单抗、IBI343、IBI363、IBI389 等。
标题:IBI343(抗 Claudin18.2 ADC)在晚期胰腺导管腺癌或胆道癌患者的安全性和疗效:I 期研究的初步结果
试验登记号:NCT05458219
摘要编号:#3037
讲者:虞先濬教授 | 复旦大学附属肿瘤医院
该研究为在中国及澳大利亚开展的 I 期研究,旨在评估 IBI343 在晚期实体瘤受试者中安全性、耐受性和初步疗效。本次大会公布了在晚期胰腺导管腺癌或胆道癌患者的数据。此外,该临床 I 期治疗晚期胃或胃食管肿瘤部分的数据将于本月在 ESMO GI 上以口头形式报告。
截至 2023 年 12 月 19 日,共入组 35 名晚期胰腺导管腺癌(PDAC)或胆道癌(BTC)患者,所有受试者既往均接受至少 1 线治疗,中位治疗线数为 2 线。
结果显示:截至 2024 年 1 月 15 日,在 25 例至少接受过 1 次基线后肿瘤评估的受试者中,7 例达到 PR, 其中 5 例为 PDAC 患者,2 例为 BTC 患者。ORR为 28.0%(95%CI:12.1-49.4),DCR 为 80.0%(95%CI:59.3-93.2)。
在 6 mg/kg 剂量组, CLDN18.2 IHC1/2/3+≥ 60% 的受试者中,13 例至少进行了 1 次基线后肿瘤评估,其中 5 例受试者达到 PR,ORR 为 38.5%(95%CI:13.9-68.4), DCR 为 84.6%(95%CI:54.6-98.1)。在本亚组中的 10 例晚期 PDAC 受试者中,ORR 为 40%(95%CI:12.2-73.8)。DoR 和 PFS 数据尚未成熟。
安全性方面,80.0% 受试者发生治疗相关不良事件 (TRAE),常见的 TRAE 为贫血(42.9%)、中性粒细胞计数减少(28.6%)、恶心(25.7%)、呕吐(25.7%)和白细胞计数减少(22.9%);25.7% 受试者发生 ≥ 3 级 TRAE;未发生与治疗相关的死亡事件。
标题:全球首创(First-in-class)PD-1/IL-2 双特异性抗体融合蛋白 IBI363 治疗晚期黑色素瘤:I 期研究的安全性和有效性初步结果
试验登记号:NCT05460767
摘要编号:#9562
讲者:陈誉教授 | 福建省肿瘤医院
研究结果:67 例标准治疗失败或不耐受的局部晚期或转移性黑色素瘤受试者接受了 100 μg/kg QW 至 2 mg/kg Q3W IBI363 治疗,其中 89.6% 的受试者既往接受过免疫检查点抑制剂治疗;61.2% 的受试者既往接受过 ≥ 2 线系统治疗;25.4% 的受试者在基线时存在肝转移;肢端和黏膜黑色素瘤占比 70.1%。
截至 2024 年 1 月 11 日,在 57 例至少有一次基线后肿瘤评估的受试者中,1 例受试者达到 CR,15 例受试者达到 PR,ORR 为 28.1% (95%CI: 17.0-41.5),DCR 为 71.9% (95%CI: 58.5-83.0);在既往经过免疫治疗的 52 例受试者中,25 例接受 1 mg/kg Q2W IBI363 治疗,ORR 为 32.0% (95%CI: 14.9-53.5),DCR 为 80.0% (95%CI: 59.3-93.2)。
安全性方面,16 例受试者(23.9%)发生了三级及以上的治疗期间不良事件(TEAE);最常见的 TEAE 是关节痛(34.3%),甲亢(29.9%),贫血(25.4%);8 例(11.9%)受试者发生了三级或以上免疫相关不良事件(irAE);无受试者发生与治疗相关的死亡事件。
标题:全球首创(First-in-class) PD-1/IL-2 双特异性抗体融合蛋白 IBI363 在晚期结直肠癌患者中的 I 期研究:安全性和有效性初步结果
试验登记号:NCT05460767
摘要编号:#3593
研究结果:68 例标准治疗失败或不耐受的局部晚期或转移性结直肠癌受试者接受了 100 μg/kg QW 至 3 mg/kg Q3W IBI363 治疗,其中 83.8% 的受试者为 MSS/pMMR,其余受试者 MMR 状态未知;76.5% 的受试者既往接受过 ≥ 3 线系统治疗;61.8% 的受试者在基线时存在肝转移。
截至 2023 年 12 月 22 日,中位随访时间为 5.3 个月(95% CI: 4.4-6.9);其中 1 例受试者达到完全缓解,7 例受试者达到部分缓解,所有剂量组患者的总体 ORR 为 12.7% (95%CI: 5.6-23.5),1 mg/kg 剂量组的 ORR 为 15.0% (95% CI: 3.2-37.9);在 PD-L1 CPS ≥ 1 的 13 例受试者中,ORR 为 30.8% (95%CI: 9.1-61.4),DCR 为 76.9% (95%CI: 46.2-95.0)。
安全性方面,22 例受试者(32.4%)发生了三级及以上 TEAE;最常见的 TEAE 是关节痛(35.3%),贫血(32.4%),发热(22.1%)和低白蛋白血症(20.6%);4 例(5.9%)受试者发生了三级或以上 irAE;未发生与治疗相关的死亡事件。
标题:抗 CLDN18.2/CD3 双特异性抗体 IBI389 在晚期胰腺导管腺癌患者中的安全性和疗效:I 期研究的初步结果
试验登记号:NCT05164458
摘要编号:#4011
讲者:郝继辉教授 | 天津市肿瘤医院
截至 2024 年 3 月 11 日,共 72 例晚期不可手术或转移性胰腺导管腺癌的受试者接受了 IBI389 单药治疗。所有受试者既往均接受至少 1 线治疗,其中 55.6% 的受试者既往接受过 2 线及以上系统治疗。
研究结果显示:在 CLDN18.2 IHC 2/3+≥ 10% 的胰腺癌受试者中,接受 100 μg/kg IBI389 治疗时,即观察到初步疗效信号。
在 RP2D 推荐剂量 600 μg/kg 组中呈现出更优疗效,在 27 例至少进行了一次基线后肿瘤评估的受试者中,ORR 为 29.6% (95%CI:13.8-50.2),cORR为 25.9%(95%CI:11.1-46.3),DCR 达 70.4%(95%CI:49.8-86.2)。在 CLDN18.2 IHC 2/3+≥ 40% 的 18 例受试者中, cORR 达 38.9%(95%CI:17.3-64.3)。
截至 2024 年 5 月 1 日,中位随访时间为 4 个月,中位无进展生存期(PFS)尚未成熟,3 个月的 PFS 率达 57.1%。安全性与总体人群安全性相似,未发现新的安全性信号。
标题:抗 CLDN18.2/CD3 双特异性抗体 IBI389 在实体瘤和胃或胃食管肿瘤患者中的安全性和初步疗效结果:I 期剂量递增和扩展研究
试验登记号:NCT05164458
摘要编号:#2519
结果显示:截至 2024 年 5 月 1 日,在接受 ≥ 10 μg/kg IBI389 单药治疗的 CLDN18.2 IHC 2/3+≥ 10% G/GEJC 患者中,26 例受试者至少接受过 1 次基线后肿瘤评估,其中 8 例受试者达到 PR,ORR 和 DCR 分别为 30.8% 和 73.1%。
安全性方面,截至 2024 年 3 月 11 日,共入组 120 例既往经过标准治疗失败或不耐受的晚期恶性肿瘤受试者。IBI389 总体耐受性良好, 各剂量组未观察到DLT 事件。60% 的受试者发生细胞因子释放综合征 (CRS),仅 1 例 3 级,未发生 4 级或 5 级 CRS。共有 58.3% 的受试者发生 ≥ 3 级 TRAEs,最常见的 ≥ 3 级 TRAE 为 γ-谷氨酰转移酶升高(21.7%)、淋巴细胞计数降低(13.3%)和食欲减退(5.0%)。
康方生物
康方有 3 个产品 18 项研究入选此次会议,涵盖胃癌、食管癌、肝癌、胆道肿瘤、胰腺癌等疾病领域。其中,PD-1/VEGF 双抗(依沃西单抗/AK112)III 期临床 HARMONi-A 研究数据曾一度引发行业热议。此后,依沃西单药对比 K 药 1 L治疗 PD-L1 阳性 NSCLC 的 III 期临床成功的信息,也再次引起股价波动。
标题:依沃西联合化疗对比安慰剂联合化疗用于经 EGFR-TKI 治疗进展的 EGFR 突变的局部晚期或转移性非鳞 NSCLC 患者的随机、双盲、多中心 III 期临床研究(AK112-301/HARMONi-A)
试验登记号:NCT05184712
摘要编号:#8508
讲者:张力教授 | 中山大学肿瘤防治中心
结果显示:研究共纳入 322 例受试者(161 例 AK112+化疗组,161 例安慰剂+化疗组)。其中,86.3% 和 85.1% 的患者接受了第三代 EGFR-TKI 治疗,21.7% 和 23.0% 的患者发生脑转移。
结果显示,截至 2023 年 3 月 10 日,中位随访 7.89 个月,经 IRRC 评估的接受AK112 治疗的患者 mPFS 为 7.06(vs 安慰剂组 4.80)(HR = 0.46 「0.34, 0.62],P<0. 001)。亚组分析显示,三代 EGFR-TKI 经治的 HR 为 0.48(95% CI:0.35-0.66),脑转移的 HR 为 0.40(0.22-0.73)以及 T790M 突变 HR 为 0.22(0.09-0.54)。AK112 组患者 ORR 为 50.6%(vs 安慰剂组 35.4%)。
PPT 链接:https://file1.dxycdn.com/p/s183/2024/0603/179/6731689209610647971.pdf
科伦博泰
在本次会议上科伦博泰公布了两项 TROP2 ADC SKB264 的临床研究结果,分别为针对 TNBC 的 III 期临床 OptiTROP-Breast01 研究以及联合PD-L1单抗 L-A167 一线治疗晚期 NSCLC 的 II 期临床 OptiTROP-Lung01 研究结果。
2022 年 5 月默沙东以 4700 万美元首付引进SKB264(MK-2870),这也是为延长 K 药的生命周期,进军「IO+ADC」赛道所准备的粮草。
当前,据 Insight 数据库显示,SKB264 已登记启动 14 项 III 期临床试验,涉及肺癌、乳腺癌、子宫内膜癌等。
其中,肺癌领域有 7 项,除 OptiTROP-Lung01 外,还在开展两项由默沙东主导的用于治疗 3L+ EGFR 突变 NSCLC(NCT06074588),2L EGFR 突变 NSCLC(NCT06305754)以及科伦主导的针对 2L EGFR 突变 NSCLC( NCT05870319)。此外,还有 3 项探索与 K 药联用的疗效:1)一线治疗转移性鳞状 NSCLC(NCT06422143);2)治疗 PD-L1 表达 ≥ 50% 的转移性 NSCLC(NCT06170788);3)治疗未获得病理完全缓解的可切除 NSCLC(NCT06312137)。
涉及乳腺癌领域的有 5 项,TNBC 有 3 项,除 OptiTROP-Breast01 外,另有一项与 K 药联用对比研究者选择方案(TPC)治疗既往接受过新辅助治疗且在手术时未达到 pCR 的 TNBC (NCT06393374),以及在中国开展的一线治疗 PD-L1 阴性 TNBC(NCT06279364)。
SKB264(MK-2870)全球项目开发进展甘特图(III 期及以上临床阶段)
来自:Insight 数据库网页版
标题:SKB264(Sacituzumab Tirumotecan/MK-2870)联合 KL-A167(抗PD-L1)一线治疗晚期 NSCLC 患者的 II 期 OptiTROP-Lung01 研究的初步结果
试验登记号:NCT05351788
摘要编号:#8502
未曾接受过治疗的晚期无驱动基因突变 NSCLC 患者入组并按非随机方式每 3 周接受一次 5 mg/kg 剂量的 SKB264 加每 3 周接受一次 1200mg 剂量的 KL-A167 治疗(1A 队列)或每 2 周接受一次 5 mg/kg 剂量的 SKB264+每 2 周接受一次 900 mg 剂量的 KL-A167 治疗(1B 队列), 直至疾病进展或发生不可耐受毒性。
研究结果:截至 2024 年 1 月 2 日,1A 队列和 1B 队列分别入组 40 名及 63 名患者。中位年龄为 63/63 岁(1A/1B 队列);97.5%/85.7% 患者的 ECOG PS 评分为 1 分;根据 IHC 22C3 pharmDx 测定法,分别有 30.0%/33.3%、32.5%/30.2% 及 37.5%/36.5% 的患者的 PD-L1 表达为 < 1%、1%-49% 及 ≥ 50%。
1A 队列经过为期 14.0 个月的中位随访后,ORR 为 48.6%(18/37, 2 例待确 认),DCR 为 94.6%,mPFS 为 15.4 个月(95% CI: 6.7, NE), 6 个月 PFS 率为 69.2%。1B 队列经过为期 6.9 个月的中位随访后,ORR 为 77.6% (45/58, 5 例待确认),DCR 为 100%,未达到 mPFS,6 个月的 mPFS 率 为 84.6%。
1B 队列的其他亚组分析如下表所示:
*包括已确认或尚未确认缓解。ORR 基于有疗效评估的患者计算(定义为在研究期间进行过至少 1 次扫描)。
安全性方面,在 1A 和 1B 队列中,最常见的 ≥ 3 级 TRAE 为中性粒细胞计数降低(30.0%/30.2%)、WBC 降低(5.0%/17.5%)、贫血(5.0%/15.9%)、皮疹 (5.0%/6.3%)及药疹(7.5%/0)。曾发生 1B 队列的 1 名患者因出现超敏反应导致停用 SKB264 的治疗相关不良事件,但并无出现治疗相关死亡事件。
标题:芦康沙妥珠单抗(sac-TMT)(SKB264/MK-2870) 用于既往接受过治疗的局部复发或转移性 TNBC 患者的 3 期 OptiTROP-Breast01 研究
试验登记号:NCT05347134
摘要编号:#104
研究结果:患者按 1:1 随机接受 SKB264 治疗(n=130)或化疗(n=133)。患者中位年龄为 51 岁;87% 存在内脏转移;26% 既往接受过 PD-1/PD-L1 抑制剂治疗;48% 在晚期阶段接受过三线或以上的化疗。
根据期中分析(截止日期:2023 年 6 月 21 日),已达到 PFS 主要终点,相比化疗,疾病进展或死亡的风险降低 69%(HR=0.31; 95% CI: 0.22-0.45; P<0.00001)。
经 BICR 评估的 SKB264 组 mPFS 为 5.7 个月(95% CI: 4.3-7.2),化疗组为 2.3 个月(95% CI: 1.6-2.7),6 个月的 PFS 率分别为 43.4%、11.1%。在 TROP2 H 评分 >200 的患者亚组中,SKB264 组 mPFS 为 5.8 个月,化疗组为 1.9 个月(HR=0.28; 95% CI: 0.17-0.48)。
在 OS 的首次计划期中分析中(截止日期:2023 年 11 月 30 日,中位随访时间 10.4 个月),相比化疗,SKB264 组 OS 显示出具有统计学意义的显著优势(HR=0.53; 95% CI: 0.36-0.78; P=0.0005);SKB264 治疗组 mOS 尚未达到(95% CI: 11.2-NE),化疗组为 9.4 个月(95% CI:8.5-11.7)。经 BICR 评估,SKB264 组 ORR 为 43.8%,化疗组为 12.8%。
安全性方面,最常见的 ≥ 3 级 TRAE(SKB264/化疗) 为中性粒细胞计数降低 (32.3%/47.0%)、贫血(27.7%/6.1%)及白细胞计数(WBC)降低 (25.4%/36.4%)。
乐普生物
标题:评估普特利单抗联合表皮生长因子受体-ADC(EGFR-ADC)MRG003 治疗 EGFR 阳性实体瘤患者安全性和有效性的 I/II 期研究的初步结果
试验登记号:NCT05688605
摘要编号:6013
讲者:阮丹云教授 | 中山大学肿瘤防治中心
在该项 I/II 期剂量递增和扩展研究中,入组患者接受 3.0 mg/kg HX008 联合每 3 周一次的 MRG003 治疗,MRG003 剂量从 1.5 mg/kg 递增至 2.3 mg/kg。主要终点为最大耐受剂量(MTD)、推荐的 II 期剂量(RP2D)以及 ORR。次要终点包括 DOR、DCR 和 PFS。
研究结果:截至 2024 年 1 月 30 日,共入组 33 名患者(I 期部分包括:9 名 NPC,1 名 SCCHN 和 3 名其他实体瘤患者;II 期部分包括:14 名 NPC 和 6 名 SCCHN 患者)。中位年龄 52 岁(31-65 岁),其中 25 名患者(76%)为男性,11 名患者(33%)的 ECOG PS 评分为 0。
安全性方面,常见 TRAEs 包括瘙痒(46%)、皮疹(33%)、AST 升高(30%)、贫血(30%)。3-4 级 TRAEs 出现在 4 名患者(12%)中,主要是白细胞计数减少(9%)和低钾血症(6%)。唯一的剂量限制性毒性 (DLT) 事件发生在 2.3 mg/kg 剂量组, 未达到 MTD,MRG003 的推荐 II 期剂量(RP2D)由安全监测委员会(SMC)确定为 2.0 mg/kg。
在 27 名可评估的患者中,17 名患者达到 PR,7 名患者 SD,ORR 和 DCR 分别为 63.0%(95%CI: 42.4, 80.6)和 88.9%(95%CI: 70.8, 97.7)。在 II 期研究部分,9 名可评估的 EGFR 阳性 NPC 患者在接受一线治疗(PD-1 抑制剂联合铂类化疗)后进展,在这些患者中观察到 2 例 CR、5 例 PR 和 2 例 SD,ORR 和 DCR 分别为 77.8%(95%CI: 40.0, 97.2)和 100%(95%CI: 66.4, 100)。5 名可评估的初治的 EGFR 阳性 SCCHN 患者,其中 3 例 PR 和 1 例 SD,ORR 和 DCR 分别为 60%(95%CI: 14.7, 94.7)和 80%(95%CI: 28.4, 99.5)。研究中的 DOR 和 PFS 尚未成熟。治疗时间最长的患者 DOR 已超过 17 个月,且仍在持续。
摘要官网链接:https://meetings.asco.org/abstracts-presentations/234882
君实生物
君实生物包括特瑞普利单抗、Tifcemalimab 等在内的共计 30+项研究入选本次大会,涵盖头颈癌、肺癌、胃/食管癌、肝癌、结直肠癌、膀胱癌、黑色素瘤等多个领域,涉及多种组合疗法。包括多项特瑞普利单抗单药或者联合用药治疗鼻咽癌的临床进展。
标题:特瑞普利单抗或安慰剂联合吉西他滨和顺铂一线治疗复发或转移性鼻咽癌(r/m NPC)的 4 年总生存随访和 EBV 滴度动态分析
摘要:#6039
结果显示:截至 2024 年 1 月 9 日,即最后一名患者入组后 50 个月,共记录 150 例死亡事件,中位随访时间为 36.8 个月。与最终 OS 分析结果相比,特瑞普利单抗组较安慰剂组表现出一致的生存改善:
特瑞普利单抗联合 GP 化疗可显著延长 OS,两组中位 OS 分别为:尚未达到 vs 33.7 个月,将死亡风险降低 39%,HR=0.61(95%CI: 0.44-0.85),P = 0.0027。5 年 OS 率分别为 52.0% vs. 33.9%。
JUPITER-02 研究生存随访分析
标题:特瑞普利单抗新辅助和辅助联合同期放化疗治疗高风险局部晚期鼻咽癌 (LA-NPC):一项随机、双盲、安慰剂对照的 II 期研究
摘要编号:#6084
该研究是一项随机、双盲、安慰剂对照的 II 期临床研究 (NCT03925090),纳入高危局部晚期鼻咽癌患者 (III-IVA 期、EBV DNA ≥ 1500 拷贝数/ml),以 2:1 的比例随机接受特瑞普利单抗 (240 mg, Q2W) 或安慰剂诱导治疗 2 周期后,接受同期放化疗 (CCRT, RT+DDP 100 mg/m2 D1, 22, 43),之后接受特瑞普利单抗 (240 mg, Q3W) 或安慰剂维持治疗 8 周期。
自 2019 年 12 月至 2021 年 12 月,该研究共入组 150 例患者,其中特瑞普利单抗治疗组 100 例患者,安慰剂组 50 例患者。
结果显示:中位随访 26.9 个月,主要终点 2 年 PFS 率达到显著差异:与单纯 CCRT 相比,联合特瑞普利单抗治疗将 2 年 PFS 率提高了 17.9%(特瑞普利单抗组 vs 安慰剂组分别为 91.8% vs 73.9%),疾病进展或死亡风险降低了 67%(HR=0.33, 95% CI: 0.15-0.76;P=0.006)。次要终点也显示出显著获益,特瑞普利单抗组 vs. 安慰剂组的 2 年 OS 率分别为 100% vs. 94.0%,2 年 DMFS 率分别为 92.8% vs. 80.0%,2 年 LRFS 率分别为 99.0% vs. 82.0%。
安全性方面,不良事件 (AE) 总体可控,特瑞普利单抗组和安慰剂组的 ≥ 3 级治疗相关不良事件 (TRAE) 发生率相似,分别为 73.7% vs. 68.0%。未发生特瑞普利单抗治疗相关的死亡。
标题:一项诱导化疗后序贯同步放化疗联合特瑞普利单抗和恩度用于高风险局部晚期鼻咽癌的多中心、随机、II 期研究
摘要编号:#6086
该项多中心、随机、II 期研究评价了在局部晚期高危型鼻咽癌的 IC-CCRT(诱导化疗序贯同步放化疗)中同时使用特瑞普利单抗和恩度(重组人血管内皮抑制素)的有效性和安全性。
研究纳入高危型 LA-NPC 患者,并按 1: 1 的比例随机分配至 IC-CCRT+TE 组(吉西他滨和顺铂诱导化疗后同步放化疗联合特瑞普利单抗和恩度)或 IC-CCRT 组(吉西他滨和顺铂诱导化疗后同步放化疗)。特瑞普利单抗 240 mg/d1 静脉滴注,每 3 周一次,至多共 12 个周期(诱导 3 个周期,同步 2 个周期,辅助治疗 7 个周期)。恩度 7.5 mg/m2/d1-10 持续静脉泵入,每 3 周一次,共 5 个周期(诱导 3 个周期,同步 2 个周期)。
自 2020 年 9 月 7 日至 2022 年 8 月 23 日,共 106 名符合条件的患者被随机分配到 IC-CCRT+TE 组(n = 53)和 IC-CCRT 组(n = 53)。
中位随访时间为 25 个月,结果显示:与 IC-CCRT 组相比,联合特瑞普利单抗和恩度治疗的 IC-CCRT+TE 组患者 PFS 显著更优(HR = 0.36,P = 0.041)。IC-CCRT+TE 组接受诱导化疗后 28 例(52.8%)患者达到 CR,IC-CCRT 组诱导化疗后 5 例(9.4%)患者达到 CR,具有明显的统计学差异(P<0.001)。
两组 ≥ 3 级晚期 AE 发生率相似,分别为 5.8% 和 5.7%,差异无明显统计学意义。≥ 3 级免疫相关不良事件 (irAE) 发生率仅为 4.7%。
百济、翰森制药、中国生物制药…
更多国内企业亮相
此外,另有百济、翰森制药、中国生物制药、贝达药业、科济药业、康诺亚等众多国内药企亮相本次会议。
百济神州公布了泽布替尼新数据,包括比较泽布替尼与阿卡替尼在复发/难治性 CLL 患者中疗效的网络荟萃分析,泽布替尼对比伊布替尼的 ALPINE 3 期研究事后分析等。
翰森制药公布了 B7-H3 ADC HS-20093 在复发或难治性骨与软组织肉瘤中的 II 期 ARTEMIS-002 研究,在 38 例可评估的骨肉瘤患者中,12.0mg/kg 组 ORR 为 17.4%,mPFS 未达到;8mg/kg 组 mPFS 为 4.0 个月。20 例其他骨与软组织肉瘤患者均为疗效可评估患者,ORR 为 25%,mPFS 为7.1个月。
正大天晴在本次大会上首次公布了 HER2 双抗 TQB2930 在乳腺癌患者中的 Ib 期临床研究(NCT06202261)数据:31 例受试者可疗效评价,ORR 为 25.8%,其中 PR 8 例;mPFS 为 5.5 个月 (95%CI 3.58-NE)。
新型 BET 抑制剂 TQB3617 在晚期恶性肿瘤受试者的 I 期临床试验结果,在 28 例接受疗效评估的淋巴瘤中,ORR 为 39.3%(11/28),其中 4 例 CR,7 例 PR。目前全球无同类产品上市。当前正大天晴正在开展一项罗伐昔替尼(TQ05105)联合 TQB3617 治疗中高危骨髓纤维化的 Ib/II 期临床研究(NCT06122831)。
科济药业则公布了靶向 CLDN18.2 的自体 CAR-T CT041 治疗胃肠道肿瘤患者的 I 期临床研究数据,所有患者的 ORR 和 DCR 分别达到 37.8% 和 75.5%。同样针对 CLDN18.2 靶点,康诺亚布局的 ADC 新药 CMG901(AZD0901)本次会上更新了治疗晚期胃癌/胃食管结合部腺癌的 I 期临床研究最新数据,所有 93 例受试者的 mOS 为 11.8 个月。
贝达药业披露了 EGFR/cMET双抗 MCLA-129 在晚期非小细胞肺癌的 Ⅰ 期数据,针对 MET14 跳跃突变 NSCLC 患者,经过 MET 抑制剂治疗后,MCLA-129 ORR 达 37.5%。
封面来源:站酷海洛 Plus
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
编辑:Hebe
PR 稿对接:微信 insightxb
投稿:微信 insightxb;邮箱 insight@dxy.cn
多样化功能、可溯源数据……
Insight 数据库网页版等你体验
点击阅读原文,立刻解锁!
临床结果临床1期ASCO会议抗体药物偶联物
100 项与 TQB-3617 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| 骨髓纤维化 | 临床2期 | 中国 | 2023-11-21 | |
| 肿瘤 | 临床1期 | 中国 | 2022-01-05 | |
| 晚期癌症 | 临床1期 | 中国 | 2021-12-21 |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
临床1期 | 36 | 願鬱築築廠築襯鏇憲構(構夢顧蓋廠醖襯膚憲選) = 廠簾艱範遞鑰積淵築淵 糧鹽顧顧憲廠衊襯範簾 (餘鏇簾獵遞選醖願顧鑰 ) | 积极 | 2024-05-24 | |||
願鬱築築廠築襯鏇憲構(醖餘糧觸鬱鹽壓觸鏇繭) = 網糧觸窪構製餘鬱繭鹹 廠願膚窪積淵憲衊膚蓋 (觸鬱壓觸製構艱選餘襯 ) 更多 |
登录后查看更多信息
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
药物交易
使用我们的药物交易数据加速您的研究。
登录
或

核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或
批准
利用最新的监管批准信息加速您的研究。
登录
或

特殊审评
只需点击几下即可了解关键药物信息。
登录
或

标准版
¥16800
元/账号/年
新药情报库 | 省钱又好用!
立即使用
来和芽仔聊天吧
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用


