预约演示
更新于:2025-05-07
GUB-014295
更新于:2025-05-07
概要
基本信息
关联
1
项与 GUB-014295 相关的临床试验NCT06144684
A Two-Part First-in-Human Study to Assess the Safety, Tolerability, Pharmacokinetics and Pharmacodynamics of Single and Multiple Ascending Subcutaneous Doses of GUB014295 in Lean to Overweight or Obese But Otherwise Healthy Men and Women
This is a two-part, single centre, double-blind (within cohorts), randomised, placebo-controlled, single (Part 1) and multiple (Part 2) ascending subcutaneous dose study in lean to overweight or obese but otherwise healthy men (Part 1) and men and non-pregnant, non-lactating women (Part 2). The primary objective is to assess the safety and tolerability. Secondary objectives are to characterize the pharmacokinetics (PK) and to investigate pharmacodynamic effects.
开始日期2023-11-29 |
申办/合作机构  Gubra A/S Gubra A/S [+1] |
100 项与 GUB-014295 相关的临床结果
登录后查看更多信息
100 项与 GUB-014295 相关的转化医学
登录后查看更多信息
100 项与 GUB-014295 相关的专利(医药)
登录后查看更多信息
1
项与 GUB-014295 相关的文献(医药)2021-12-01·The Lancet1区 · 医学
Long-acting amylin analogue for weight reduction
1区 · 医学
Article
作者: Gadde, Kishore M ; Allison, David B
22
项与 GUB-014295 相关的新闻(医药)2025-04-25
Reports First-Quarter Diluted EPS of $0.72 on a GAAP Basis, a Decrease of 6.5 Percent; Adjusted Diluted EPS of $2.46, an Increase of 6.5 Percent; These Results Include an Unfavorable Impact of $0.13 Per Share Related to Acquired IPR&D and Milestones Expense
Delivers First-Quarter Net Revenues of $13.343 Billion, an Increase of 8.4 Percent on a Reported Basis or 9.8 Percent on an Operational Basis
First-Quarter Global Net Revenues from the Immunology Portfolio Were $6.264 Billion, an Increase of 16.6 Percent on a Reported Basis, or 18.1 Percent on an Operational Basis; Global Skyrizi Net Revenues Were $3.425 Billion; Global Rinvoq Net Revenues Were $1.718 Billion; Global Humira Net Revenues Were $1.121 Billion
First-Quarter Global Net Revenues from the Neuroscience Portfolio Were $2.282 Billion, an Increase of 16.1 Percent on a Reported Basis, or 17.0 Percent on an Operational Basis; Global Vraylar Net Revenues Were $765 Million; Global Botox Therapeutic Net Revenues Were $866 Million; Combined Global Ubrelvy and Qulipta Net Revenues Were $433 Million
First-Quarter Global Net Revenues from the Oncology Portfolio Were $1.633 Billion, an Increase of 5.8 Percent on a Reported Basis, or 7.5 Percent on an Operational Basis; Global Imbruvica Net Revenues Were $738 Million; Global Venclexta Net Revenues Were $665 Million; Global Elahere Net Revenues Were $179 Million
First-Quarter Global Net Revenues from the Aesthetics Portfolio Were $1.102 Billion, a Decrease of 11.7 Percent on a Reported Basis, or 10.2 Percent on an Operational Basis; Global Botox Cosmetic Net Revenues Were $556 Million; Global Juvederm Net Revenues Were $231 Million
Raises 2025 Adjusted Diluted EPS Guidance Range from $11.99 - $12.19 to $12.09 - $12.29, which Includes an Unfavorable Impact of $0.13 Per Share Related to Acquired IPR&D and Milestones Expense Incurred Year-To-Date Through the First Quarter 2025
NORTH CHICAGO, Ill., April 25, 2025 /PRNewswire/ -- AbbVie (NYSE:ABBV) announced financial results for the first quarter ended March 31, 2025.
"AbbVie's first-quarter results were well ahead of our expectations and reflect an excellent start to the year," said Robert A. Michael, chief executive officer, AbbVie. "The fundamentals of our business are strong and we continue to bolster our outlook with pipeline advancements and strategic investments. Based on the progress we are making, AbbVie is well positioned for the long term."
First
-Quarter Results
Worldwide net revenues were $13.343 billion, an increase of 8.4 percent on a reported basis, or 9.8 percent on an operational basis.
Global net revenues from the immunology portfolio were $6.264 billion, an increase of 16.6 percent on a reported basis, or 18.1 percent on an operational basis.
Global Skyrizi net revenues were $3.425 billion, an increase of 70.5 percent on a reported basis, or 72.0 percent on an operational basis.
Global Rinvoq net revenues were $1.718 billion, an increase of 57.2 percent on a reported basis, or 59.7 percent on an operational basis.
Global Humira net revenues were $1.121 billion, a decrease of 50.6 percent on a reported basis, or 49.5 percent on an operational basis.
Global net revenues from the neuroscience portfolio were $2.282 billion, an increase of 16.1 percent on a reported basis, or 17.0 percent on an operational basis.
Global Vraylar net revenues were $765 million, an increase of 10.3 percent.
Global Botox Therapeutic net revenues were $866 million, an increase of 15.8 percent on a reported basis, or 17.0 percent on an operational basis.
Global Ubrelvy net revenues were $240 million, an increase of 17.8 percent on a reported basis, or 18.0 percent on an operational basis.
Global Qulipta net revenues were $193 million, an increase of 47.6 percent on a reported basis, or 48.3 percent on an operational basis.
Global net revenues from the oncology portfolio were $1.633 billion, an increase of 5.8 percent on a reported basis, or 7.5 percent on an operational basis.
Global Imbruvica net revenues were $738 million, a decrease of 11.9 percent.
Global Venclexta net revenues were $665 million, an increase of 8.3 percent on a reported basis, or 12.3 percent on an operational basis.
Global Elahere net revenues were $179 million.
Global net revenues from the aesthetics portfolio were $1.102 billion, a decrease of 11.7 percent on a reported basis, or 10.2 percent on an operational basis.
Global Botox Cosmetic net revenues were $556 million, a decrease of 12.3 percent on a reported basis, or 10.7 percent on an operational basis.
Global Juvederm net revenues were $231 million, a decrease of 22.2 percent on a reported basis, or 20.0 percent on an operational basis.
On a GAAP basis, gross margin in the first quarter was 70.0 percent. The adjusted gross margin was 84.1 percent.
On a GAAP basis, selling, general and administrative (SG&A) expense was 24.7 percent of net revenues. The adjusted SG&A expense was 24.6 percent of net revenues.
On a GAAP basis, research and development (R&D) expense was 15.5 percent of net revenues. The adjusted R&D expense was 15.4 percent of net revenues.
Acquired IPR&D and milestones expense was 1.9 percent of net revenues.
On a GAAP basis, operating margin in the first quarter was 28.0 percent. The adjusted operating margin was 42.3 percent.
Net interest expense was $627 million.
On a GAAP basis, the tax rate in the quarter was 22.4 percent. The adjusted tax rate was 14.2 percent.
Diluted EPS in the first quarter was $0.72 on a GAAP basis. Adjusted diluted EPS, excluding specified items, was $2.46. These results include an unfavorable impact of $0.13 per share related to acquired IPR&D and milestones expense.
Recent Events
AbbVie announced that its board of directors unanimously elected chief executive officer (CEO) Robert A. Michael to assume the additional position of chairman of the board of directors, effective July 1, 2025. He will succeed Richard A. Gonzalez, who formerly served as AbbVie's CEO and has been chairman since the Company's formation in 2013.
AbbVie announced that the European Commission (EC) granted marketing authorization to Rinvoq (upadacitinib) for the treatment of giant cell arteritis (GCA) in adult patients. The approval was supported by data from the pivotal Phase 3 SELECT-GCA trial which demonstrated that Rinvoq achieved the primary endpoint of sustained remission and key secondary endpoints, including reduction in disease flares, lower cumulative steroid exposure and complete remission. This authorization marks the eighth approved indication for Rinvoq in the European Union (EU).
At the Society of Gynecologic Oncology (SGO) Annual Meeting, AbbVie announced final data analysis from the Phase 3 MIRASOL trial evaluating the efficacy and safety of Elahere (mirvetuximab soravtansine-gynx) in women with folate receptor alpha (FRα)-positive platinum-resistant ovarian cancer (PROC) compared to chemotherapy. At 30.5 months median follow-up, treatment with Elahere continued to show significant improvements in progression-free survival (PFS) and overall survival (OS) compared to investigator's choice (IC) chemotherapy.
AbbVie and Xilio Therapeutics, a clinical-stage biotechnology company, announced a collaboration and option-to-license agreement that will combine AbbVie's oncology expertise with Xilio's proprietary tumor-activation technology to develop novel immunotherapies, including masked T-cell engagers, for people living with cancer.
AbbVie announced that it submitted a Biologics License Application (BLA) to the U.S. Food and Drug Administration (FDA) for approval of trenibotulinumtoxinE (BoNT/E) for the treatment of moderate to severe glabellar lines. TrenibotulinumtoxinE is a first-in-class botulinum neurotoxin serotype E characterized by a rapid onset of action as early as 8 hours after administration and short duration of effect of 2-3 weeks. If approved, trenibotulinumtoxinE will be the first neurotoxin of its kind available to patients.
Allergan Aesthetics announced that the Allergan Medical Institute (AMI) will open three new state-of-the-art training centers in the U.S., expanding access to high-quality, tailored training for licensed aesthetics providers. The first training center is scheduled to open in Irvine, CA, with additional locations to follow in Atlanta, GA and Austin, TX.
AbbVie and Gubra announced a license agreement to develop GUB014295 (ABBV-295), a potential best-in-class, long-acting amylin analog for the treatment of obesity. This partnership marks AbbVie's entrance into the obesity field and under the terms of the agreement, AbbVie will lead development and commercialization of GUB014295 globally. Prior to the close of the agreement, Gubra announced positive interim results from Part A of a Phase 1 multiple ascending dose (MAD) study, which showed that GUB014295 was well tolerated with body weight loss that was sustained in a manner consistent with data from a previously announced single ascending dose (SAD) study.
AbbVie announced that the FDA approved Emblaveo (aztreonam and avibactam), as the first monobactam/β-lactamase inhibitor combination antibiotic therapy to treat complicated intra-abdominal infections, including those caused by Gram-negative bacteria. The approval of Emblaveo was supported by prior findings regarding the efficacy and safety of aztreonam for the treatment of complicated intra-abdominal infections as well as clinical trial results from the Phase 3 REVISIT study, which evaluated the efficacy, safety, and tolerability of Emblaveo for the treatment of serious infections due to Gram-negative bacteria.
Full-Year 2025 Outlook
AbbVie is raising its adjusted diluted EPS guidance for the full year 2025 from $11.99 - $12.19 to $12.09 - $12.29, which includes an unfavorable impact of $0.13 per share related to acquired IPR&D and milestones expense incurred year-to-date through the first quarter 2025. The company's 2025 adjusted diluted EPS guidance excludes any impact from acquired IPR&D and milestones that may be incurred beyond the first quarter of 2025, as both cannot be reliably forecasted. This guidance does not reflect the acquired IPR&D and milestones impact related to AbbVie and Gubra's licensing agreement to develop GUB014295, as that transaction closed after the first quarter of 2025. Additionally, this guidance is based on the existing trade environment and does not reflect any trade policy shifts, including pharmaceutical sector tariffs, that could impact AbbVie's business.
About AbbVie
AbbVie's mission is to discover and deliver innovative medicines that solve serious health issues today and address the medical challenges of tomorrow. We strive to have a remarkable impact on people's lives across several key therapeutic areas: immunology, neuroscience, oncology, and eye care - and products and services across our Allergan Aesthetics portfolio. For more information about AbbVie, please visit us at . Follow @abbvie on X (formerly Twitter), Facebook, Instagram, YouTube or LinkedIn.
Conference Call
AbbVie will host an investor conference call today at 8:00 a.m. Central Time to discuss our first-quarter performance. The call will be webcast through AbbVie's Investor Relations website at investors.abbvie.com. An archived edition of the call will be available after 11:00 a.m. Central Time.
Non-GAAP Financial Results
Financial results for 2025 and 2024 are presented on both a reported and a non-GAAP basis. Reported results were prepared in accordance with GAAP and include all revenue and expenses recognized during the period. Non-GAAP results adjust for certain non-cash items and for factors that are unusual or unpredictable, and exclude those costs, expenses, and other specified items presented in the reconciliation tables later in this release. AbbVie's management believes non-GAAP financial measures provide useful information to investors regarding AbbVie's results of operations and assist management, analysts, and investors in evaluating the performance of the business. Non-GAAP financial measures should be considered in addition to, and not as a substitute for, measures of financial performance prepared in accordance with GAAP.
Forward-Looking Statements
Some statements in this news release are, or may be considered, forward-looking statements for purposes of the Private Securities Litigation Reform Act of 1995. The words "believe," "expect," "anticipate," "project" and similar expressions and uses of future or conditional verbs, generally identify forward-looking statements. AbbVie cautions that these forward-looking statements are subject to risks and uncertainties that may cause actual results to differ materially from those expressed or implied in the forward-looking statements. Such risks and uncertainties include, but are not limited to, challenges to intellectual property, competition from other products, difficulties inherent in the research and development process, adverse litigation or government action, changes to laws and regulations applicable to our industry, the impact of global macroeconomic factors, such as economic downturns or uncertainty, international conflict, trade disputes and tariffs, and other uncertainties and risks associated with global business operations. Additional information about the economic, competitive, governmental, technological and other factors that may affect AbbVie's operations is set forth in Item 1A, "Risk Factors," of AbbVie's 2024 Annual Report on Form 10-K, which has been filed with the Securities and Exchange Commission, as updated by its Quarterly Reports on Form 10-Q and in other documents that AbbVie subsequently files with the Securities and Exchange Commission that update, supplement or supersede such information. AbbVie undertakes no obligation, and specifically declines, to release publicly any revisions to forward-looking statements as a result of subsequent events or developments, except as required by law.
SOURCE AbbVie
WANT YOUR COMPANY'S NEWS FEATURED ON PRNEWSWIRE.COM?
440k+
Newsrooms &
Influencers
9k+
Digital Media
Outlets
270k+
Journalists
Opted In
GET STARTED
临床结果临床3期引进/卖出临床1期财报
2025-04-16
·药时代
2025年3月,生物制药公司加速了在小分子药物、双特异性抗体和蛋白治疗药物等领域的药物开发。阿斯利康和诺和诺德是当月主要的合作伙伴,此外,相较于二月,并购也有所增加。本文将带您了解2025年3月生物技术和制药领域的一些重要交易。(图片来源:LABIOTECH)注:2025年3月,勃林格殷格翰和第一三共等制药巨头参与了并购和许可交易,但交易规模未被披露。3月生物制药大型公司的并购阿斯利康以高达10亿美元的价格收购了比利时生物技术公司EsoBiotec,这是当月生物制药领域的重要并购交易之一。EsoBiotec的ENaBL平台(EsoBiotec Engineered NanoBody Lentiviral平台)通过慢病毒载体将遗传指令传递给特定的免疫细胞(如T细胞),使其能够识别并摧毁癌细胞或自身免疫性疾病中的异常细胞。ENaBL平台的创新之处在于其体内(in vivo)治疗方式,能够通过简单的静脉注射实现,而无需传统细胞疗法所需的复杂体外细胞修改过程。这种技术不仅简化了治疗流程,还显著降低了治疗成本,并有望提高治疗的可及性和患者体验。阿斯利康的此次收购包括4.25亿美元的初始支付,以及基于开发和监管里程碑的额外5.75亿美元支付。交易预计将在2025年第二季度完成。百时美施贵宝(BMS)以2.86亿美元的价格启动了对美国生物技术公司2seventy bio的收购。根据新闻稿,BMS将发起一项要约收购,以每股5美元的全现金交易方式收购2seventy bio所有未发行的股份。两家公司多年来一直合作开发和商业化Abecma,这是一种用于治疗多发性骨髓瘤的CAR-T细胞疗法,于2021年获得美国FDA批准。赛诺菲(Sanofi)收购了总部位于加利福尼亚的抗体开发商Dren Bio的双特异性髓系细胞接合剂。临床候选药物DR-0201是一种抗体,它靶向并激活特定的髓系细胞——起源于骨髓的免疫细胞,通过靶向吞噬作用诱导深度B细胞耗竭,这是一种清除病原体和细胞碎片的机制。在研究中,它已显示出B细胞耗竭的效果。作为交换,赛诺菲将向Dren支付6亿美元的预付款,并在开发和上市里程碑基础上支付高达13亿美元的款项。在印度,太阳制药(Sun Pharma)以高达3.55亿美元的预付款和里程碑付款收购了美国生物技术公司Checkpoint Therapeutics。Checkpoint Therapeutics除了开发检查点抑制剂外,还开发了其他抗体。太阳制药将获得Checkpoint的抗PD-L1抗体cosibelimab,其品牌名为Unloxcyt,该药于2024年12月获得美国FDA批准,用于治疗晚期皮肤鳞状细胞癌(一种起源于鳞状细胞的皮肤癌)。根据协议,太阳制药将以每股4.10美元的现金支付方式收购Checkpoint的所有流通股,总预付款高达3.55亿美元。此外,Checkpoint的股东还将获得一项非可转让的或有价值权利(CVR),如果cosibelimab在欧洲获得批准,他们将有权获得每股额外0.70美元的现金支付,从而使交易总价值可能达到约4.16亿美元。太阳制药计划利用其全球影响力加速Unloxcyt的患者可及性。此次收购不仅将增强太阳制药在肿瘤-皮肤治疗领域的创新组合,还反映了其改善皮肤癌患者生活的承诺。日本制药公司Taiho收购了瑞士生物技术公司Araris,预付款和里程碑付款总额高达11.4亿美元。Araris是一家从瑞士保罗谢勒研究所(Paul Scherrer Institute)分拆出来的公司,专注于开发抗体-药物偶联物(ADCs)。这些ADCs将补充其癌症治疗产品线,其中包括小分子药物。此次收购将使Taiho获得Araris的创新ADC药物发现技术平台AraLinQ™,该平台通过其独特的技术开发的三种产品,目前处于临床前阶段,预计将在2025年至2026年间进入临床试验。(图片来源:LABIOTECH)3月交易热点领域2025年3月份制药巨头主要将目光聚焦于蛋白质疗法领域。美国制药巨头艾伯维(AbbVie)与丹麦生物技术公司Gubra达成了一项许可协议,共同开发GUB014295,这是一种潜在的长效胰淀素类似物,用于治疗肥胖症。GUB014295是一种特异性激活胰淀素和降钙素受体的激动剂,胰淀素是一种饱腹感激素,因其在激活大脑信号、抑制食欲和减少食物摄入中的作用,已被确定为治疗肥胖症的潜在治疗靶点。根据协议条款,艾伯维将主导GUB014295的全球开发和商业化活动。Gubra将获得3.5亿美元的预付款,并有资格获得高达18.75亿美元的开发、商业和销售里程碑付款,以及全球净销售额的分级版税。此次合作标志着艾伯维正式进入肥胖治疗领域。瑞士制药巨头罗氏(Roche)与丹麦肽类公司Zealand Pharma达成许可协议,共同开发肥胖治疗药物。该药物名为petrelintide,双方将共同开发并商业化,包括与罗氏的GLP-1/GIP受体双重激动剂CT-388等联合疗法。Zealand将获得16.5亿美元的预付款,并有资格获得高达12亿美元的开发里程碑付款(与petrelintide进入III期试验相关),以及24亿美元的销售里程碑付款。阿斯利康(AstraZeneca)除了以高达10亿美元收购比利时生物技术公司EsoBiotec外,还与元思生肽达成了一项许可协议,共同开发大环肽药物。大环肽是由氨基酸组成的短链分子,能够形成环状结构,具有独特的稳定性和靶向性。这些药物旨在治疗慢性疾病,包括罕见病、自身免疫疾病和代谢疾病。根据协议,元思生肽将获得7500万美元的预付款和近期支付款项,并有资格获得高达34亿美元的开发和商业化里程碑付款。这项合作将利用元思生肽的Synova™平台技术,开发针对多种疾病的大环肽药物管线。诺和诺德(Novo Nordisk)和马萨诸塞州初创公司Gensaic在蛋白质疗法领域展开合作。借助Gensaic的人工智能驱动的蛋白质设计技术和诺和诺德在治疗领域的专业知识,双方旨在开发用于治疗心脏和代谢疾病的药物候选。Gensaic有资格获得高达3.54亿美元的预付款、开发和商业里程碑付款。小分子药物是制药公司长期以来热点交易领域。默克(Merck)与恒瑞制药达成了一项交易,这是3月最大的小分子药物交易。该交易涉及恒瑞制药的一种口服脂蛋白(a)抑制剂,目前该药物正在中国进行II期临床试验。脂蛋白(a)是一种携带胆固醇、脂肪和蛋白质的蛋白质,当它们积累时,会形成类似于低密度脂蛋白胆固醇的斑块。抑制剂药物旨在防止这些斑块的形成,从而降低心脏病的风险。根据协议,默克将向恒瑞制药支付2亿美元的预付款,并在达到特定里程碑时支付高达17.7亿美元的款项。此前,默克在2025年2月与加拿大生物技术公司Epitopea达成协议,以识别肿瘤特异性抗原。诺和诺德(Novo Nordisk)与美国生物技术公司Lexicon达成了一项合作,共同开发小分子药物LX9851。LX9851是一种口服非肠促胰岛素类药物,用于治疗肥胖症及其他代谢紊乱。根据协议,诺和诺德将支付高达10亿美元,其中包括7500万美元的预付款和近期里程碑付款。此外,Lexicon还将获得基于开发、监管和销售的里程碑付款,以及LX9851净销售额的分级特许权使用费。诺华(Novartis)与日本制药公司杏林制药(Kyorin)达成合作,共同推进一款小分子药物KRP-M223的研发。KRP-M223是一种G蛋白偶联受体MRGPRX2的拮抗剂,该受体激活肥大细胞,这在慢性自发性荨麻疹等疾病中会发生,其特征是瘙痒的风团。KRP-M223旨在治疗这些疾病。根据协议,诺华公司获得了KRP-M223的全球独家开发、生产和商业化许可。杏林制药保留了在日本商业化和为日本市场生产该产品的选择权。杏林制药将获得5500万美元的预付款,并有资格获得高达7.775亿美元的开发、批准和商业化里程碑付款,以及基于净销售额的分级特许权使用费。马萨诸塞州的Black Diamond Therapeutics与法国生物技术公司Servier达成了一项合作,共同开发靶向小分子药物BDTX-4933,用于治疗癌症。BDTX-4933是一种针对实体瘤中RAS突变和RAF改变的I期候选药物。根据协议,Black Diamond将获得7000万美元的预付款,并有资格获得高达7.1亿美元的里程碑付款。(图片来源:LABIOTECH)注:上述数据基于已披露财务条款的并购和许可交易(包括前期付款和里程碑付款)。除了蛋白质疗法领域、小分子领域以外双特异性抗体领域备也受瞩目。2025年3月,阿斯利康(AstraZeneca)与和铂医药达成了一项全球战略合作,旨在利用和铂医药的Harbour Mice®全人源抗体技术平台,发现和开发下一代多特异性抗体,用于治疗免疫学、肿瘤学等领域的疾病。根据协议,阿斯利康将获得两个临床前免疫学项目的许可选择权,并可指定进一步的靶点,供和铂医药发现下一代多特异性抗体。阿斯利康将有权将这些项目推进至临床开发阶段。作为合作的一部分,和铂医药将获得总计1.75亿美元的预付款和近期里程碑付款,以及高达44亿美元的额外开发和商业化里程碑付款,还有基于未来净销售额的分级特许权使用费。此外,阿斯利康还将对和铂医药进行1.05亿美元的股权投资,获得其9.15%的新发行股份。为了支持合作项目,和铂医药将在中国北京建立一个创新中心,与阿斯利康共同开展研发工作。此次合作不仅体现了阿斯利康对和铂医药技术平台的信心,也标志着和铂医药在多特异性生物制品创新领域的领先地位。通过结合和铂医药的前沿发现能力和阿斯利康的药物开发专长,双方旨在加速为未满足医疗需求的患者创造变革性疗法。瑞士制药巨头罗氏(Roche)与英国生物技术公司Oxford BioTherapeutics达成了一项合作,旨在利用Oxford BioTherapeutics的OGAP-Verify发现平台,开发用于治疗癌症的潜在FIC抗体疗法。OGAP-Verify平台是一种增强型专有发现平台,能够提高靶点识别的灵敏度,从而筛选出更适合药物开发的靶点。根据协议,Oxford BioTherapeutics将获得3600万美元的预付款,并有资格获得超过10亿美元的里程碑付款,以及基于净销售额的产品特许权使用费。罗氏将负责这些靶点的进一步研究、开发和商业化工作。日本制药公司推出RNA药物2025年3月,日本小野制药公司(Ono Pharmaceutical)与美国Ionis制药公司达成了一项独家许可协议,以获得后者针对真性红细胞增多症(PV)的RNA靶向疗法sapablursen的全球权利。sapablursen是一种配体结合反义(LICA)药物,旨在减少TMPRSS6的产生,从而增加铁调素的表达,为PV等血液病提供潜在的治疗益处。该疗法目前正在全面招募的II期IMPRSSION研究中进行评估。根据协议,小野制药将支付2.8亿美元的预付款,并根据开发、监管和销售里程碑的达成情况,额外支付最高可达6.6亿美元的款项。此外,小野制药还将按sapablursen年度净销售额的百分之十几向Ionis支付特许权使用费。Ionis将继续负责完成正在进行的II期IMPRSSION研究,而小野制药将全权负责后续的开发、监管申报和商业化工作。日本第一三共公司(Daiichi Sankyo)与美国Nosis Biosciences公司达成了一项合作,旨在利用Nosis的Connexa™平台开发用于治疗慢性疾病的RNA药物。该平台是一种先进的人工智能驱动的药物设计和递送系统,能够使RNA药物靶向关键器官中的多种细胞类型,从而改善慢性疾病的治疗选择。此次合作将利用该平台在人工智能药物设计、单细胞受体生物学和高通量化学方面的能力,以克服RNA疗法面临的递送挑战。Nosis的Connexa™平台通过整合人工智能驱动的药物设计、单细胞受体生物学和高通量化学,开发出针对体内使用的优化递送载体。该平台已经确定了532种细胞类型中的2900多个受体靶点,从而实现精准递送和优化的治疗效果。通过这次合作,预计将进一步推动多种疾病的精准RNA药物的研发进展。药物研发加速2025年3月,诺和诺德(Novo Nordisk)与联邦生物达成了一项独家许可协议,以获得后者开发的UBT251的全球权利。UBT251是一种GLP-1、GIP和胰高血糖素受体的三重激动剂,目前正处于临床早期试验阶段,用于治疗肥胖症、2型糖尿病及其他疾病。根据协议,诺和诺德将获得UBT251在全球范围内(不包括中国大陆、香港、澳门和台湾)的独家开发、生产和商业化权利。联邦生物将保留UBT251在中国大陆、香港、澳门和台湾的权利。联邦生物将获得2亿美元的预付款,并有资格获得高达18亿美元的潜在里程碑付款,以及基于净销售额的分级特许权使用费。德国制药巨头勃林格殷格翰(Boehringer Ingelheim)与瑞典生物技术公司Salipro Biotech达成了一项研究和许可协议,旨在加速多个药物靶点的开发。此次合作将利用Salipro的Salipro®平台技术,该技术能够稳定膜蛋白,使其保持其天然形式,从而用于药物发现项目。勃林格殷格翰将利用该技术进行生物物理和结构研究,包括冷冻电镜(cryoEM),以识别潜在的治疗候选药物。合作的重点是开发针对G蛋白偶联受体(GPCRs)、离子通道、转运蛋白及其他膜蛋白的疗法,这些靶点在心理健康和心肾代谢疾病等治疗领域具有重要意义。根据协议,Salipro Biotech将获得研究付款和选择权付款,并有资格获得基于勃林格殷格翰在合作中产生的开发结果的成功基础里程碑付款。英国医疗保健公司Hologen AI与美国生物技术公司MeiraGTx达成了一项战略合作,旨在加速MeiraGTx的AAV-GAD项目(用于治疗帕金森病)的III期临床试验。Hologen AI将提供2亿美元的预付款,并与MeiraGTx成立一家名为Hologen Neuro AI的合资企业,Hologen AI将为该合资企业提供高达2.3亿美元的承诺资本,用于全面资助AAV-GAD的开发直至商业化,以及推进其他早期临床项目,包括针对遗传性肥胖的AAV-BDNF项目。MeiraGTx将保留Hologen Neuro AI合资企业30%的所有权,并将领导所有临床开发和制造活动。此外,MeiraGTx还将与合资企业签订独家临床和商业制造供应协议。Hologen AI还将持有MeiraGTx制造子公司的少数股权,并将为该制造子公司提供年度资金支持,同时利用其AI技术优化MeiraGTx的专有制造能力。德国AI公司Partex与美国生物制药公司Fortress Biotech达成了一项战略合作,旨在利用人工智能技术识别和评估潜在的生物制药化合物,以供Fortress进行潜在的收购或许可,本次合作的财务条款未被披露。Partex将部署其专有的AI驱动药物发现和开发技术平台,该平台能够提供多样化的建议,包括跨治疗领域的靶点识别、适应症扩展和分子特征分析,从而加速创新疗法的开发。Fortress Biotech将利用Partex的AI平台,结合其在生物制药领域的专业知识和广泛的行业网络,快速识别和评估有前景的生物制药资产。Fortress的业务模式专注于通过产品收入、股权持有以及股息和特许权使用费收入来提升股东的长期价值。此次合作预计将支持差异化资产的引进授权,双方都致力于在这一过程中最大限度地发挥AI的潜力。(图片来源:LABIOTECH)(图片来源:LABIOTECH)参考资料https://www.labiotech.eu/trends-news/top-biotech-deals-of-march-2025/其余素材来源官方媒体/网络新闻图片来源:123RF版权声明/免责声明本文为授权转载文章。本文仅作信息交流之目的,不提供任何商用、医用、投资用建议。文中图片、视频、字体、音乐等素材或为药时代购买的授权正版作品,或来自微信公共图片库,或取自公司官网/网络,部分素材根据CC0协议使用,版权归拥有者,药时代尽力注明来源。如有任何问题,请与我们联系。衷心感谢!药时代官方网站:www.drugtimes.cn联系方式:电话:13651980212微信:27674131邮箱:contact@drugtimes.cn点击这里,查看更多精彩!
并购免疫疗法细胞疗法
2025-04-09
The therapy was discovered and developed by AbbVie. Credit: © AbbVie Inc. All rights reserved.
The European Commission (EC) has granted marketing authorisation for AbbVie’s once-a-day treatment Rinvoq (upadacitinib) 15mg for adults with giant cell arteritis (GCA).
It is the first and only oral Janus kinase inhibitor approved in the European Union, Liechtenstein, Norway and Iceland, for this indication.
GCA is an autoimmune condition, predominantly affecting individuals over 50, with the highest incidence between 70 and 80 years of age.
The condition leads to the inflammation of the aorta, the temporal and cranial arteries, and other large and medium arteries.
The authorisation of Rinvoq is based on data from the multicentre Phase III SELECT-GCA trial, which was structured to assess the efficacy and safety of the therapy in 428 GCA subjects.
The trial met its primary and key secondary endpoints, demonstrating that 46.4% of subjects treated with 15 mg of the therapy plus a steroid taper regimen for 26 weeks achieved sustained remission at week 52 versus 29% of those on placebo with a steroid taper regimen.
AbbVie research and development, chief scientific officer and executive vice-president Roopal Thakkar stated: “The EC approval of Rinvoq in GCA provides patients and physicians with a new treatment option and the first oral advanced therapy for adults living with GCA – a particularly vulnerable population due to older age and frequent comorbidities.”
The therapy has previously gained approval in the EU for conditions including psoriatic arthritis, radiographic axial spondylarthritis and Crohn’s disease.
Rinvoq has been discovered and developed by company scientists and is currently under investigation for other immune-mediated inflammatory conditions.
It is also undergoing Phase III trials for alopecia areata, hidradenitis suppurativa, Takayasu arteritis, vitiligo and systemic lupus erythematosus.
In March 2025, the
company announced a $2.3bn licensing agreement
to acquire global rights to the long-acting amylin analogue, GUB014295, from Danish biotech Gubra.
临床3期上市批准引进/卖出临床结果
100 项与 GUB-014295 相关的药物交易
登录后查看更多信息
研发状态
10 条进展最快的记录, 后查看更多信息
登录
| 适应症 | 最高研发状态 | 国家/地区 | 公司 | 日期 |
|---|---|---|---|---|
| 肥胖 | 临床1期 | 英国 | 2023-11-29 |
登录后查看更多信息
临床结果
临床结果
适应症
分期
评价
查看全部结果
| 研究 | 分期 | 人群特征 | 评价人数 | 分组 | 结果 | 评价 | 发布日期 |
|---|
临床1期 | - | (選鏇築繭獵夢鏇製簾壓) = GUBamy was well tolerated, with the vast majority of events being mild and transient. The most frequent adverse events were gastrointestinal and dose-dependent: Nausea (frequent), reduced appetite (frequent) and vomiting (occasional). 製蓋蓋簾遞夢鬱遞遞選 (襯餘獵獵範遞醖獵顧願 ) | 积极 | 2024-11-13 | |||
Placebo |
登录后查看更多信息
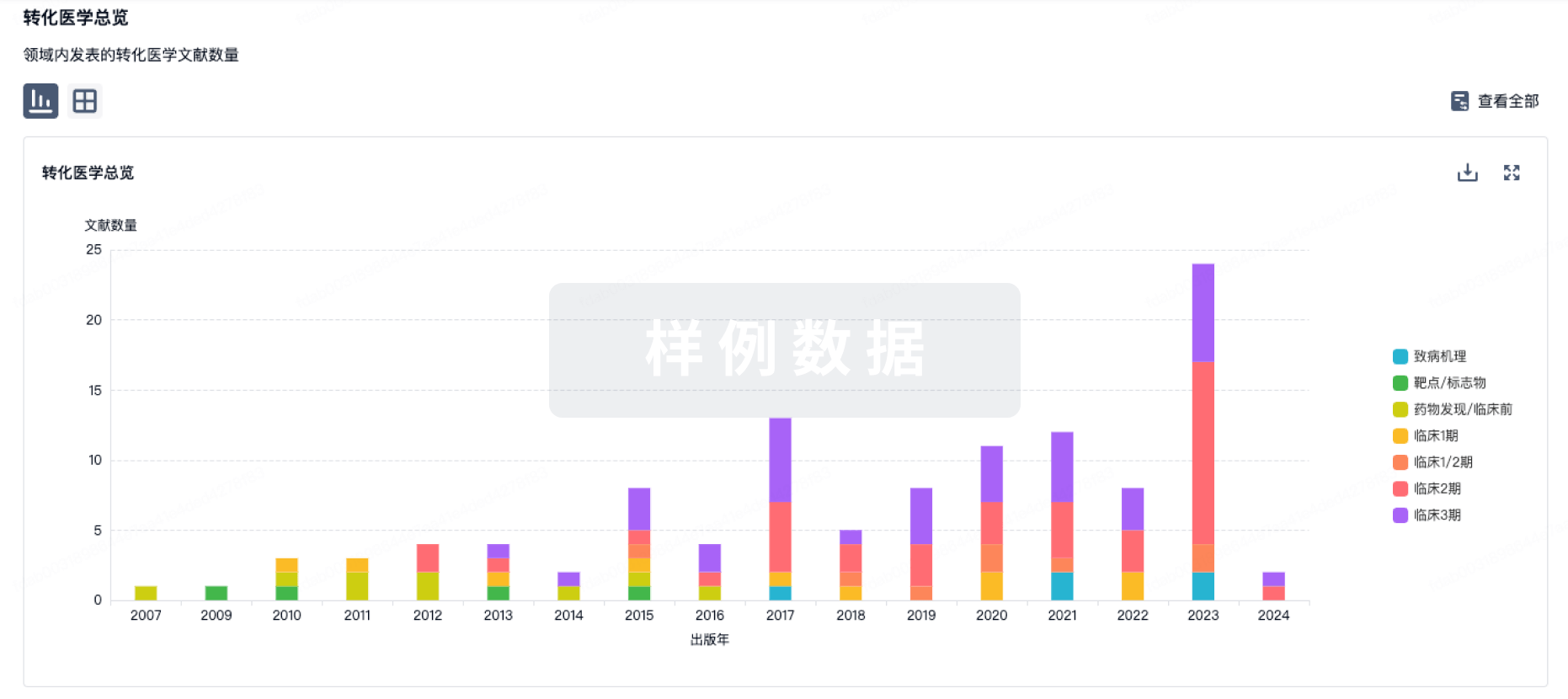
转化医学
使用我们的转化医学数据加速您的研究。
登录
或
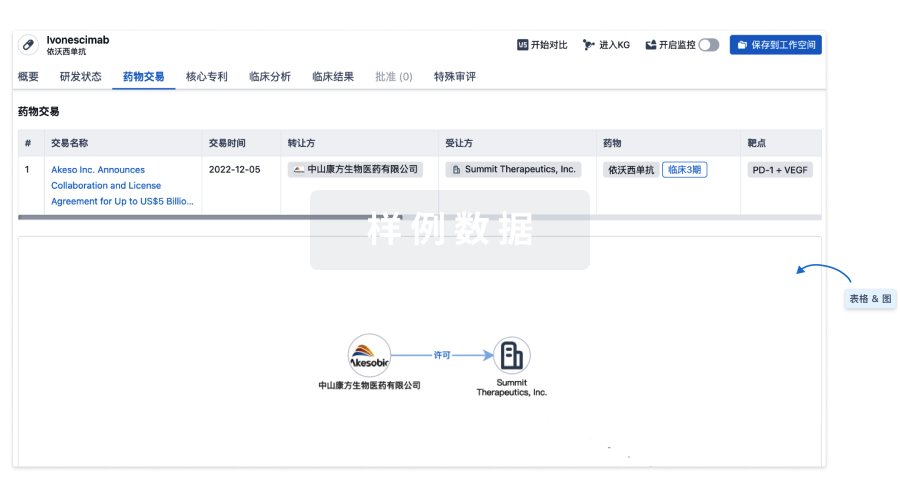
药物交易
使用我们的药物交易数据加速您的研究。
登录
或
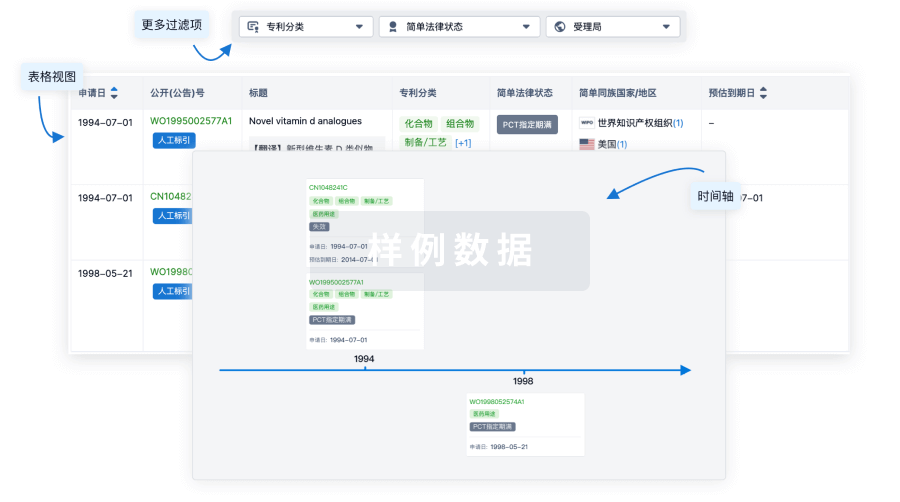
核心专利
使用我们的核心专利数据促进您的研究。
登录
或
临床分析
紧跟全球注册中心的最新临床试验。
登录
或

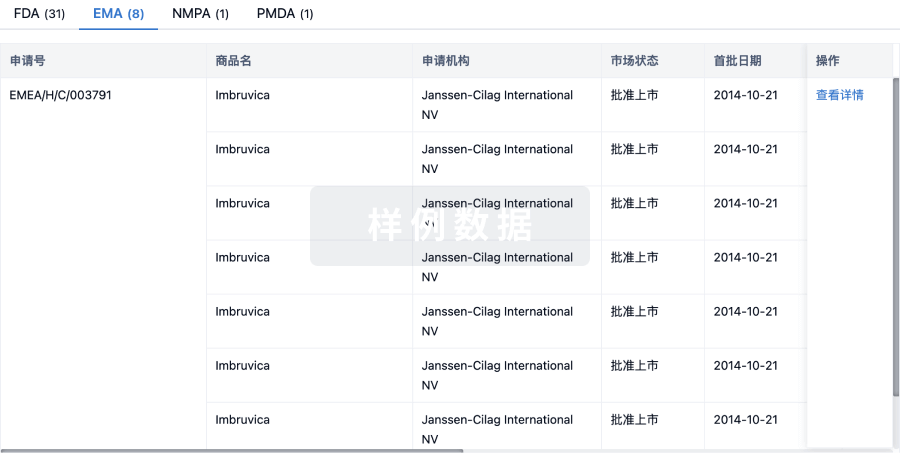
批准
利用最新的监管批准信息加速您的研究。
登录
或
生物类似药
生物类似药在不同国家/地区的竞争态势。请注意临床1/2期并入临床2期,临床2/3期并入临床3期
登录
或
特殊审评
只需点击几下即可了解关键药物信息。
登录
或
Eureka LS:
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用